 高中化学物质结构与性质 苏教版 知识点归纳.docx
高中化学物质结构与性质 苏教版 知识点归纳.docx
- 文档编号:9549089
- 上传时间:2023-02-05
- 格式:DOCX
- 页数:16
- 大小:142.92KB
高中化学物质结构与性质 苏教版 知识点归纳.docx
《高中化学物质结构与性质 苏教版 知识点归纳.docx》由会员分享,可在线阅读,更多相关《高中化学物质结构与性质 苏教版 知识点归纳.docx(16页珍藏版)》请在冰豆网上搜索。
高中化学物质结构与性质苏教版知识点归纳
[温故知新必修2专题1]微观结构与物质的多样性部分内容
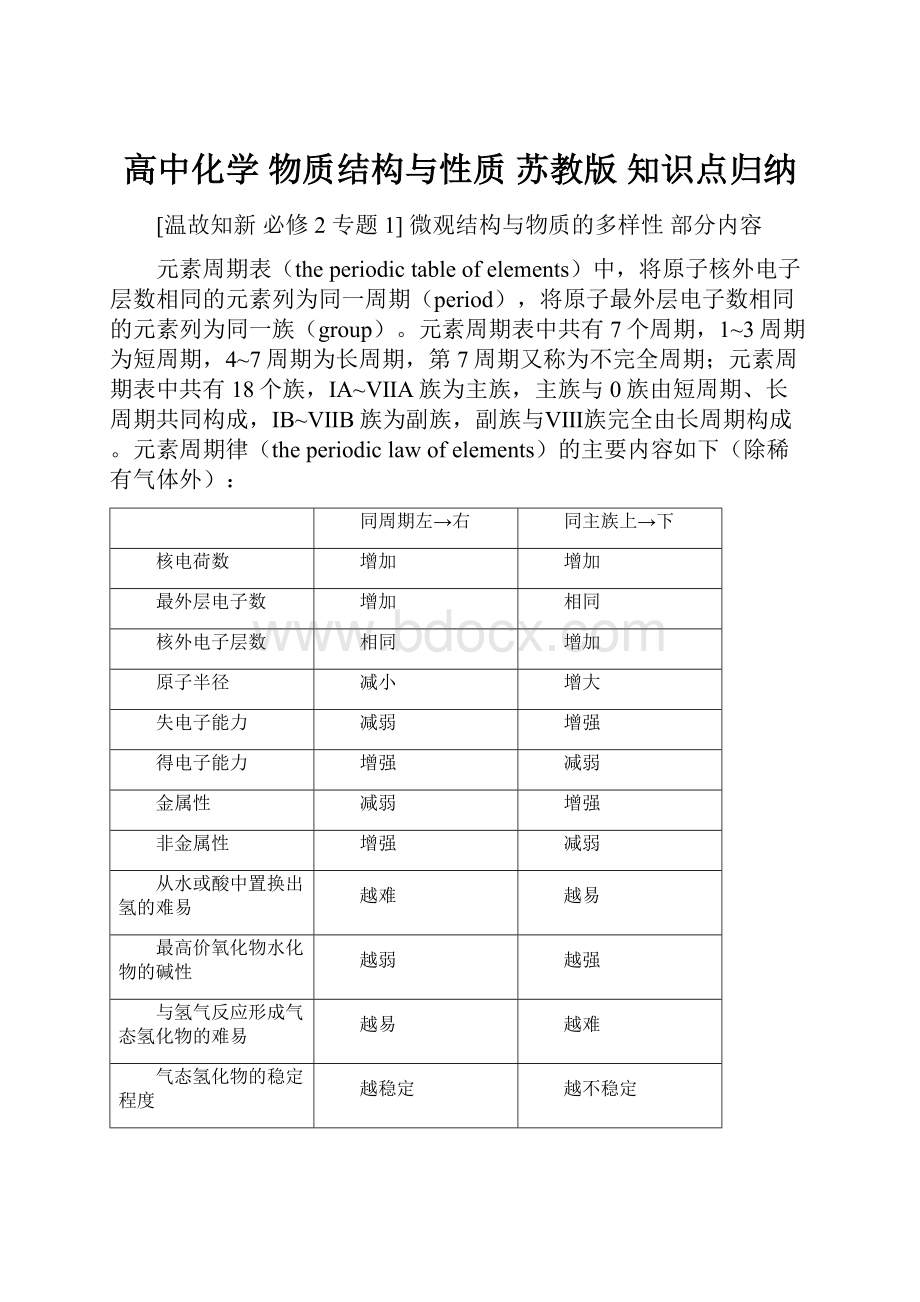
元素周期表(theperiodictableofelements)中,将原子核外电子层数相同的元素列为同一周期(period),将原子最外层电子数相同的元素列为同一族(group)。
元素周期表中共有7个周期,1~3周期为短周期,4~7周期为长周期,第7周期又称为不完全周期;元素周期表中共有18个族,ⅠA~ⅦA族为主族,主族与0族由短周期、长周期共同构成,ⅠB~ⅦB族为副族,副族与Ⅷ族完全由长周期构成。
元素周期律(theperiodiclawofelements)的主要内容如下(除稀有气体外):
同周期左→右
同主族上→下
核电荷数
增加
增加
最外层电子数
增加
相同
核外电子层数
相同
增加
原子半径
减小
增大
失电子能力
减弱
增强
得电子能力
增强
减弱
金属性
减弱
增强
非金属性
增强
减弱
从水或酸中置换出氢的难易
越难
越易
最高价氧化物水化物的碱性
越弱
越强
与氢气反应形成气态氢化物的难易
越易
越难
气态氢化物的稳定程度
越稳定
越不稳定
最高价氧化物水化物的酸性
越强
越弱
*元素周期表中,元素的相对原子质量为元素的已知各同位素按其在自然界中含量所求得的加权平均数。
通常地,主族元素的最高正化合价在数值上等于其最外层电子数,最低负化合价与其最高正化合价绝对值之和等于8,金属元素没有负化合价。
以下是短周期元素的最高正化合价及最低负化合价:
同种元素的原子或离子,随核外电子数的递增半径递增;同周期的主族元素的原子,随核电荷数的递增半径递减;同主族的元素原子或带相同电荷的离子,随核电荷数的递增半径递增;核外电子排布相同的离子,随核电荷数的递增半径递减。
以下是短周期元素的原子半径(单位:
pm):
元素周期表中,位置相近的元素性质相似,且在金属和非金属分界线附近的元素既表现出一定的金属性,又表现出一定的非金属性。
*一些元素的性质呈现出“对角线”相似性,如元素周期表中的Li与Mg、Be与Al及B与Si。
同种元素形成不同单质的现象称为同素异形现象(allotropism),这些单质互称为该元素的同素异形体(allotrope)。
相同分子式的化合物结构不同的现象称为同分异构现象(isomerism),这些化合物互称为同分异构体(isomer)。
[新知]选修3物质结构与性质
1913年,丹麦物理学家N.Bohr在Rutherford行星式原子模型的基础上,提出了新的原子结构理论:
(1)原子核外电子在有确定半径和能量的特定的原子轨道上运动,电子在运动时并不辐射能量;
(2)不同的原子轨道能量不同,原子轨道的能量变化不连续;(3)电子可在能量不同的轨道上发生跃迁。
原子核外的电子具有波粒二象性,不遵循经典力学的运动规律。
1927年,德国物理学家W.Heisenberg提出了不确定原理,认为无法同时确定电子的位置与速度,电子并没有确定的轨道。
因此,人们采用统计方法描述电子在某一位置出现的概率。
为形象表示电子在核外空间出现的概率分布情况,人们用点的疏密程度表示概率密度,这种图形称为电子云(electroncloud)图。
原子核外电子的排布与如下的一系列整数有关:
(1)主量子数(principalquantumnumber,n)表示电子所处的电子层的类型。
n的值越大则电子层离核越远,能量越高。
n=1,2,3,4,5分别可记作K、L、M、N、O。
(2)角量子数(angularquantumnumber,l)表示电子所处的原子轨道的类型。
n的值相同时,l的值越大则原子轨道能量越高。
l=0,1,2,3,4分别可记作s、p、d、f、g。
(3)磁量子数(magneticquantumnumber,m)表示原子轨道在空间的伸展方向,m可取0,±1,±2,±3。
(4)自旋量子数(spinquantumnumber,ms)表示电子自身的两种不同状态,ms=+1/2,-1/2分别可记作↑、↓。
以下是一些原子轨道的形状(从左至右为s、px、py、pz、dx2-y2、dz2):
以下是量子数、电子层、原子轨道与电子容量的关系:
电子层
K
L
M
N
电子亚层
s
s
p
s
p
d
s
p
d
f
原子轨道
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
轨道数
1
1
3
1
3
5
1
3
5
7
1
4
9
16
电子容量
2
2
6
2
6
10
2
6
10
14
2
8
18
32
原子核外电子的排布遵循如下法则:
(1)能量最低原理。
电子的排布要尽可能使整个原子处于最低的能量状态,即电子应依次进入能量较高的原子轨道。
(2)Pauli不相容原理。
每个原子轨道最多能容纳两个ms不同的电子。
(3)Hund规则。
在n与l相同的原子轨道上排布的电子,应尽可能分占m不同的原子轨道,且ms相同,这样整个原子处于最低的能量状态。
美国科学家L.Pauling总结出多电子原子轨道的近似能级图(如右图)。
这种能级图简单明了,基本反映了多电子原子核外电子按能量由低到高的填充次序。
但按这种能级图,所有元素的原子轨道能级次序都相同。
*1962年,美国化学家F.A.Cotton注意到原子轨道的能量与原子序数有关,提出了新的原子轨道能级图(如右下图),这里不再过多介绍。
根据上述规则,可写出原子的电子排布式与轨道表示式。
为避免繁复书写,可将内层电子已达到稀有气体结构的部分用[X]表示(X为稀有气体元素符号),在化学反应中,一般是原子的外围电子发生变化。
因此,描述原子核外电子排布时,也可仅写出外围电子的排布式(详细参见教材)。
1~36号元素的电子排布式如下:
从左侧表中可看出一些特殊情况。
例如,铬(Cr)原子的电子排布为[Ar]3d54s1而不是[Ar]3d44s2;铜(Cu)原子的电子排布为[Ar]3d104s1而不是[Ar]3d94s2。
这说明3d轨道处于半充满(|↑|↑|↑|↑|↑|)和全充满(|↑↓|↑↓|↑↓|↑↓|↑↓|)状态时原子是相对稳定的。
*应当指出,有些原子序数较大的过渡元素,其电子排布更为复杂,难以用上述原则来概括,如镧系、锕系中的某些元素。
*元素周期表中区块的划分如右图。
黄色部分为s区(ns1~2),蓝色部分为d区((n-1)d1~9ns1~2),绿色部分为ds区((n-1)d10ns1~2),粉红色部分为p区(ns2np1~6),橙红色部分为f区,外围电子排布较为复杂。
每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化。
某元素的气态原子失去一个电子形成+1价气态阳离子所需的最低能量,称为该元素的第一电离能(firstionizationenergy,I1)。
第一电离能越小,原子越易失电子,金属性越强。
元素的第一电离能大小与其原子的核外电子排布有关。
通常情况下,核外电子在能量相等的轨道上形成全空、半满和全满结构时,原子的能量较低,第一电离能较大。
*某元素的气态原子获得一个电子形成-1价气态负离子所需的最低能量,称为该元素的电子亲和能(electronicaffinity,A1)。
电子亲和能越小,原子越易得电子,非金属性越强。
为比较元素的原子在化合物中争夺电子的能力,美国化学家L.Pauling于1932年提出了元素的电负性(electronegavity,χP)。
电负性越小,原子争夺电子能力越弱,金属性越强。
以下是1~36号元素的第一电离能(单位:
kJ·mol-1)。
以下是1~36号元素的电负性(Pauling标度):
一般地,电负性(Pauling标度)大于1.8的元素为非金属,小于1.8的元素为金属;电负性小的元素化合价为正,电负性大的元素化合价为负;成键元素间电负性差大于1.7,形成离子键;电负性差小于1.7,形成共价键。
常温下,金属单质有许多共同的特点,如具有金属光泽,能导电传热,具有延展性等。
这些共性都是由金属晶体(metalliccrystal)的结构导致的。
金属原子的电子受核束缚较弱,在晶体内部易脱离原子,这样就形成自由电子与金属阳离子。
金属阳离子与自由电子间的强烈相互作用称为金属键(metallicbond)。
通常情况下,金属内部自由电子的运动无方向性。
但在外电场作用下,自由电子发生定向运动而形成电流,因此金属具有导电性(electricalconductivity)。
金属部分受热时,这部分自由电子能量增加,运动速率加快,与金属阳离子或原子碰撞频率增加,发生能量的传递而使整块金属达到相同温度,因此金属具有导热性(thermalconductivity)。
金属键无方向性,金属受外力时,金属原子间发生相对滑动但仍然保持金属键的作用。
因此,在一定外力的作用下金属可发生形变,具有延展性(ductility)。
一般地,金属原子半径越小,金属键键长越小,键能越大,金属键越强,金属的原子化热越大,金属晶体硬度越大,熔沸点越高。
金属晶体由能反映晶体结构特征的基本重复单位——晶胞(unitcell)在空间连续重复延伸而形成。
金属原子在平面上可有两种排列方式(a非密置层、b密置层)如右图。
在空间中,将上述两种排列方式堆积,就形成了4种基本堆积方式:
简单立方(Po)、体心立方(Na、K、Cr、Mo、W)、面心立方(Au、Ag、Cu、Pb)和六方(Mg、Zn、Ti)从左至右如右图。
离子化合物中,阴阳离子间的静电力使离子相互吸引,电子间及原子核间的静电力使离子相互排斥。
当静电引力与斥力平衡时,阴阳离子形成稳定离子键(ionicbond),整个体系能量最低。
通常地,阴阳离子及其电荷分布可看作球形对称,在空间各方向上静电作用相同,都可与异号电荷离子发生作用,在静电作用能达到的范围内,一个离子可同时吸引多个异号电荷离子。
因此,离子键无方向性与饱和性。
离子晶体(ioniccrystal)中阴阳离子间静电作用的大小以晶格能(latticeenergy,U)表示,晶格能指拆开1mol离子晶体使之形成气态阴阳离子时所需的能量。
一般地,结构相似时,成键离子半径越小,离子键键长越小,键能越大,离子键越强,晶格能越大,离子晶体硬度越大,熔沸点越高。
NaCl型(NaCl、AgBr、CaO、CsF、FeO、KCl、MgO等)与CsCl型(CsCl、AgCd、AuZn、FeTi、NH4Cl、NH4Br等)是最常见的离子晶体结构类型。
在NaCl晶体(如右上图)中,Na+或Cl-周围各排列6个异号电荷离子,每个NaCl晶胞中含4个Na+与4个Cl-,配位数为6。
在CsCl晶体(如左图)中,Cs+或Cl-周围各排列8个异号电荷离子,每个CsCl晶胞中含1个Cs+与1个Cl-,配位数为8。
离子晶体中离子配位数主要取决于阴阳离子半径比。
*一般地,阳离子半径与阴离子半径之比值越大,配位数越多。
通常地,电负性相近的原子间通过共用电子对形成共价键(covalentbond)。
若两个氢原子电子ms不同,相互靠近时随核间距减小,两个1s轨道同号重叠,核间形成一个电子概率密度较大的区域,核间引力增大,系统能量降低。
当核间距达到平衡距离(74pm)时,系统能量达到最低,这种状态称为氢分子的基态(groundstate)。
若核间距继续减小,核间斥力增大,系统能量骤升,氢原子回到平衡位置。
若两个氢原子ms相同,相互靠近时两个1s轨道异号重叠,核间形成一个电子概率密度较小的区域,核间斥力增大,系统能量升高,处于不稳定状态,这种状态称为氢分子的排斥态(repulsivestate),不可能形成稳定的氢分子。
因此,共价键形成本质上是:
当成键原子相互靠近时,原子轨道重叠,ms不同的未成对电子形成共用电子对,核间电子概率密度增加,系统能量降低。
右图为氢分子形成过程中能量随核间距的变化曲线以及电子概率密度的同号重叠与异号重叠示意。
(4)
(3)
(2)
(1)
成键过程中,每个原子有几个未成对电子,常就只能与几个ms不同的未成对电子形成共价键,这是共价键的饱和性。
成键过程中,两个原子常只能沿一定方向成键以达到原子轨道最大程度的重叠,这是共价键的方向性。
几种稳定的重叠方式如右图。
根据原子轨道重叠方式的不同,共价键可分为σ键与π键。
原子轨道沿核间连线方向进行同号重叠形成σ键,例如右图中
(1)
(2)(3);原子轨道沿垂直于核间连线方向平行进行同号重叠形成π键,例如右图中(4)。
通常地,单键中有一个σ键,双键中有一个σ键与一个π键,叁键中有一个σ键与两个π键。
*[Re2Cl8]2-中两个Re原子间的四重键中含有δ键,U2中U—U键中含有φ键,这里不再过多介绍。
根据成键原子共用电子对是否发生偏移,共价键可分为极性键(polarbond)与非极性键(non-polarbond)。
成键原子电负性相同时,共用电子对不发生偏移,形成非极性键;成键原子电负性不同时,共用电子对发生偏移,形成极性键。
一般地,电负性差越大,共用电子对偏移程度越大,共价键极性越强。
*键的极性大小可用键矩(bondmoment)衡量。
键矩为矢量,方向由正电荷重心指向负电荷重心。
键矩值越大,键极性越强。
键矩(μ)、正或负电荷重心所带电量(q)、正负电荷重心间距离(l,通常取键长)的关系如下:
μ=ql
由一个原子提供一对电子与另一个接受电子的原子形成的共价键称为配位键(coordinationbond),如NH4+、CO、[Cu(NH3)4]2+中都含有配位键。
形成配位键需满足两个条件:
提供共用电子对的原子中存在孤对电子;接受共用电子对的原子中存在空轨道。
成键原子核间的平均距离称为键长(bondlength),断裂气态分子的共价键形成气态原子过程中吸收的能量称为键能(bondenergy),分子中两个σ键间夹角称为键角(bondangle)。
键能可用于描述共价键的强度。
一般地,原子轨道重叠程度越大,键长越短,键能越大。
化学反应中,若键断裂吸收的能量大于键形成放出的能量,该反应通常吸热,反之通常放热。
所有原子间通过共价键结合直接形成的晶体称为原子晶体(atomiccrystal)。
一般地,结构相似时,成键原子半径越小,共价键键长越小,键能越大,共价键越强,原子晶体硬度越大,熔沸点越高。
分子间存在较弱的相互作用称为分子间作用力(intermolecularforce)。
大量分子通过分子间作用力结合形成分子晶体(molecularcrystal)。
范德华力(vanderWaal’sforce)与氢键(hydrogenbond)是两种常见的分子间作用力。
范德华力一般无饱和性与方向性,*包括取向力(orientationforce)、诱导力(inductionforce)与色散力(dispersionforce)。
当H原子与电负性大而半径较小的原子X以共价键结合时,H原子能与另一个电负性大而半径较小的原子Y间形成氢键,因此氢键常用X—H…Y表示。
氢键既能存在于分子间也能存在于分子内,具有饱和性与方向性,比化学键弱但比范德华力强。
由于H原子体积小,为减少X与Y的斥力,它们尽量远离使键角接近180°,这是氢键的方向性。
又由于H原子体积小,它接触体积较大的X、Y时,另一较大原子就难以再向它靠近,这是氢键的饱和性。
一般地,结构相似时,分子质量越大,分子间作用力越大,物质的熔沸点越高;结构不相似而分子质量相似时,分子极性越大,分子间作用力越大,物质的熔沸点越高;含氢键的物质熔沸点反常的高,分子内含氢键的物质熔沸点较低;构成物质的分子与溶剂分子间作用力越大,溶解度越大。
通常地,离子晶体熔沸点较高,硬度较大;原子晶体熔沸点高,硬度大;分子晶体熔沸点较低,硬度较小;金属晶体熔沸点与硬度差异较大。
为解释多原子分子的几何构型,L.Pauling于1931年提出了杂化轨道理论(hybridizationofatomicorbitals),进一步发展了价键理论。
在形成CH4分子的过程中,碳原子中有一个电子从2s轨道激发到2p空轨道上。
这样,1个2s轨道与3个2p轨道“混合”形成4个sp3杂化轨道。
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。
这样,碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠形成4个σ键,从而形成CH4分子。
CH4分子中C—H键间夹角均为109.5°。
在形成BF3分子的过程中,硼原子中有一个电子从2s轨道激发到2p空轨道上。
这样,1个2s轨道与2个2p轨道“混合”形成3个sp2杂化轨道。
硼原子中3个sp2杂化轨道间夹角为120°,这3个sp2杂化轨道分别与氟原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
在形成BeCl2分子的过程中,铍原子中有一个电子从2s轨道激发到2p空轨道上。
这样,1个2s轨道与1个2p轨道“混合”形成2个sp杂化轨道。
铍原子中2个sp杂化轨道间夹角为180°,这2个sp杂化轨道分别与氯原子的3p轨道形成σ键,因此BeCl2分子为直线形结构。
为推测分子的空间构型,N.V.Sidgwick与H.M.Powell于1940年提出了价层电子对互斥理论(ValenceShellElectronPairRepulsion,VSEPR)。
该理论认为:
分子中的价电子对(包括成键电子对与孤电子对)由于相互排斥,趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
具有相同价电子对数的分子,中心原子的杂化轨道类型相同,价电子对空间构型相同。
若分子中中心原子的杂化轨道上存在孤电子对,由于孤电子对比成键电子对更靠近中心原子核,因而价电子对间斥力大小次序为:
孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对
且随孤电子对数增多,成键电子对—成键电子对间斥力减小,键角减小。
对于ABm型分子或离子(A为中心原子,B为配位原子),分子或离子的价电子对数VPN可通过下式确定:
VPN=
(中心原子的价电子数+配位原子总共提供的价电子数
所带电荷数)
式中,中心原子的价电子数等于中心原子的最外层电子数;考虑每个配位原子提供的价电子数时,每个氢原子或卤素原子提供1个价电子,每个氧原子或硫原子提供0个价电子。
部分价电子对数、价电子对空间构型、中心原子的杂化轨道类型、分子类型、孤电子对数、分子空间构型及例子如下(模型中黄色小球表示孤电子对):
价电子对数
价电子对空间构型
中心原子的杂化轨道类型
分子类型
孤电子对数
分子空间构型
例子
2
直线形
sp
AX2
0
直线形
BeCl2,CO2,NO2+
3
三角形
sp2
AX3
0
三角形
BF3,SO3,CO32-
AX2
1
V形
SnCl2,O3,NO2-
4
四面体
sp3
AX4
0
四面体
CH4,CCl4,NH4+,SO42-
AX3
1
三角锥
NH3,NF3,SO32-
AX2
2
V形
H2O,OF2,ClO2-
具有相同价电子数与相同原子数的分子或离子具有相同的结构特征,这一原理称为等电子原理(isoelectronicprinciple)。
分子呈电中性,分子中有正电荷(各原子核)与负电荷(各电子)。
类似物体的重心,任何分子都有一个正电荷重心与负电荷重心。
这两个重心不重合的分子称为极性分子(polarmolecule),这两个重心重合的分子称为非极性分子(non-polarmolecule)。
双原子分子的极性取决于成键原子间共价键是否有极性。
多原子分子的极性取决于分子的空间构型。
如CO2、BF3、CH4等分子,虽然成键原子间共价键均为极性键,但由于配位原子对称地分布在中心原子周围,因此整个分子正负电荷重心重合,因此这些分子为非极性分子。
*分子极性的强弱可用偶极矩(dipolemoment)来衡量。
偶极矩为矢量,方向由正电荷重心指向负电荷重心。
偶极矩值越大,分子极性越强。
偶极矩(μ)、正或负电荷重心所带电量(q)、正负电荷重心间距离(d)的关系如下:
μ=qd
一般地,极性分子溶质易溶于极性分子溶剂,非极性分子易溶于非极性分子溶剂。
这称为相似相溶规则(likedissolvesliketheory)。
若一对分子,其组成与原子排列方式完全相同,但如同左手和右手互为镜像而不能在三维空间中重叠,这对分子互称为手性异构体(chiralisomer)。
有手性异构体的分子称为手性分子(chiralmolecule)。
*其中能使平面偏振光逆时针旋转的称为左旋异构体(laevoisomer),能使平面偏振光顺时针旋转的称为右旋异构体(dextroisomer)。
当4个不同的原子或基团连接在碳原子上时,形成的分子为手性分子。
其中,4个不同的原子或基团所连接的碳原子称为手性碳原子(chiralcarbonatom)。
氨基酸分子的手性异构体如右图所示。
在水溶液中,Cu2+与NH3结合为[Cu(NH3)4]2+的过程如下:
NH3中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3中氮原子通过共用氮原子提供的电子对形成配位键。
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物(coordinationcompound)。
在[Cu(NH3)4]SO4中,内界为[Cu(NH3)4]2+,外界为SO42-,Cu2+为中心原子,NH3中N为配位原子,NH3为配位体,Cu2+的配位数为4。
Fe3+、Cu2+、Zn2+、Ag+等具有空轨道的过渡金属离子或原子常作为中心原子,H2O、NH3、CO等含孤电子对的中心分子及F-、Cl-、CN-等含孤电子对的离子常作为配位体。
含两种或以上配位体的配合物,若配位体在空间排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2有顺式与反式两种异构体,性质上存在一定差异,如右图(左为顺式,右为反式)。
部分配位数、中心原子的杂化轨道类型、空间构型、例子如下:
配位数
中心原子的杂化轨道类型
空间构型
例子
2
sp
直线形
[Ag(NH3)2]+、[Cu(NH3)2]+、
[Ag(CN)2]-
4
sp3
四面体
[BeF4]2-、[HgCl4]2-、[Zn(NH3)4]2+
dsp2
平面正方形
[Ni(CN)4]2-、
[PtCl2(NH3)2]、
[PdCl4]2-、[AuCl4]-
6
d2sp3,sp3d2
八面体
[Co(NH3)6]3+、[Fe(CN)6]3-、[SiF6]2-、[AlF6]3-、[PtCl6]2-
配合物在许多方面有广泛应用。
在实验研究中,人们常用形成配合物的方法来检验离子、分离物质、定量测定物质组成;在生产中,配合物被广泛应用于染色、电镀、硬水软化、冶金领域;在许多尖端研究领域如激光材料、超导材料、抗癌药物研究、催化剂研制等方面,配合物发挥的作用也越来越大。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 物质结构与性质 苏教版 知识点归纳 物质 结构 性质 知识点 归纳
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《Java程序设计》考试大纲及样题试行.docx
《Java程序设计》考试大纲及样题试行.docx
