 届高考化学第一轮复习讲练测试题23.docx
届高考化学第一轮复习讲练测试题23.docx
- 文档编号:8048571
- 上传时间:2023-01-28
- 格式:DOCX
- 页数:26
- 大小:187.17KB
届高考化学第一轮复习讲练测试题23.docx
《届高考化学第一轮复习讲练测试题23.docx》由会员分享,可在线阅读,更多相关《届高考化学第一轮复习讲练测试题23.docx(26页珍藏版)》请在冰豆网上搜索。
届高考化学第一轮复习讲练测试题23
第二讲离子反应离子共存及检验
1、了解电解质的概念。
了解强电解质和弱电解质的概念。
2、了解离子反应的概念、离子反应发生的条件。
3、了解电解质在水溶液中的电离以及电解质溶液的导电性。
4、能正确书写化学方程式和离子方程式,并能进行有关计算。
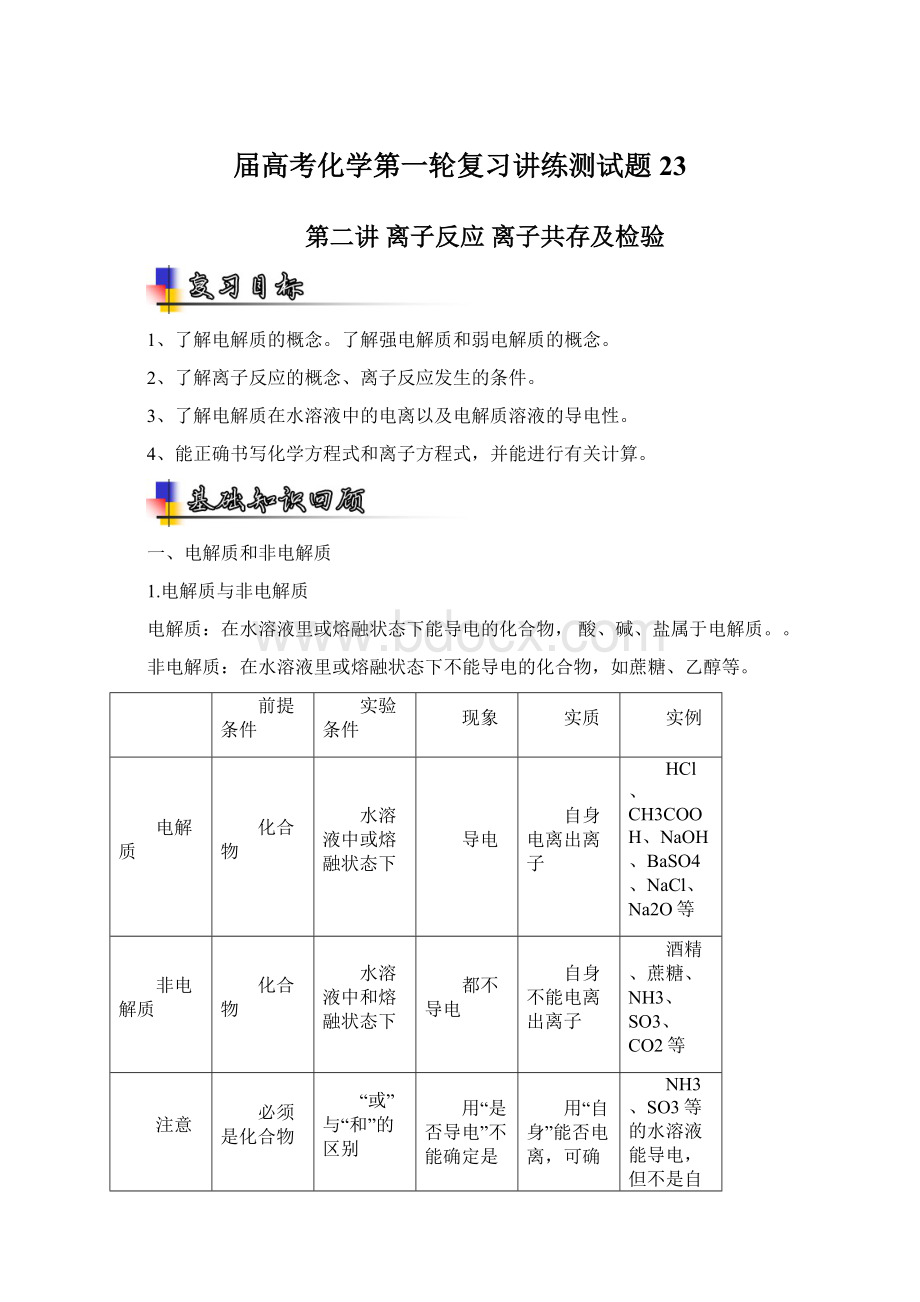
一、电解质和非电解质
1.电解质与非电解质
电解质:
在水溶液里或熔融状态下能导电的化合物,酸、碱、盐属于电解质。
。
非电解质:
在水溶液里或熔融状态下不能导电的化合物,如蔗糖、乙醇等。
前提条件
实验条件
现象
实质
实例
电解质
化合物
水溶液中或熔融状态下
导电
自身电离出离子
HCl、CH3COOH、NaOH、BaSO4、NaCl、Na2O等
非电解质
化合物
水溶液中和熔融状态下
都不导电
自身不能电离出离子
酒精、蔗糖、NH3、SO3、CO2等
注意
必须是化合物
“或”与“和”的区别
用“是否导电”不能确定是否为(非)电解质
用“自身”能否电离,可确定是否为(非)电解质
NH3、SO3等的水溶液能导电,但不是自身电离而导电,所以是非电解质
【易错警示】
(1)电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。
(2)化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。
如:
SO2、SO3、CO2、NO2等。
(3)常见电解质的范围:
酸、碱、盐、离子型氧化物。
(4)溶剂化作用:
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
2.强电解质和弱电解质
强电解质:
在溶液中能够全部电离的电解质。
则强电解质溶液中不存在电离平衡。
弱电解质:
在溶液中只是部分电离的电解质。
则弱电解质溶液中存在电离平衡。
强电解质
弱电解质
定义
溶于水后几乎完全电离的电解质
溶于水后只有部分电离的电解质
化合物类型
离子化合物及具有强极性键的共价化合物
某些具有弱极性键的共价化合物。
电离程度
几乎100%完全电离
只有部分电离
电离过程
不可逆过程,无电离平衡
可逆过程,存在电离平衡
溶液中存在的微粒(水分子不计)
只有电离出的阴阳离子,不存在
电解质分子
既有电离出的阴阳离子,又有电解质分子
实例
绝大多数的盐(包括难溶性盐)
强酸:
H2SO4、HCl、HClO4等
强碱:
Ba(OH)2Ca(HO)2等
弱酸:
H2CO3、CH3COOH等。
弱碱:
NH3·H2O、Cu(OH)2Fe(OH)3等。
电离方程式
KNO3=K++NO
H2SO4=2H++SO
NH3·H2O
NH
+OH_
H2S
H++HS_HS-
H++S2-
【注意】
(1)强、弱电解质的范围:
强电解质:
强酸、强碱、绝大多数盐
弱电解质:
弱酸、弱碱、水
(2)强、弱电解质与溶解性的关系:
电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。
一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。
如:
BaSO4、BaCO3等。
(3)强、弱电解质与溶液导电性的关系:
溶液的导电性强弱与溶液中的离子浓度大小有关。
强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。
而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
(4)强、弱电解质与物质结构的关系:
强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。
(5)强、弱电解质在熔融态的导电性:
离子型的强电解质由离子构成,在熔融态时产生自由移动的离子,可以导电。
而共价型的强电解质以及弱电解质由分子构成,熔融态时仍以分子形式存在,所以不导电。
二、电离与电离方程式的书写
1.概念
电解质在水溶液中或熔融状态下离解成自由移动离子的过程。
2.电离方程式书写方法
(1)强电解质:
完全电离,用===表示。
如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SO
、NaOH===Na++OH-、(NH4)2SO4===2NH
+SO
。
(2)弱电解质:
部分电离,用“
”表示。
①多元弱酸分步电离,且电离程度逐步减弱,以第一步电离为主。
如H2S的电离方程式为H2S
H++HS-;HS-
++S2-。
②多元弱碱分步电离,但一步写出。
如Cu(OH)2
Cu2++2OH-。
③两性氢氧化物双向电离。
如Al(OH)3的电离方程式:
H++AlO
+H2O
Al(OH)3
Al3++3OH-。
(3)酸式盐:
①强酸酸式盐完全电离,一步写出。
如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SO
,
在熔融状态下的电离方程式为NaHSO4===Na++HSO
。
②多元弱酸酸式盐,第一步完全电离,其余部分电离。
如NaHCO3===Na++HCO
,HCO
H++CO
。
3.金属导电与电解质溶液导电原因对比
(1)金属导电是由于自由电子在电场作用下的定向移动,温度高、金属阳离子振动幅度大,自由电子定向移动阻力增大,金属导电性变弱。
(2)电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。
电解质溶液导电能力的大小,决定于溶液中自由移动离子的浓度和离子的电荷数,和电解质的强弱没有必然联系。
但温度升高时,弱电解质电离程度增大、离子浓度增大、导电性会增强。
【典型例题1】【黑龙江实验2019届上期中】下列说法错误的是()
①强电解质溶液的导电性比弱电解质溶液的导电性强
②BaSO4投入水中,导电性较弱,故它是弱电解质
③弱电解质水溶液中至少存在两种共价化合物分子
④强电解质都是离子化合物,弱电解质都是共价化合物
⑤CaO是强电解质,是因为它的水溶液能导电⑥Cl2的水溶液能导电,所以Cl2是电解质
A.①②④⑤⑥B.①③⑤C.②④⑥D.③⑤⑥
【点评】判断电解质强弱的注意点:
1、电解质的强弱与物质内部结构决定的,与任何外界因素无关。
2、电解质的强弱与其溶解度无关,某些盐如硫酸钡难溶于水,但溶于水的部分完全电离,所以是强电解质。
能溶于水的物质不一定是强电解质,例如醋酸等,电离程度很小,属于弱电解质。
3、电解质溶液之所以导电,是由于溶液中有自由移动的离子存在,电解溶液的导电能力的大小,决定于溶液中自由移动的离子的浓度和离子的电荷数,和电解质的强弱没有必然的联系。
【迁移训练1】【江西临川一中2019届10月月考】在氢硫酸溶液中,通入或加入少量的下列物质:
①O2;②Cl2;③SO2;④CuSO4;⑤NH3能使溶液的导电能力增强的是()
A.①②③B.②④⑤C.①④⑤D.②③④
【典型例题2】写出下列典型物质的电离方程式
(1)H2SO4________________________________________________________________;
(2)H2CO3________________________________________________________________;
(3)NaHSO4______________________________________________________________;
(4)NaHCO3______________________________________________________________;
(5)NaHSO4(熔融)________________________________________________________;
(6)Al2O3(熔融)__________________________________________________________。
【点评】在书写电离方程式的过程中一定要区分强弱电解质,弱电解质为部分电离,多元弱酸为分步电离;还要注意区分多元酸的酸式酸根的电离与水解的区别。
【迁移训练2】下列物质在指定条件下电离方程式正确的是()
A.Na2CO3溶于水 Na2CO3===Na
+CO
B.Al(OH)3酸式电离 Al(OH)3===H++AlO
+H2O
C.NaHS溶于水HS-的电离 HS-+H2O
H2S+OH-
D.NaHCO3加热熔化 NaHCO3===Na++HCO
二、离子反应和离子方程式
1、离子反应
(1)概念
凡有离子参加或生成的反应都是离子反应,其本质是向着离子浓度减少的方向进行,发生反应的条件为生成沉淀、气体、弱电解质以及发生氧化还原反应。
(2)离子反应发生的条件
①复分解反应类型:
②氧化还原反应类型:
强氧化性物质+强还原性物质―→弱氧化性物质+弱还原性物质。
如FeCl3溶液与Cu反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。
3、离子方程式及书写
(1)离子方程式:
用实际参加反应的离子符号来表示离子反应的式子.所谓实际参加反应的离子,即是在反应前后数目发生变化的离子。
离子方程式不仅表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
如:
H++OH-=H2O可以表示强酸与强碱反应生成可溶性盐的中和反应。
(2)离子方程式书写步骤
书写离子方程式按照“一写、二改、三消、四查”的步骤书写。
应注意的是,第二步“改”是关键:
把易溶于水、易电离的物质拆写成离子形式,难溶、难电离、气体、单质、氧化物等仍用化学式表示
①没有自由移动离子参加反应,不能写离子方程式
②单质、氧化物、弱电解质、难溶物在离子方程式中一律写化学式,如SO2与NaOH溶液反应的离子方程式:
SO2+2OH-=SO
+H2O,生石灰与盐酸反应离子方程式:
CaO+2H+=Ca2++H2O,锌与醋酸溶液反应离子方程式:
Zn+2HAC=Zn2++2AC—+H2↑
③弱酸及多元弱酸的酸式酸根离子不能拆开写,如NaHS溶液与NaOH溶液反应:
HS-+OH-=S2-+H2O,NaHCO3溶液与盐酸反应:
HCO
+H+=H2O+CO2↑
【规律小结】离子方程式书写中的一般规律
(1)易溶、易电离的物质(强酸、强碱、可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体、单质、氧化物均以化学式表示。
(2)离子方程式中,浓硫酸不能拆写成离子形式,而浓硝酸、浓盐酸要拆写成离子形式,多元弱酸的酸式酸根不能拆写成离子形式,如NaHCO3不能拆写成“Na++H++CO
”。
(3)拆写时,微溶物的澄清溶液要写成离子形式,呈浑浊状态或沉淀时要写成化学式,如在离子方程式中澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
(4)氨水作为反应物写为NH3·H2O,作为生成物,若有加热条件或浓度很大时,写为“NH3↑+H2O”。
(5)检查“===”“”“↓”“↑”及必要条件是否正确、齐全,离子方程式应遵循质量守恒、电荷守恒。
【典型例题3】【百强校·2019届邯郸一中第七次月考】下列表示对应化学反应的离子方程式正确的是()
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.5molFe和4molCl2反应:
5Cl2+4Fe
2FeCl2+2FeCl3
C.向Ca(ClO)2 溶液中通入过量的 SO2:
C1O-+SO2+H2O=HClO+HSO3-
D.FeSO4酸性溶液中加H2O2:
2Fe2++H2O2=2Fe3++2OH-
【点评】离子方程式正误判断是高考高频知识点,解这类题主要是从以下几个方面考虑:
①反应原理,如:
铁与盐酸或稀硫酸反应只生成二价铁;三氯化铝溶液与碳酸钠溶液混合发生的是双水解反应,而不是复分解反应;Mg2+遇OH-和CO32-时更宜生成的是Mg(OH)2沉淀等。
②电解质的拆分,化学反应方程式改写为离子方程式时只有强酸、强碱及可溶性盐可以改写成完全电离形式,如NaHCO3只能改写成Na+和HCO3-。
③配平,离子方程式的配平不能简单的满足原子守恒,而应该优先满足电子守恒、电荷守恒及原子守恒。
④注意反应物的用量对离子反应的影响,选项C为易错选项。
【迁移训练3】【百强校·2019届滕州一中12月月考】下列解释物质用途或现象的反应方程式不准确的是()
A.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO-3+Ba2++2OH-=BaCO3↓+2H2O+CO32-
B.Fe(NO3)3溶液中加入过量的HI溶液;2Fe3++2I-=2Fe2++I2
C.Na2S203溶液中加入稀硫酸:
S2O32-+2H+=SO2+S↓+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:
Cl-+ClO-+2H+=Cl2↑+H2O
三、离子共存
发生下列反应而不能大量共存的情况:
1、发生复分解反应。
(1)生成难溶物或微溶物:
如:
Ba2+与CO
,Ag+与Br-,Ca2+与SO
等不能大量共存。
(2)生成气体或挥发性物质:
如:
NH
与OH-,H+与CO
、HCO
、S2-、HS-、SO
、HSO
等不能大量共存。
(3)生成难电离物质:
如:
H+与CH3COO-、CO
、S2-、SO
等因生成弱酸不能大量共存;OH-与NH4+因生成的弱碱不能大量共存;H+与OH-生成水不能大量共存。
2、发生氧化还原反应:
氧化性离子(如Fe3+、NO
、ClO-、MnO
(H+)等)与还原性离子(如S2-、I-、Fe2+、SO
等)不能大量共存。
3、离子间发生水解相互促进不能共存:
弱酸对应的阴离子和弱碱对应的阳离子相互促进双水解进行到底。
如Al3+、Fe3+、NH
与CO
、HCO
、S2-、HS-、AlO
等。
4、络合反应:
如Fe3+和SCN-。
【典型例题4】【百强校·2019届沙市第一次模拟】在下列各溶液中,离子可能大量共存的是()
A.无色的碱性溶液中:
CrO42﹣、K+、Na+、SO42﹣
B.含有大量ClO﹣的溶液中:
K+、H+、I﹣、SO42
C.使pH试纸变红的溶液中:
NH4+、Na+、SO42﹣、Cl﹣
D.水电离产生的c(H+)=10﹣12mol•L﹣1的溶液中:
Na+、Fe2+、SO42﹣、NO3﹣
【点评】关于离子能否大量共存的问题首先应注意题目所给的附件条件,常见附件条件有:
(1)无色透明溶液;
(2)由水电离的氢离子、氢氧根离子浓度;(3)与Al反应生成H2的溶液;(4)使指示剂呈现某种颜色;(5)如“一定”、“可能”等。
关于离子能否共存的判断,关键在于首先要搞清楚溶液中的各种离子为何种性质的离子;其次判断该反应的实质是否是离子反应,最后再判断离子间发生哪些反应,在一定条件下离子间又发生哪些反应。
【迁移训练4】【百强校·2019届山东省实验一模】下列有关离子组的评价及相关离子方程式均正确的是()
离子组
评价及离子方程式
A
H+、Fe2+、NO3-、Cl-
不能大量共存于同一溶液中,因为发生反应:
2Fe2++2H+═2Fe3++H2↑
B
Na+、K+、HCO3-、OH-
不能大量共存于同一溶液中,因为发生反应:
HCO3-+OH-═H2O+CO2↑
C
Ca2+、NH4+、CO32-、Cl-
能大量共存于同一溶液中
D
Na+、NH4+、SO42-、Cl-
能大量共存于同一溶液中
四、离子检验与推断
(一)离子的检验
1、常见的阳离子的检验
(1)常规检验法
①用NaOH溶液能检验出Cu2+、Fe3+、Fe2+、Al3+、NH4+
Cu2+:
产生蓝色沉淀
Fe3+:
产生红褐色沉淀
Fe2+:
先产生白色沉淀,然后迅速变成灰绿色,最终变成红褐色
Al3+:
产生白色沉淀,继续加入NaOH溶液,白色沉淀又会迅速消失
NH4+:
共热,生成使湿润的红色石蕊试纸变蓝的气体
②焰色反应
用焰色反应可以检验溶液中的K+和Na+。
K+:
火焰呈紫色(透过蓝色钴玻璃)
Na+:
火焰呈黄色
(2)特殊检验法
Fe3+:
加入KSCN溶液呈红色
Fe2+:
加入KSCN溶液无现象,滴加新制氯水后溶液呈红色。
2、常见阴离子的检验
(1)利用酸碱指示剂检验
OH-:
滴入酚酞试液,溶液变红色
滴入紫色石蕊试液,溶液变蓝色
(2)利用盐酸和其他试剂检验
CO
:
①加入BaCl2溶液后生成白色沉淀,再加稀盐酸沉淀溶解,并放出无色无味气体
②加入稀盐酸后,放出能使澄清石灰水变浑浊的无色无味的气体
SO
:
先加入稀盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀
SO
:
加入BaCl2溶液,产生白色沉淀,再加入稀盐酸,放出无色有刺激性气味,能使品红溶液褪色的气体
(3)利用AgNO3(HNO3酸化)溶液检验
Cl-:
生成不溶于稀硝酸的白色沉淀
Br-:
生成不溶于稀硝酸的浅黄色沉淀
I-:
生成不溶于稀硝酸的黄色沉淀
(4)利用某些特征反应检验
I-:
滴入淀粉溶液和氯水,溶液变蓝色
(二)、离子的推断
利用离子反应进行物质的推断是推断题中的一种重要题型,它既考查了常见离子的典型性质,又考查了考生的推断能力。
这类试题常将物质拆分为离子,通过实验并根据其现象推断出相关物质。
解答此类试题,易出现一错全错的连锁错误,因此,解答的关键是依据题目表述的现象和离子的性质,初步推出可能的物质,然后逐步分析,从而得出正确的结果。
【典型例题5】【百强校·2019届上杭县第一12月月考】某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种。
向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
A.一定有S2-、SO32-、Na+B.一定没有Ag+、Al3+
C.可能只有Na+、S2-、CO32-D.一定有Na+、S2-、NO3
【点评】掌握离子性质的反应现象是解题关键,溶液中加入稀盐酸,浅黄色沉淀和气体出现,SO32-、S2-存在或者NO3-、S2-存在加入盐酸可以生成沉淀硫;出现气体可能是S2-、CO32-、SO32-离子结合氢离子生成硫化氢气体、二氧化碳气体、二氧化硫气体;溶液的焰色为黄色,则含有Na+;推断一定不含银离子,若含有银离子,则S2-、CO32-、SO32-离子都不能存在,依据离子共存判断Al3+一定不存在,所以溶液中一定含有Na+、S2-离子,S2-、CO32-、SO32-、NO3-离子可能含有。
【迁移训练5】【百强校•2019届陕西省西藏民族学院附中期末】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成.
②另取少量原溶液,逐滴加入5mL0.2mol•L-1盐酸,发生的现象是:
开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D.可能含有Cl-
考点一:
离子方程式的书写
离子方程式的书写时高考的重点和难点,特别是与用量有关的反应方程式的书写、正误的判断及其应用。
解决此类问题的难点在量的关系及进行的配平。
在解决过程中可按照其成因进行分类,了解其原理,届可以顺利解决。
1、连续型反应
指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。
如CO2通入NaOH溶液中,先生成碳酸盐,再生成酸式盐:
①碱过量(CO2少量):
CO2+2OH-===CO
+H2O;
②碱不足(CO2过量):
CO2+OH-===HCO
。
(2)多元弱酸(或其酸酐)与更弱酸的盐溶液。
如CO2通入NaAlO2溶液中,先生成碳酸盐,再生成酸式盐:
①NaAlO2过量(CO2少量):
2AlO
+CO2+3H2O===2Al(OH)3↓+CO
;
②NaAlO2不足(CO2过量):
AlO
+CO2+2H2O===Al(OH)3↓+HCO
。
(3)多元弱酸盐与强酸反应。
如Na2CO3溶液与稀盐酸,先反应生成酸式盐,然后生成二氧化碳:
盐酸不足:
CO
+H+===HCO
;
盐酸过量:
CO
+2H+===CO2↑+H2O。
(4)铝盐溶液与强碱溶液,如在铝盐中滴入强碱,先生成氢氧化铝沉淀,然后溶解生成偏铝酸根:
铝盐过量(NaOH少量):
Al3++3OH-===Al(OH)3↓;
强碱过量(NaOH过量):
Al3++4OH-===AlO
+2H2O。
(5)NaAlO2溶液与强酸溶液,在偏铝酸盐中滴加强酸,先生存氢氧化铝,然后溶解,生成铝离子:
NaAlO2过量:
AlO
+H++H2O===Al(OH)3↓;
强酸过量:
AlO
+4H+===Al3++2H2O。
(6)Fe与稀HNO3溶液,在硝酸中逐渐加入铁,先生存三价铁,铁过量,生成二价铁:
Fe过量:
3Fe+2NO
+8H+===3Fe2++2NO↑+4H2O;
HNO3过量:
Fe+NO
+4H+===Fe3++NO↑+2H2O。
2、先后型反应:
一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。
又可称为竞争型。
NH4HSO4溶液与NaOH溶液的反应:
(H+先于NH
发生反应)
NaOH不足:
H++OH-===H2O;
NaOH过量:
NH
+H++2OH-===NH3·H2O+H2O。
3、配比型反应:
当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足)而跟用量有关。
(1)Ca(HCO3)2溶液与NaOH溶液:
NaOH不足:
Ca2++HCO
+OH-===CaCO3↓+H2O;
NaOH过量:
Ca2++2HCO
+2OH-===CaCO3↓+2H2O+CO
。
(2)NaHSO4溶液与Ba(OH)2溶液
溶液呈中性时:
2H++SO
+2OH-+Ba2+===BaSO4↓+2H2O;
SO
完全沉淀时:
H++SO
+Ba2++OH-===H2O+BaSO4↓。
【注意事项】与“量”有关的离子方程式的书写技巧
(1)多元弱酸盐与强酸反应时,应注意反应物的用量。
如在Na2CO3溶液中滴加少量盐酸,离子方程式为CO
+H+===HCO
;若盐酸过量,离子方程式为CO
+2H+===CO2↑+H2O。
(2)CO2(或SO2)与强碱溶液反应时,应注意CO2(或SO2)是否过量。
一般地,若CO2(或SO2)少量,产物为碳酸盐(或亚硫酸盐),若CO2(或SO2)过量,产物为碳酸氢盐(或亚硫酸氢盐)。
如
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高考 化学 第一轮 复习 测试 23
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
