 度验证计划.docx
度验证计划.docx
- 文档编号:6810375
- 上传时间:2023-01-10
- 格式:DOCX
- 页数:8
- 大小:19.78KB
度验证计划.docx
《度验证计划.docx》由会员分享,可在线阅读,更多相关《度验证计划.docx(8页珍藏版)》请在冰豆网上搜索。
度验证计划
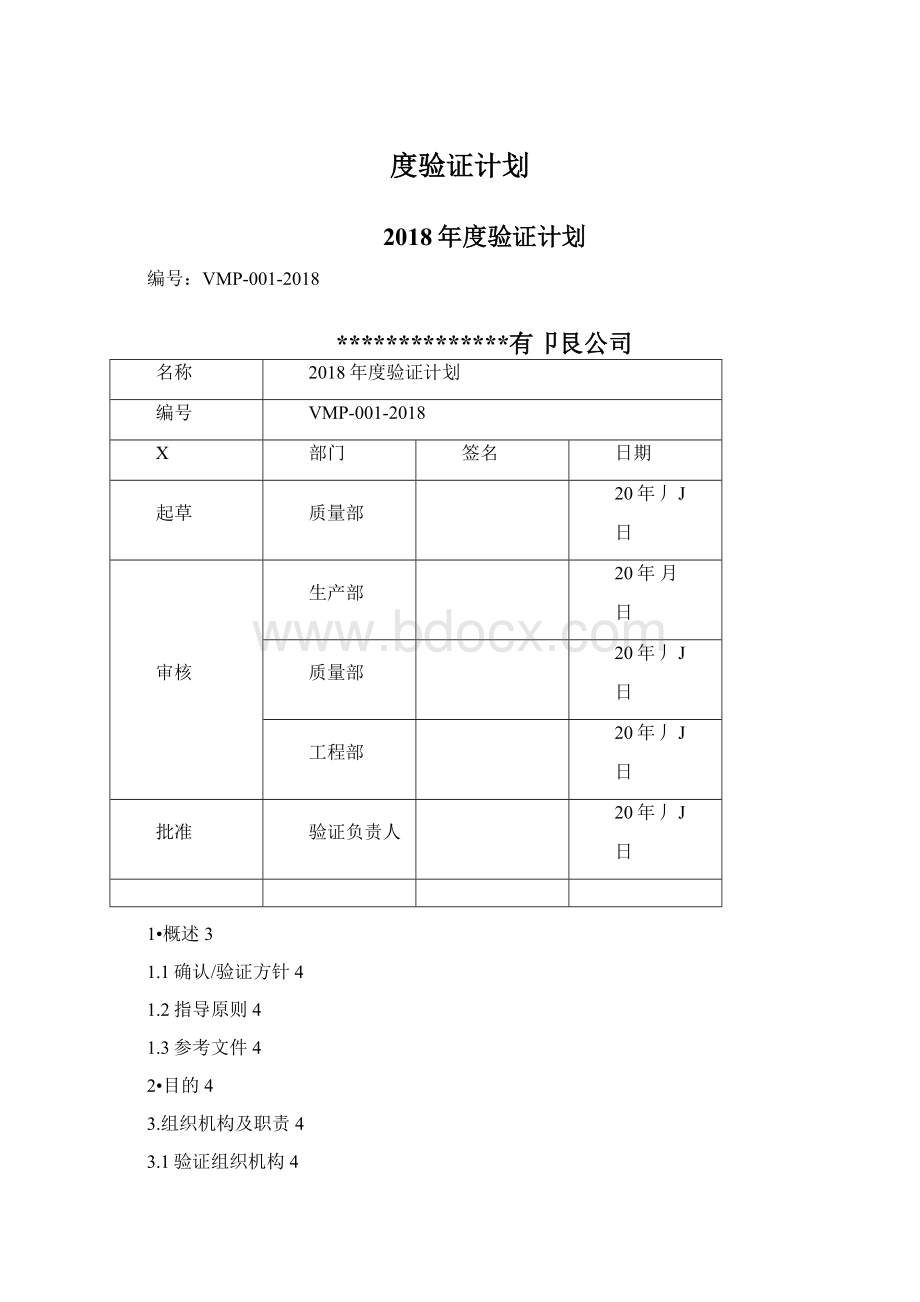
2018年度验证计划
编号:
VMP-001-2018
**************有卩艮公司
名称
2018年度验证计划
编号
VMP-001-2018
X
部门
签名
日期
起草
质量部
20年丿J
日
审核
生产部
20年月
日
质量部
20年丿J
日
工程部
20年丿J
日
批准
验证负责人
20年丿J
日
1•概述3
1.1确认/验证方针4
1.2指导原则4
1.3参考文件4
2•目的4
3.组织机构及职责4
3.1验证组织机构4
3.2验证职责4
4•简介5
4.1厂房、设施和设备简介5
4.2工艺简介7
(1)前处理:
1中药饮片T称量T提取T过滤T储罐T浓缩9F燥T备用
2中药饮片T称:
itT混合9粉碎T灭菌9备用
⑵制剂:
取干膏、药粉按标准要求配料T(制粒T干燥T整粒)T混合T填充胶囊T抛光T铝塑包装T
外包装
4.3品种目录7
5.风险评估7
6.验证计划8
1.1确认/验证方针
为了确保影响产品质量的关键要素,包括厂房设施、生产设备、生产工艺、分析方法等符合GMP规定的要求,保证患者的用药安全。
因此,木公司特制订如下情况需进行验证:
所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证;
关键工艺参数和关键工艺步骤应进行验证;
当验证状态发生漂移时应进行再验证;关键的工艺/设备/设施等应进行定期再验证;
当发生的变更影响产品质量时,所涉及的变更应经过验证;
检验方法、仪器发生变化时应进行验证。
1.2指导原则
本次验证严格按照2010版GMP及其实施指南要求,参照WHO及ISPE有关技术指南的要求,在风险评估的基础上确定验证项目的范围及程度,对验证过程中岀现的偏差和变更进行评估,确保所生产的药品符合预定用途和注册要求。
13参考文件
《药品生产质量管理规范》(2010年版)
《药品生产质量管理规范》(2010年版)附录-《确认与验证》
药品GMP实施指南
《中国药典》(2015年版)
2•目的
为公司的整个验证工作的实施提供指导,确保本公司的验证工作按照规定有序进行,符合GMP有关验证的要求。
其内容包括:
确认/验证方针、指导原则、参考文件、组织机构及职责、确认/验证的范围及程度、确认/验证进度等。
3•组织机构及职责
3.1验证组织机构
根据验证工作需要,成立验证小组,小组成员由生产部、质量部、工程部等相关部门人员组成。
具体如下:
组长:
****
组员:
****(质量部部长)
****(生产部部长)****(工程部部长)
3.2验证职责
3.2.1验证小组职责
1负责验证方案的审批;
2负责组织协调验证各项工作,以保证验证方案规定项目的顺利实施;
3负责验证数据及方法的审核;
4负责验证报告的审批。
3.2.2工程部职责
1负责厂房设备设施的验证及再验证工作;
2参与验证活动,确保验证进度;
3根据验证结果修订相关厂房设备文件及记录;
3.2.3质量部职责
1负责验证方案的起草与修订;
2负责工艺、清洁验证工作的取样并出具检测报告;
3负责空气净化系统、纯化水系统的取样检测;
4负责检验仪器、检验方法的验证工作;
5负责验证工作的中的监督检查,确保验证进度;
6负责验证工作中的偏差处理及变更控制工作;
7负责起草验证报告。
8根据验证结果修订相关质量文件及记录;
3.2.4生产部职责
1组织协调工艺、清洁验证活动,确保验证进度;
2负责工艺、清洁验证数据的收集;
3参与厂房设施设备的验证工作;
4根据验证结果修订相关生产文件及记录;
4•简介
4.1厂房、设施和设备简介
************有限公司占地而积******m2,本企业共有杠个*****生产车间,由*******有限公司按照2010版GMP要求设计,*******有限公司建造。
1#厂房建筑东西向总长度97.1米,南北向宽度为50米。
该厂房的东部为三层:
一层由北向南布置有锅炉房、消防控制室、餐厅、阴凉库(2间)、劳保仓库和泵房,二层为化验室,由北向南布置有空调机房、阳性对照室、准备室、微生物限度室、试剂室、样品室、仪器室、高温室、天平室、液相色谱室、标准溶液室、理化室、气瓶室、气相色谱室、样品前处理室、更衣室及盥洗室;三层为办公用房,由北向南依次布置有留样室、稳定性考察室、办公室(10间)及盥洗室。
该厂房的西部为生产车间:
其西部布置有药材前处理和提取车间;北部布置有药材库及动力机房房、高低压配电室、制水间;南部为洁净生产区;东部布置有原辅料料包材仓库、成品仓库。
中药硬胶囊剂生产车间包括前处理组(含中药粉碎和提取)、收膏组、制剂组、外包装组、仓库、动力区。
(1)前处理组位于2#厂房西部,属一般生产区,建筑而积约825平方米,有拣选工作台1个,洗药机1台,润药池2个,切药机2台,剁药机1台,药材干燥设备1台,粉碎机组2台,湿热灭菌柜1台,提取罐3台,药液储罐2台,双效浓缩机组1台,单效浓缩机组1台,沉淀罐1台,酒精回收机组1台,酒精储罐2台,溶剂回收罐1台,发酵罐1台。
以上设备均为优质不锈钢材质,现阶段能满足企业生产需要。
物料由药材库直接传入前处理组,人员由前处理组北侧人员通道进入。
(2)收膏组位于1#厂房中西部,属D级洁净区,建筑面积约300平方米。
收膏洁净区有收膏混膏、微波干燥灭菌、净料粉碎等工序,有符合GMP要求的微波干燥箱1台、干膏粉碎机1台。
收膏组人员从1#厂房南侧进入洁净区,前处理组通过管路和收膏洁净区西侧的气闸将物料传入收膏组,收膏组将加工处理好的物料从收膏洁净区东侧的气闸传至制剂组,废弃物由收膏组北侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(3)制剂组位于1#厂房中部,属D级洁净区,建筑面积约2000平方米。
制剂洁净区有混合配料、制粒干燥、胶囊充填、内包装等工序,有符合GMP要求的混合机1台、槽式混合机1台、摇摆式颗粒剂1台、沸腾干燥机1台、热风循环烘箱1台、胶囊充填机3台、铝塑包装机3台。
制剂组人员从2#厂房南侧进入洁净区,制剂洁净区北侧通过气闸与原辅料包材库相连,完成内包装后的待包装品从洁净区内包间的传递口直接传至外包装组,废弃物由制剂组东侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(4)外包装组位于2#厂房南侧,属一般生产区,建筑面积约270平方米,有2条包装生产线。
外包装组与包材库、成品库相连,方便存取。
人员分工明确,责任到人,有效地避免各种人为的差错。
(5)仓库分为药材库、原辅料包材库和成品库,其中药材库位于1#厂房北侧,分为常温库与阴凉库;原辅料包材库位于1#厂房东侧,分为标签库、原辅包材库、阴凉库;成品库位于2#厂房东侧,分为常温库与阴凉库。
(6)动力区分为锅炉房、配电室、动力机房、制水间,其中锅炉房位于2#厂房东北角,有1.7吨锅炉2台,主要为生产提供蒸汽;配电室位于1#厂房北侧,主要为生产提供电力;动力机房位于1#厂房北侧,主要有3台空调机组、1台制冷机组、[套压缩空气设备,主要为洁净区提供洁净空气和洁净压缩空气;制水间位于动力机房南侧,有0.5吨/h双级反渗透制纯化水机组一套,主要为洁净区提供纯化水。
4.2工艺简介
(1)前处理:
1中药饮片T称量T提取T过滤T储罐T浓缩T干燥T备用
2中药饮片t称*I混合t粉碎t灭菌t备用
(2)制剂:
取干膏、药粉按标准要求配料T(制粒T干燥T整粒)T混合T填充胶
囊T抛光T铝塑包装T外包装
4.3品种目录
号
药品名称
规格
剂型
药品批准文号
备注
5•风险评估
5.1厂房设施设备再确认
参照《药品GMP指南-质量管理体系》第97-98页的“厂房、设施、设备等完成确认之后应通过变更管理系统进行控制,所有影响产品质量的变更等都应有正式的中请、记录并批准。
在没有发生较大的变更的情况下,可以通过对维护、校准、工作日志、偏差、变更等的定期回顾,确保厂房、设施、设备等的确认状态。
这种周期性的回顾可视为再确认。
当发生改造、变更或反复出现故障时,需通过风险评估确定是否进行再确认,以及再确认的范围和程度。
”内容,在厂房、设施、设备等完成确认的情况下,如发生变更,需立即停止生产,进行再确认合格后方可使用;如无变更,在HVAC系统和纯化水系统正式运行1年后,其余厂房、设施、设备正式运行2年后通过对维护、校准、工作日志、偏差、变更等的定期回顾进行再确认。
如增加新设施设备,需对相关设备进行确认合格后方可使用。
5.2工艺验证
根据《药品生产质量管理规范(2010年修订)》的规定,我公司因企业搬迁生产设备、生产环境等发生变更,存在影响产品质量的因素,在新厂址未生产过的品种应完成连续三个成功批次的工艺验证。
参照《药品GMP指南-质量管理体系》第103-104页的规定,生产工艺的再验证,可分为以下两种情况:
(1)当发生可能影响产品质量的变更或出现异常情况时,应通过风险评估确定是否需进行再验证以及确定再验证的范围和程度。
(2)生产工艺在完成首次验证后,应定期进行再验证以确定它们仍保持验证状态并仍能满足要求,再验证的频率可以由企业根据产品、剂型等因素自行制定。
周期性的再验证可以采用同步验证的方式、回顾的方式或两者相结合的方式进行。
5.3清洁再验证
参照《药品GMP指南-质量管理体系》第116页的规定“每个清洁程序应定期进行再验证,验证的频率由企业根据实际情况制定。
对日常清洁程序监测结果的回顾可以作为周期性再验证。
”
在己完成清洁验证的情况下,如清洁程序发生变更并可能影响清洁效果、设备发生变更并可能影响到清洁效果、当分组或最差条件发生变化并可能影响到验证结论、日常监测中发现异常结果时,应立即停产,进行清洁再验证合格后方可继续生产;如无变更,在正式生产2年后,通过对日常清洁程序监测结果的回顾进行再验证。
6•验证计划
根据风险评估内容特制订本年度验证计划
2018年验证计划一览表
序
号
项目名称
类别
部
门
负贞
人
验证日
期
1
洁净厂房再
验证
设备验
证
2
HVAC系统再
验证
设备验
证
3
纯化水系统
再验证
设备验
证
4
压缩空气系
统再验证
设备验
证
5
其他设备
设备验
证
6
新生产品种
工艺验证
工艺验
证
根据生
产计划进行连续三批验证
7
清洁再验证
清洁验
证
质
量部
沈小
凯
与相关
设备再验证
同时进行
8
产品年度质
量回顾
工艺验
证
生
产部
靖礼
红
2029年1
月
車注:
未列入本汁划的验证可根据需要及时提出由验证小组批准进行。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 验证 计划
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
