 艾滋病母婴阻断附件相关流程新及用药方案.docx
艾滋病母婴阻断附件相关流程新及用药方案.docx
- 文档编号:6528716
- 上传时间:2023-01-07
- 格式:DOCX
- 页数:60
- 大小:549.89KB
艾滋病母婴阻断附件相关流程新及用药方案.docx
《艾滋病母婴阻断附件相关流程新及用药方案.docx》由会员分享,可在线阅读,更多相关《艾滋病母婴阻断附件相关流程新及用药方案.docx(60页珍藏版)》请在冰豆网上搜索。
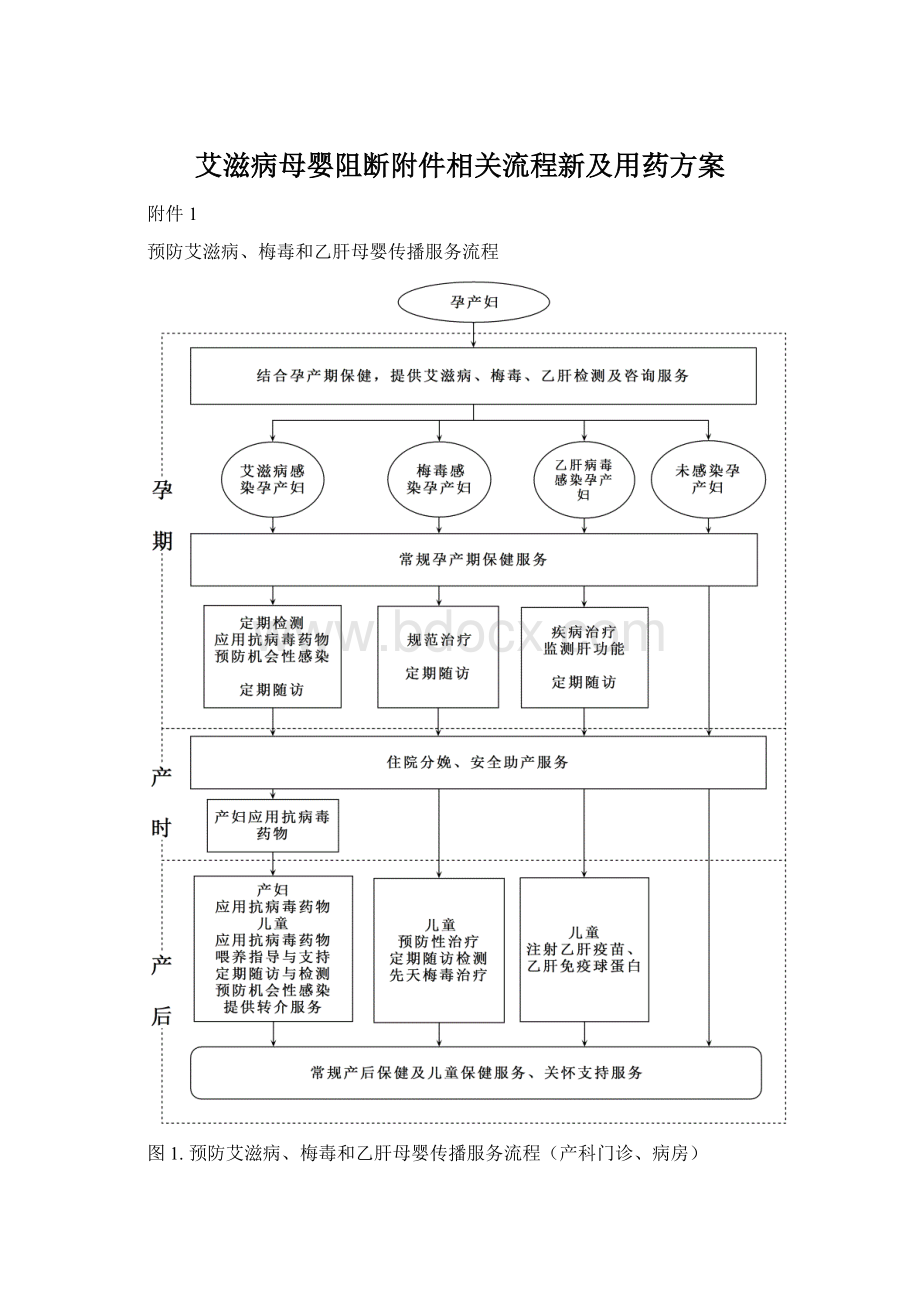
艾滋病母婴阻断附件相关流程新及用药方案
附件1
预防艾滋病、梅毒和乙肝母婴传播服务流程
图1.预防艾滋病、梅毒和乙肝母婴传播服务流程(产科门诊、病房)
附件2
孕产妇艾滋病抗体检测及服务流程
图2.孕妇艾滋病抗体检测及服务流程
(检验科上墙)
附件3
产时艾滋病抗体检测及服务流程
图3产时艾滋病抗体检测及服务流程
(适用于孕期未接受HIV检测的产妇,产科病房上墙)
附件4
孕产妇梅毒检测及服务流程
图4.孕产妇梅毒检测及服务流程
(检验科上墙)
附件5
艾滋病感染孕产妇所生儿童艾滋病感染
早期诊断检测及服务流程
目前暂时条件成熟
阳性反应阴性反应
阴性反应
呈阳性反应阳性反应阴性反应
阳性反应阴性反应
SHAPE\*MERGEFORMAT
图5.艾滋病感染孕产妇所生儿童艾滋病感染早期诊断检测及服务流程
附件6
感染孕产妇所生儿童艾滋病抗体
检测及服务流程
图6.艾滋病感染孕产妇所生儿童艾滋病抗体检测及服务流程
附件7
梅毒感染孕产妇所生儿童的随访与先天梅毒感染状态监测
图7.梅毒感染孕产妇所生儿童的随访及先天梅毒感染状态监测图
附件8
预防艾滋病、梅毒和乙肝母婴传播相关报表上报流程及要求
一、预防艾滋病、梅毒和乙肝母婴传播相关报表上报流程
实施单位目标人群填报表格上报流程
卫生部妇幼保健与社区卫生司
县级妇幼保健机构整理汇总、上报月报表及系列个案登记卡,经县级、地级及省级逐级审核、逐级上报。
填写预防艾滋病母婴传播婚前保健门诊咨询检测登记。
上报表格:
表1-Ⅰ、预防艾滋病母婴传播工作月报表(婚前保健机构填写)
表3-Ⅰ、艾滋病病毒感染孕产妇/婚检妇女登记卡(保密)
婚前保健青年男女
中国疾病预防控制中心妇幼保健中心
婚前保健机构
产科门诊(孕期保健门诊)和产科病房分别填写预防艾滋病、梅毒和乙肝母婴传播咨询检测登记。
上报表格:
表1-Ⅱ、预防艾滋病母婴传播工作月报表
表2-Ⅰ、预防梅毒、乙肝母婴传播工作月报表
(孕产期保健机构和助产机构填写)
提供孕产期保健和助产服务的医疗保健机构(含乡和社区)
所有孕产妇
艾滋病、梅毒感染孕产妇及所生儿童
上报系列个案卡:
表3-Ⅰ、艾滋病病毒感染孕产妇/婚检妇女登记卡(保密)
表3-Ⅱ、艾滋病病毒感染孕产妇妊娠及所生婴儿登记卡(保密)
表3-Ⅲ、艾滋病病毒感染孕产妇及所生儿童随访登记卡(保密)
表4-Ⅰ、梅毒感染孕产妇登记卡(保密)
表4-Ⅱ、梅毒感染孕产妇及所生儿童随访登记卡(保密)
上报月报表:
表1-Ⅲ、预防艾滋病母婴传播工作月报表
表2-Ⅱ、预防梅毒、乙肝母婴传播工作月报表
(由乡镇卫生院和社区服务中心填报本辖区内的数据表,县级妇幼保健机构汇总)
县级妇幼保健机构
乡镇卫生院和社区服务中心
非住院分娩产妇及其分娩的婴儿
二、预防艾滋病、梅毒和乙肝母婴传播相关报表上报时限及要求
(一)预防艾滋病、梅毒和乙肝母婴传播工作月报表(表1、表1-Ⅰ、表1-Ⅱ、表1-Ⅲ,表2、表2-Ⅰ、表2-Ⅱ)。
各级医疗保健机构应于每月1日前将上月预防艾滋病、梅毒和乙肝母婴传播工作月报表(本机构填写部分)上报至本辖区的县(市、区)级妇幼保健机构。
各级妇幼保健机构收集、整理、汇总和逐级审核后,形成“预防艾滋病母婴传播工作月报(汇总)表”(表1)及“预防梅毒、乙肝母婴传播工作月报表(汇总)表”(表2),县级于每月3日之前将纸质和网络报表报送到达地级妇幼保健机构,地级于每月6日之前将纸质和网络报表报送到达省级妇幼保健机构,省级妇幼保健机构于每月8日前将汇总数据报省卫生厅妇社处,15日前将纸质和网络报表前上报至中国疾病预防控制中心妇幼保健中心。
(二)预防艾滋病、梅毒和乙肝母婴传播系列个案登记卡
艾滋病病毒感染孕产妇/婚检妇女基本情况登记卡(表3–Ⅰ)应于获得艾滋病病毒感染孕产妇/婚检妇女确认试验阳性结果后5日内填报。
对既往已确认感染者,本次预防艾滋病母婴传播服务中了解其感染状态后5日内填报。
艾滋病病毒感染孕产妇妊娠及所生婴儿登记卡(表3–Ⅱ)应于艾滋病病毒感染孕产妇出现妊娠结局或产褥期(分娩至42日)后5日内填报。
艾滋病病毒感染产妇及所生儿童随访登记卡(表3–Ⅲ)应分别于艾滋病病毒感染产妇所生儿童满1、3、6、9、12、18个月后5日内填报。
梅毒感染孕产妇登记卡(表4–I)应于孕产妇诊断为梅毒感染后5日内填报。
梅毒感染孕产妇及所生儿童随访登记卡(表4–II)应于梅毒感染产妇所生儿童死亡、诊断先天梅毒感染或排除梅毒感染后5日内填报。
如梅毒感染孕产妇自然流产、人工终止妊娠、死亡或确定失访,或者所生儿童满18月龄后确定失访,应在其后5日内填报。
县级妇幼保健机构和(或)卫生行政部门应于各类个案登记卡填报后3日内,完成纸质审核上报和网络代报、审核。
地级妇幼保健机构和(或)卫生行政部门在随后的5日内完成纸质审核上报和网络审核上报。
省级妇幼保健机构和卫生行政部门在随后的7日内完成纸质审核上报和网络审核上报。
各级医疗卫生机构(含乡级和社区卫生服务中心)和各级妇幼保健机构负责将相关的原始登记、月报表及系列个案登记卡留存备案。
附件9
艾滋病感染孕产妇及所生儿童
抗艾滋病病毒用药方案
预防艾滋病母婴传播抗病毒药物的应用可分为预防性抗病毒用药方案和治疗性抗病毒用药方案。
对于处于艾滋病临床I期或II期,免疫功能相对较好,CD4+T淋巴细胞计数>350/mm3的艾滋病感染孕产妇,建议采用预防性抗病毒用药方案;对处于艾滋病临床Ⅲ期或Ⅳ期,CD4+T淋巴细胞计数≤350/mm3的艾滋病感染孕产妇,建议采用治疗性抗病毒用药方案。
一、预防性应用抗病毒药物
(一)孕产妇预防性应用抗病毒药物。
1.孕期和分娩时。
从妊娠14周或14周后发现艾滋病感染后尽早开始服用齐多夫定(AZT)300mg+拉米夫定(3TC)150mg+洛匹那韦/利托那韦(克力芝)(LPV/r)400/100mg,每天2次;或者AZT300mg+3TC150mg,每天2次,依非韦伦(EFV)600mg,每天1次,直至分娩结束。
2.分娩后。
若选择人工喂养,产妇可在分娩结束后停止抗病毒药物的应用;若选择母乳喂养,产妇持续应用抗病毒药物至停止母乳喂养后1周。
(二)婴儿应用抗病毒药物。
婴儿可以选择应用以下两种抗病毒药物方案中的任一种。
1.奈韦拉平(NVP)方案:
新生儿出生体重≥2500g,服用NVP15mg(即混悬液1.5ml),每天1次;出生体重<2500g且≥2000g,服用NVP10mg(即混悬液1.0ml),每天1次;出生体重<2000g,服用NVP2mg/kg(即混悬液0.2ml/kg),每天1次;至出生后4~6周。
2.齐多夫定(AZT)方案:
新生儿出生体重≥2500g,服用AZT15mg(即混悬液1.5ml),每天2次;出生体重<2500g且≥2000g,服用AZT10mg(即混悬液1.0ml),每天2次;出生体重<2000g,服用AZT2mg/kg(即混悬液0.2ml/kg),每天2次;至出生后4~6周。
无论婴儿选择哪种抗病毒药物,都应在出生后尽早(6~12小时内)开始服用。
(三)孕期没有接受HIV检测,临产时才发现艾滋病感染的孕产妇。
1.选择人工喂养者。
(1)产妇:
服用单剂量NVP200mg,及AZT300mg+3TC150mg,每天2次,至分娩结束;产后继续服用AZT300mg+3TC150mg,每天2次,连续服用7天。
(2)婴儿:
出生后尽早(6~12小时内)服用单剂量NVP2mg/kg(即混悬液0.2ml/kg),同时服用AZT4mg/kg(即混悬液0.4ml/kg),每天2次,至出生后4~6周。
或出生后尽早(6~12小时内)服用NVP,出生体重≥2500g,服用NVP15mg(即混悬液1.5ml),每天1次;出生体重<2500g且≥2000g,服用NVP10mg(即混悬液1.0ml),每天1次;出生体重<2000g,服用NVP2mg/kg(即混悬液0.2ml/kg),每天1次;至出生后4~6周。
2.选择母乳喂养者。
可以选择应用以下两种抗病毒药物方案中的任一种。
(1)产妇:
服用AZT+3TC+LPV/r或AZT+3TC+EFV(用法及剂量同上),至停止母乳喂养后1周。
婴儿:
出生后尽早(6~12小时内)服用NVP,每天1次,至出生后6周(用量同前)。
(2)产妇:
服用单剂量NVP200mg,及AZT300mg+3TC150mg,每天2次,至分娩结束;产后继续服用AZT300mg+3TC150mg,每天2次,连续服用7天。
婴儿:
出生后尽早(6~12小时内)服用NVP,每天1次,至母乳喂养停止后1周(对于产后才发现的感染产妇,产妇可暂不用抗病毒药物,婴儿采用此方案)。
二、治疗性应用抗病毒药物
(一)孕产妇治疗性应用抗病毒药物。
尽早开始服用AZT300mg+3TC150mg,每天2次,EFV600mg,每天1次;或者CD4+T淋巴细胞计数<250/mm3时,还可以选择尽早服用AZT300mg+3TC150mg+NVP200mg,每天2次。
(二)婴儿应用抗病毒药物。
婴儿可以选择应用以下两种抗病毒药物方案中的任一种。
1.NVP方案:
新生儿出生体重≥2500g,服用NVP15mg(即混悬液1.5ml),每天1次;出生体重<2500g且≥2000g,服用NVP10mg(即混悬液1.0ml),每天1次;出生体重<2000g,服用NVP2mg/kg(即混悬液0.2ml/kg),每天1次;至出生后4~6周。
2.AZT方案:
新生儿出生体重≥2500g,服用AZT15mg(即混悬液1.5ml),每天2次;出生体重<2500g且≥2000g,服用AZT10mg(即混悬液1.0ml),每天2次;出生体重<2000g,服用AZT2mg/kg(即混悬液0.2ml/kg),每天2次;至出生后4~6周。
无论婴儿选择哪种抗病毒药物,都应在出生后尽早(6~12小时内)开始服用。
附件10
梅毒感染孕产妇及所生儿童治疗方案
一、梅毒感染孕产妇治疗方案
(一)推荐方案。
1.普鲁卡因青霉素G,80万单位/日,肌内注射,连续15日;
2.苄星青霉素240万单位,分两侧臀部肌内注射,每周1次,共3次。
(二)替代方案。
1.若没有青霉素,可用头孢曲松,1克/日,肌内注射或静脉给药,连续10天;
2.青霉素过敏者:
可用红霉素治疗(禁用四环素、多西环素),红霉素500mg,每日4次,口服,连服15天。
二、梅毒感染孕产妇所生新生儿的预防性治疗方案
出生后应用苄星青霉素G,5万单位/公斤体重,分双臀肌肉注射。
三、先天梅毒患儿的治疗方案
(一)脑脊液正常者。
苄星青霉素G,5万单位/公斤,1次注射(分两侧臀肌)。
(二)脑脊液异常者。
水剂青霉素G,每日5万单位/公斤,分2次静脉滴注,连续10~14天;或普鲁卡因青霉素G,每日5万单位/公斤,肌注,连续10~14天。
如无条件检查脑脊液者,可按脑脊液异常者治疗。
预防艾滋病、梅毒和乙肝母婴传播相关报表
表1预防艾滋病母婴传播工作月报(汇总)表
(由妇幼保健机构汇总)
省(自治区、直辖市)市(县)
年月
编号
项目
人数
指标说明
1.
婚前保健
接受婚前保健人数
男
由表1–Ⅰ汇总获得。
2.
女
3.
接受艾滋病咨询人数
男
4.
女
5.
接受HIV抗体检测人数
男
6.
女
7.
HIV抗体阳性人数
男
8.
女
9.
孕期
接受初次产前保健的孕妇数
由表1–Ⅱ汇总获得。
10.
接受艾滋病咨询孕妇数
11.
接受HIV抗体检测孕妇数
12.
HIV抗体阳性孕妇数
13.
住院分娩
住院分娩产妇数
14.
孕期接受艾滋病咨询产妇数
15.
孕期接受HIV抗体检测产妇数
16.
仅产时接受艾滋病咨询产妇数
17.
仅产时接受HIV抗体检测产妇数
18.
仅产时HIV抗体检测阳性产妇数
19.
HIV抗体阳性产妇总数
20.
住院分娩活产数
21.
HIV抗体阳性产妇所娩活产数
22.
非住院分娩
非住院分娩产妇数
由表1–Ⅲ汇总获得。
23.
孕期接受艾滋病咨询产妇数
24.
孕期接受HIV抗体检测产妇数
25.
仅产时接受HIV抗体检测产妇数
26.
仅产时HIV抗体检测阳性产妇数
27.
HIV抗体阳性产妇数
28.
非住院分娩活产数
29.
HIV抗体阳性产妇所娩活产数
30.
地区产妇总数
31.
地区活产总数
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表1–Ⅰ预防艾滋病母婴传播工作月报表
(由婚前保健机构填写)
市(县)医院(妇幼保健院)年月
编号
项目
人数
1.
接受婚前保健人数
男
2.
女
3.
其中接受艾滋病咨询人数
男
4.
女
5.
其中接受HIV抗体检测人数
男
6.
女
7.
其中HIV抗体阳性人数
男
8.
女
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表1–Ⅱ预防艾滋病母婴传播工作月报表
(由开展孕期保健和助产服务机构填写)
市(县)医院(妇幼保健院)年月
编号
项目
人数
指标说明
9.
孕
期
接受初次产前保健的孕妇数
指初次接受孕期保健服务的孕妇人数。
10.
接受艾滋病咨询孕妇数
以艾滋病检测相关告知登记或咨询登记或其他记录资料为依据。
11.
接受HIV抗体检测孕妇数
孕期初次接受HIV抗体检测的孕妇人数,以艾滋病抗体检测结果报告单为依据。
12.
HIV抗体阳性孕妇数
包括所有在孕期检出的HIV抗体阳性孕妇,无论其妊娠结局如何。
13.
住
院
分
娩
住院分娩产妇数
包括在本机构住院分娩的所有产妇(含≥28孕周引产的产妇)。
14.
孕期接受艾滋病咨询产妇数
本机构住院分娩产妇中在孕期接受艾滋病咨询的人数,依据孕期告知登记、咨询记录及相关信息资料为依据。
15.
孕期接受HIV抗体检测产妇数
本机构住院分娩产妇中在孕期接受HIV抗体检测的人数。
16.
仅产时接受艾滋病咨询产妇数
本机构住院分娩产妇中在孕期未接受艾滋病咨询与检测,仅在住院分娩时才接受艾滋病咨询的产妇人数,以产时登记或出具相关信息材料为依据统计。
17.
仅产时接受HIV抗体检测产妇数
本机构住院分娩产妇中在孕期未接受HIV抗体检测,仅在住院分娩时才接受该检测的产妇人数,依据分娩登记及艾滋病检测结果报告单填写。
18.
仅产时HIV抗体检测阳性产妇数
本机构住院分娩产妇中在孕期未接受HIV抗体检测,仅在住院分娩时才接受该检测、且结果阳性的产妇人数。
19.
HIV抗体阳性产妇总数
在本机构住院分娩的所有HIV抗体阳性产妇人数,无论其在孕期还是产时检出。
20.
住院分娩活产数
包括所有住院分娩活产数。
21.
HIV抗体阳性产妇所娩活产数
在本机构住院分娩的HIV抗体阳性产妇分娩活产数。
注:
如果1个孕产妇在孕产期多次接受咨询、检测,则仅上报1次。
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表1–Ⅲ预防艾滋病母婴传播工作月报表
(由乡/社区卫生服务中心填报,县级妇幼保健机构汇总)
市(县)年月
编号
项目
人数
指标说明
22.
非住院分娩
非住院分娩产妇数
由三级保健网络常规上报数据获得。
23.
孕期接受艾滋病咨询产妇数
在孕期接受过艾滋病咨询的产妇人数,以“孕产期保健手册”记录为依据。
24.
孕期接受HIV抗体检测产妇数
在孕期接受过HIV抗体检测的产妇人数,以“孕产期保健手册”记录或“艾滋病检测结果报告单”为依据。
25.
仅产时接受HIV抗体检测产妇数
在孕期未接受HIV抗体检测,仅分娩时才接受该检测的产妇人数,依据“孕产期保健手册”记录或“艾滋病检测结果报告单”填写。
26.
仅产时HIV抗体检测阳性产妇数
在孕期未接受HIV抗体检测,仅分娩时才接受该检测,且结果阳性的产妇人数。
27.
HIV抗体阳性产妇数
指非住院分娩的所有HIV抗体阳性产妇人数。
28.
非住院分娩活产数
指非住院分娩的所有活产数。
29.
HIV抗体阳性产妇所娩活产数
指非住院分娩的HIV抗体阳性产妇分娩活产数。
30.
辖区产妇总数
由三级保健网络常规上报数据获得,为辖区内住院分娩与非住院分娩的产妇人数总和。
31.
辖区活产总数
由三级保健网络常规上报数据获得,为辖区内住院分娩与非住院分娩的活产数总和。
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表2预防梅毒、乙肝母婴传播工作月报(汇总)表
(由妇幼保健机构汇总)
省(自治区、直辖市)市(县)
年月
编号
项目
人数
指标说明
1.
孕期
接受初次产前保健的孕妇数
由表2–Ⅰ汇总获得。
2.
接受梅毒检测孕妇数
3.
其中:
梅毒感染孕妇数
4.
接受乙肝表面抗原检测孕妇数
5.
其中:
乙肝表面抗原阳性孕妇数
6.
住院分娩
梅毒
孕期接受梅毒检测产妇数
由表2–Ⅰ汇总获得。
7.
仅产时接受梅毒检测产妇数
8.
仅产时诊断为梅毒感染产妇数
9.
梅毒感染产妇总数
10.
梅毒感染产妇所娩活产数
11.
乙肝
孕期接受乙肝表面抗原检测产妇数
12.
仅产时接受乙肝表面抗原检测产妇数
13.
仅产时乙肝表面抗原阳性产妇数
14.
乙肝表面抗原阳性产妇总数
15.
乙肝表面抗原阳性产妇所生活产数
16.
其中:
注射乙肝免疫球蛋白的儿童数
17.
非住院分娩
梅毒
接受梅毒检测产妇数
由表2–Ⅱ汇总获得。
18.
梅毒感染产妇数
19.
梅毒感染产妇所生活产数
20.
乙肝
接受乙肝表面抗原检测产妇数
21.
乙肝表面抗原阳性产妇总数
22.
乙肝表面抗原阳性产妇所生活产数
23.
其中:
注射乙肝免疫球蛋白的儿童数
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表2–Ⅰ预防梅毒、乙肝母婴传播工作月报表
(由开展孕期保健和助产机构填写)
市(县)医院(妇幼保健院)年月
编号
项目
人数
指标说明
1.
孕期
接受初次产前保健的孕妇数
指初次接受孕期保健服务的孕妇人数。
2.
接受梅毒检测孕妇数
孕期初次接受梅毒检测的孕妇人数,以梅毒检测结果报告单为依据。
3.
其中:
梅毒感染孕妇数
包括所有在孕期诊断为梅毒感染的孕妇,无论其妊娠结局如何。
4.
接受乙肝表面抗原检测孕妇数
孕期初次接受乙肝病毒病原体血清学检测(乙肝表面抗原或两对半)的孕妇数,以检测结果报告单为依据。
5.
其中:
乙肝表面抗原阳性孕妇数
包括所有在孕期检出的乙肝表面抗原阳性孕妇,无论其妊娠结局如何。
6.
住院分娩
梅毒
孕期接受梅毒检测产妇数
本机构住院分娩产妇中在孕期接受梅毒检测的人数。
7.
仅产时接受梅毒检测产妇数
本机构住院分娩产妇中在孕期未接受梅毒检测,仅在住院分娩时才接受该检测的产妇人数,依据分娩登记及梅毒检测结果报告单填写。
8.
仅产时诊断为梅毒感染产妇数
本机构住院分娩产妇中在孕期未接受梅毒检测,仅分娩时才接受该检测、且诊断为梅毒感染的产妇人数。
9.
梅毒感染产妇总数
在本机构住院分娩的所有诊断为梅毒感染的产妇人数,无论其在孕期还是产时诊断为梅毒感染。
10.
梅毒感染产妇所娩活产数
在本机构住院分娩的梅毒感染产妇分娩活产数。
11.
乙肝
孕期接受乙肝表面抗原检测产妇数
本机构住院分娩产妇中在孕期接受乙肝病毒病原体血清学检测(乙肝表面抗原或两对半)的人数。
12.
仅产时接受乙肝表面抗原检测产妇数
本机构住院分娩产妇中在孕期未接受乙肝病毒病原体血清学检测(乙肝表面抗原或两对半),仅在住院分娩时才接受该检测的产妇人数,依据分娩登记及相关检测结果报告单填写。
13.
仅产时乙肝表面抗原阳性产妇数
本机构住院分娩产妇中在孕期未接受乙肝病毒病原体血清学检测(乙肝表面抗原或两对半),仅住院分娩时才接受该检测、且乙肝表面抗原阳性的产妇人数。
14.
乙肝表面抗原阳性产妇总数
在本机构住院分娩的所有乙肝表面抗原阳性产妇人数,无论其在孕期还是产时检出。
15.
乙肝表面抗原阳性产妇所娩活产数
本机构住院分娩的乙肝表面抗原阳性产妇分娩活产数。
16.
其中:
注射乙肝免疫球蛋白的儿童数
在本机构住院分娩的乙肝表面抗原阳性产妇分娩的活产儿中接受乙肝免疫球蛋白注射的人数。
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
表2–Ⅱ预防梅毒、乙肝母婴传播工作月报表
(由乡/社区卫生服务中心填报,县/市妇幼保健机构汇总)
市(县)年月
编号
项目
人数
指标说明
17.
非住院分娩
梅毒
接受梅毒检测产妇数
接受过梅毒检测的产妇人数,以“孕产期保健手册”记录或“梅毒检测结果报告单”为依据。
18.
梅毒感染产妇数
非住院分娩的所有诊断为梅毒感染产妇人数。
19.
梅毒感染产妇所娩活产数
非住院分娩的所有梅毒感染产妇分娩活产数。
20.
乙肝
接受乙肝表面抗原检测产妇数
接受过乙肝病毒病原体血清学检测(乙肝表面抗原或两对半)的产妇人数,以“孕产期保健手册”记录或“检测结果报告单”为依据。
21.
乙肝表面抗原阳性产妇总数
非住院分娩的所有乙肝表面抗原阳性产妇人数。
22.
乙肝表面抗原阳性产妇所娩活产数
非住院分娩的所有乙肝表面抗原阳性产妇分娩活产数。
23.
其中:
注射乙肝免疫球蛋白的儿童数
非住院分娩的乙肝表面抗原阳性产妇分娩的活产儿中接受乙肝免疫球蛋白注射的人数。
填报时间:
填报人:
填报单位负责人:
填报单位(盖章):
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 艾滋病 母婴 阻断 附件 相关 流程 用药 方案
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
