 重点中学学年度高二上学期化学试题.docx
重点中学学年度高二上学期化学试题.docx
- 文档编号:6254945
- 上传时间:2023-01-04
- 格式:DOCX
- 页数:15
- 大小:331.14KB
重点中学学年度高二上学期化学试题.docx
《重点中学学年度高二上学期化学试题.docx》由会员分享,可在线阅读,更多相关《重点中学学年度高二上学期化学试题.docx(15页珍藏版)》请在冰豆网上搜索。
重点中学学年度高二上学期化学试题
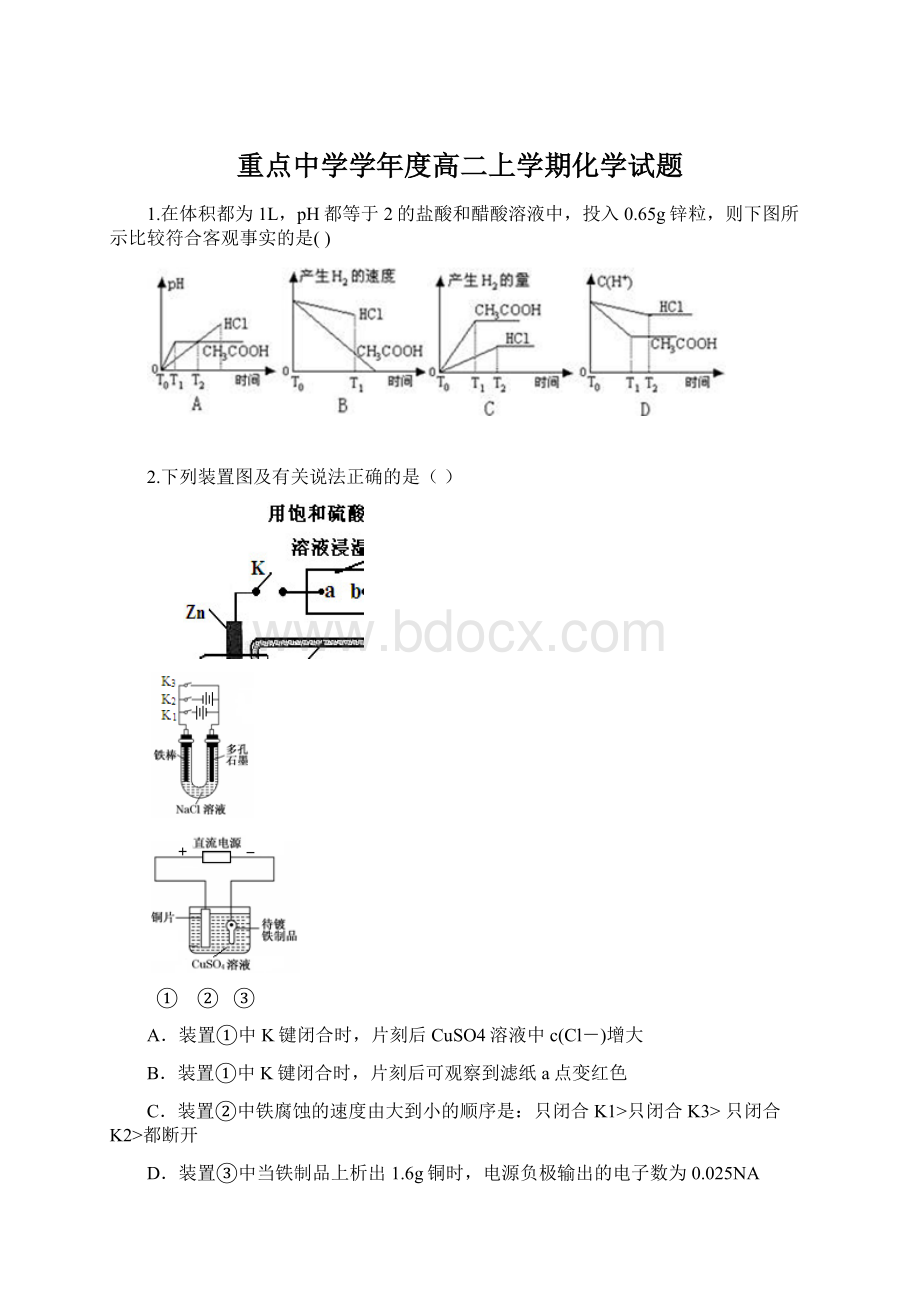
1.在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是()
2.下列装置图及有关说法正确的是()
①②③
A.装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大
B.装置①中K键闭合时,片刻后可观察到滤纸a点变红色
C.装置②中铁腐蚀的速度由大到小的顺序是:
只闭合K1>只闭合K3>只闭合K2>都断开
D.装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA
3.(09盐城第三次调研)日本产业技术综合研究所最近研发了一种新型的锂空气电池,它既可用作充电电池又可作锂燃料电池。
用作燃料电池时,可更换正极的水性电解液和卡盒以及负极的金属锂就可以连续使用,分离出的氢氧化锂可回收锂而循环使用。
下列叙述不正确的是
A.放电时负极的电极反应式为:
Li-e-=Li+
B.充电时,阳极的电极反应式为:
2H2O+O2+4e-=4OH―
C.充电时,锂极与外电源的负极相连
D.熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂
4.在25℃时,纯水的电离度为a1,pH=11的氨水中水的电离度为a2,pH=3的盐酸中水的电离度为a3。
若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为a4,则下列关系式正确的是
A.a1<a2<a3<a4B.a3<a2<a1<a4
C.a2<a3<a1<a4D.a2<a3<a4<a1
5.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24,该溶液中一定能够大量存在的离子组是
A.Ba2+、Na+、Cl-、NO3- B.Al3+、Ca2+、SO42-、Br-
C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
6.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池。
已知通入CH4的一极,其电极反应式是:
CH4+10OH--8e-=CO32-+7H2O;通入O2的另一极,其电极反应式是:
O2+2H2O+4e-=4OH-,该电池放电时,下列有关叙述中,不正确的是
A.通入CH4的电极为负极 B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动 D.该电池使用一段时间后应补充KOH
7.今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:
V2=11:
9
8.(08芜湖二模)下列各项中的两个量,其比值一定为2:
1的是()
A.在反应2FeCl3+Fe====3FeCl2中还原产物与氧化产物的质量
B.在相同温度下,0.2mol·L-1CH3COOH溶液与0.1mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H22NH3已达到平衡c(NH3)和c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积
9.碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。
锌锰电池以氢氧化钾溶液为电解质溶液,电池总反应式为;Zn+MnO2+2H2O=2MnOOH+Zn(OH)2下列说法错误的是
A.电池工作时,锌失去电子
B.电池负极反应为Zn+2OH--2e-=Zn(OH)2
C.电池工作时,电流由负极通过外电路流向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减少6.5g
10.防治雾雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(l)PM2.5是环保部门监测空气质量的重要指标。
将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子的种类和平均浓度如下表:
离子种类
Na+
NH4+
SO42-
NO3-
浓度/(mol/L)
2.0×l0-6
2.8×10-5
3.5×10-5
6.0×l0-5
则试样的pH为____________。
(2)雾霾的主要成分之一是来自汽车尾气的氮氧化物,研究表明CH4可以消除汽车尾气中氮氧化物的污染。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-889.6KJ/mol
②N2(g)+2O2(g)=2NO2(g)ΔH=+67.2KJ/mol
③2NO2(g)
N2O4(g)ΔH=-56.9KJ/mol
写出甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:
_____。
(3)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g)
CH3OH(g)ΔH,CO的平衡转化率与温度、压强的关系如图所示:
①该可逆反应的ΔH_____0(填“>”“<”“=”)。
A,B,C三点对应的平衡常数KA、KB、KC的大小关系是_________。
压强:
p1_______p2(填“>”“<”“=”)。
在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:
v正________v逆(填“>”“<”“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是__________(填字母)
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2molCO和4molH2,在p2、T2条件下达到平衡状态C点,此时容器容积为2L,则在该条件下反应的平街常数K为______________。
11.氢气是一种新型的绿色能源,又是一种重要的化工原料。
以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。
该方法由气化炉制造H2和燃烧炉再生CaO两步构成。
气化炉中涉及到的反应为:
ⅠC(s)+H2O(g)
CO(g)+H2(g) K1;
ⅡCO(g)+H2O(g)
CO2(g)+H2(g) K2;
ⅢCaO(s)+CO2(g)
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
ⅣC(s)+O2(g)=CO2
ⅤCaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。
在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。
下列能说明反应达到平衡的是_______________。
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强
温度
p1/Mpa
p2/Mpa
500℃
45.6%
51.3%
700℃
67.8%
71.6%
下列图像正确的是_________。
(3)已知反应Ⅱ的△H=-41.1kJ/mol,C=O、O-H、H-H的键能分别为803KJ/mol,464kJ/mol、436kJ/mol,则CO中碳氧键的键能为_________kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为_________;当重新平衡后,CO2浓度_________(填“变大”“变小”“不变”)。
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。
该电池的总反应为:
H+NiOOH
M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
12.三氧化二镍是一种重要的电子元件材料、蓄电池材料。
工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。
已知草酸的钙、镁、镍盐均难溶于水。
根据下列工艺流程示意图回答问题。
(1)操作1的名称为____________________________________。
(2)沉淀A为_________________________(用电子式表示)。
(3)试剂B的名称为_______________,沉镍后,滤液中C2O42-的浓度为0.01mol/L,则残留在滤液中的c(Ni2+)=_______________(已知Ksp=4×10-10)。
(4)NiC2O4·2H2O高温煅烧制取三氧化二镍的热重曲线如右图所示:
①T3温度后,草酸镍全部转化为三氧化二镍,则a为_______________(保留一位小数)。
②T2温度发生反应的化学方程式为__________________________。
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。
某同学设计如下实验流程进行检验。
混合气体
现象
澄清石灰水变浑浊
①试剂1的化学式为_____________________。
②碱石灰的作用是________________________________。
13.(11分)现有下列物质:
①Cl2 ②SO2 ③0.1mol·L-1Na2CO3
④0.1mol·L-1NH3.H2O ⑤0.1mol·L-1CH3COOH ⑥BaSO4
(1)属于强电解质 属于弱电解质 属于非电解质 ,向⑤中加入等物质的量④,溶液导电性 (填“增强”或“减弱”)
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。
。
(3)同学乙认为③溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。
请你设计实验证明该同学的观点是否正确。
。
(4)在T℃时,反应2SO2(g)+O2(g)2SO3(g)△H<0的平衡常数K=6×102则:
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②T℃时,某生向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率V(正) V(逆)(填“大于”、“等于”或“小于”)。
14.工业生产中产生的SO2、NO直接排放将对大气造成严重污染,利用电化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素).
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2﹣的离子方程式 .
(2)含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
图1
图2
①下列说法正确的是 (填标号).
A.pH=7时,溶液中c( Na+)<c (HSO3﹣)+c(SO32﹣)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10﹣7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时的溶液中c(OH﹣)=c(H+)+c(HSO4﹣)+c(H2SO4)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为 .
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 .
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.
图中A为电源的 (填“正”或“负”)极.右侧反应室中发生的主要电极反应式为 .
(4)已知进人装置Ⅳ的溶液中NO2﹣的浓度为 0.4mol/L,要使1m3该溶液中的NO2﹣完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L.
15.重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。
工业上一般采用高温煅烧还
原法;实验室可以采用沉淀转化法。
●高温煅烧还原法
(1)煅烧还原的热化学方程式为:
有关的数据:
Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ·mol-1
C(s)+
O2(g)=CO(g);△H=-110.5kJ·mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ·mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):
.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。
如此处理多次,直到BaSO4全部转化为BaCO3:
BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20molBaSO4,每次用1.00L2.0mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?
(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
16.氮及其化合物在工农业生产、生活中有重要作用。
请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_____________。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为
则该反应的热化学方程式为___________________________________________。
(3)工业合成氨的反应:
N2(g)+3H2(g)
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如右图所示:
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是________点。
②T2条件下,在2L的密闭容器中,充入xmolN2和ymolH2时,3min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):
v(N2)=___________;该反应的平衡常数的值K=______________________。
③图像中T2________T1(填“高于”、“低于”、“等于”或“无法确定”)。
④科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,这提高了氮气和氢气的转化率。
写出电化学合成过程中发生还原反应的电极方程式:
_______________________________________。
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
下列有关分析推断正确的是____________。
A.硝酸起始浓度为4mol/L B.①中溶解了5.6gFe
C.③中n(Cu2+)=0.15mol D.④中V=6.72L
17.(12分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____。
A.9B.13C.11~13之间D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①__和___两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH―多0.05mol。
(4)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。
现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是.
Mg(OH)2(固)
Mg2++2OH-……①
NH4++H2O
NH3·H2O+H+……②
H++OH-
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是.
Mg(OH)2(固)
Mg2++2OH-……①NH4++OH-
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
①丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂加入Mg(OH)2悬浊液中,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3B.CH3COONH4C.Na2CO3D.NH3·H2O
②丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2溶解的离子方程式___________________。
18.I.
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),G常用作耐火材料,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周
期表中位置△.C溶液加热蒸干灼烧的产物是△.
(2)写出反应⑤的离子方程式△。
(3)若向气体K的水溶液中加入盐酸,室温下使其溶液的PH=7,则溶液中离子浓度由大到小的排列是△。
(4)已知:
FeO(s)+CO(g)
Fe(s)+CO2(g);△H=—11kJ/mol。
在1L的密闭容器中,投入7.2gFeO和0.1molCO在定温条件下反应,该反应的正反应速率随时间变化情况如图所示,在t1时改变了某种条件,反应在t2时达平衡,改变的条件可能是_____△______。
(选填字母)
a.升高温度b.增大CO的浓度
c.使用催化剂d.增大压强
II.电浮选凝聚法是工业上采用的一种污水处理法:
保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。
Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。
阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
(1)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则由阳极电极反应的产物反应生成Fe(OH)3沉淀的离子方程式为△。
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知正极的电极反应是:
O2+2CO2+4e-=2CO32-。
①负极的电极反应是△。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。
为此电池工作时必须有部分A物质参加循环。
则A物质的化学式是△。
试卷答案
1.C2.B3.B4.D5.6.B7.C8.答案:
A9.C
10
(1)4
(2)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O
(1)ΔH=-899.9KJ/mol(3)①
11.
(1)K1·K2·K3BC
(2)BD (3)1072.9 (4)正向移动或向右移动不变(5)M+H2O+e-=MH+OH-
12.
(1)过滤
(2)
、
(3)草酸或可溶性的草酸盐4×10-8mol/L
(4)①45.4②NiC2O4·H2O
NiC2O4+H2O
(5)①CuSO4②吸收二氧化碳,避免对CO的检验产生干扰
13.
(1)③⑥;④⑤;①②;增强
(2)向纯碱溶液中滴酚酞试液后,溶液显红色,然后逐滴加入CaCl2溶液直到过量,若溶液红色逐渐变浅直至消失,则说明上述观点正确。
(3)用pH试纸(或pH计)测常温下0.1mol·L-1纯碱溶液的pH,若pH<12,则该同学观点正确;若pH>12,则该观点不正确。
(4)①减少 ②否;大于
14.
(1)NO+H2O+Ce4+=Ce3++NO2﹣+2H+;
(2)①ABC;
②3SO2+5OH﹣=2SO32﹣+HSO3﹣+2H2O;
③酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)正;2HSO3﹣+2H++2e﹣=S2O42﹣+2H2O;
(4)4480.
16.答案:
(1)C
(2)N2(g)+O2(g)=2NO(g) △H=+183.8kJ/mol
(3)①q②ax/6mol·L-1·min-1 16(ax)2/[(x-ax)(3x-3ax)3]
③低于④N2+6H++6e-=2NH3
(4)AC
17.
(1)D(2分)
(2)C(2分)
(3)①NH3•H2O和NH4+(共2分,均答对给分)②NH4+和H+(共2分,均答对给分)
(4)
B(1分)②乙(1分);Mg(OH)2+2NH4+=Mg2++2NH3·H2O(2分)
18.I.
(1)第四周期第Ⅷ族;氧化铁(
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 重点中学 学年度 上学 化学试题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
