 初中化学有关压强对比实验的专项训练.docx
初中化学有关压强对比实验的专项训练.docx
- 文档编号:5782858
- 上传时间:2023-01-01
- 格式:DOCX
- 页数:15
- 大小:387.53KB
初中化学有关压强对比实验的专项训练.docx
《初中化学有关压强对比实验的专项训练.docx》由会员分享,可在线阅读,更多相关《初中化学有关压强对比实验的专项训练.docx(15页珍藏版)》请在冰豆网上搜索。
初中化学有关压强对比实验的专项训练
压强原理实验
1、压强差的形成
因素
常见反应
常见现象
气压增大
气压减小
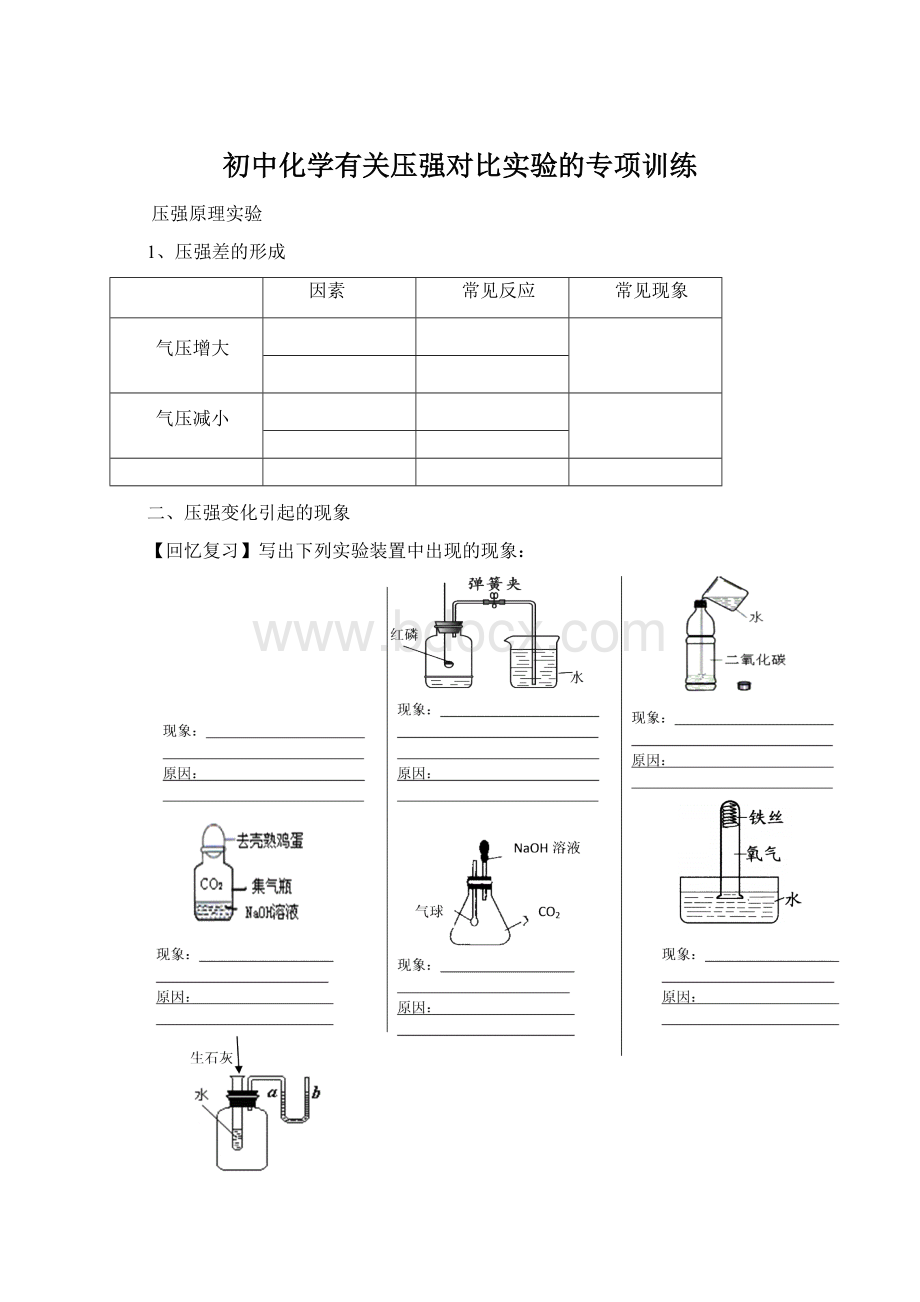
二、压强变化引起的现象
【回忆复习】写出下列实验装置中出现的现象:
现象:
;
原因:
;
三、压强原理的应用
【应用一:
由现象推压强变化】
1.(3分)在一次科学实践活动课上,同学们做了“会动的鸡蛋”系列趣味实验。
(1)向装有干冰的集气瓶中加入热水(如图A),观察到有大量白雾产生,熟鸡蛋在瓶口跳动,该实验说明干冰具有______________的性质。
(2)向集满二氧化碳气体的瓶中加入饱和的氢氧化钠溶液(如图B),观察到瓶口的熟鸡蛋被吞入瓶中,其原因是______________。
2.任选2种为一组,按下图装置进行实验,将液体滴入瓶中,关闭活塞。
现象
物质
气球变鼓,一段时间后恢复原状
气球变鼓,一段时间后不恢复原状
液体
固体
3.如右图所示的甲、乙两个装置(气密性良好),从分液漏斗中加入液体,一段时间后两装置中的气球都胀大(忽略液体体积对气球体积的影响)。
精确称量发现:
两个实验反应后质量均与反应前数值不相等。
①两个反应(填“遵守”或“不遵守”)质量守恒定律。
②请分别解释两个装置中气球胀大的原因。
4.下图装置可以完成多个简单实验,具有药品用量少、尾气不外逸等优点。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时
挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质
是。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色
的干燥纸花,烧杯②中盛有碳酸钙粉末。
为了验证使石蕊变色的物质是碳酸
而不是二氧化碳,应采取的实验操作是_______________________________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。
请将下表中的试剂补充完整。
滴管甲
烧杯①
滴管乙
烧杯②
试剂
H2O
Mg
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是_________________________。
【应用二:
由压强变化推现象】
一、检查气密性
1、常用方法:
(1)手握受热膨胀法:
____________________________________________。
(2)注水法:
________________________________________________。
(3)吹气(抽气)法:
________________________________________。
2、变型装置:
检查装置气密性:
保持K1关闭,打开K2、K3,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置的左侧气密性良好的现象是;用同样原理可以检查装置另一侧的气密性。
检查装置气密性:
打开a,关闭b,在A中加入水,,则装置的气密性良好。
用同样原理可以检查装置另一侧的气密性。
检查上述装置气密性的实验方案是______________。
实验前,连接好仪器,关闭K,加水至长颈漏斗内液面高于瓶中液面。
一段时间后,液面高度保持不变,该现象说明___________。
二、由压强理解图像
1.为了帮助同学们更好的理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置(如图1)内的压强、温度和氧气浓度,三条曲线变化趋势如图2所示。
图1图2
(2)X曲线表示的是(填“温度”或“氧气的浓度”)。
(3)结合X、Y两条曲线,解释图2中BC段气压变化的原因是。
(4)实验中测得的数据如下:
测量
项目
实验前
实验后
烧杯中水的体积
烧杯中剩余水的体积
瓶中剩余气体的体积
体积/mL
80.0
46.4
126.0
根据实验数据计算:
测得的空气中氧气的体积分数为(列出计算式即可)。
2.用右图所示装置测定空气中氧气的体积分数,实验时先在实际容积为250mL的集气瓶中装进50mL的水,在粗铜丝末端的铜勺中放足量白磷,按图连好仪器,点燃酒精灯加热铜丝一端,白磷燃烧。
(1)若实验成功,最终集气瓶中水的体积约为____________mL。
(2)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是_______;由此现象分析,影响气体压强的主要因素有__________________。
三、气液模型
装置
操作
现象
方程式
解释原因
1.打开K1,
关闭K2
2.关闭K1,打开K2
1.打开K1,
关闭K2
2.关闭K1,
打开K2
1.打开K2,K3,关闭K1;
2.打开K1,关闭K2,K3
1.打开K2,K3,关闭K1;
2.打开K1,关闭K2,K3
练习:
1.(4分)化学小组用下图所示装置研究酸碱盐的性质(夹持仪器已省略)。
(1)关闭K2,打开K1和分液漏斗玻璃塞、活塞,向B装置中加入稀盐酸,使其浸没大理石后关闭分液漏斗活塞。
A中反应的化学方程式为,B中发生反应的化学方程式为。
(2)当B中的物质仍在反应时,关闭K1,打开K2。
一段时间后C中的现象为;
充分反应后,C中一定含有溶质NaCl的原因是。
2.(4分)为了研究反应中压强的变化情况,利用下图进行实验。
(1)检查装置气密性:
打开a,关闭b,在A中加入水,,则装置的气密性良好。
用同样原理可以检查装置另一侧的气密性。
(2)在A、B中分别加入澄清石灰水,在集气瓶内放入一定量的大理石,将a、b都打开,用注射器加入足量稀盐酸直至液面浸没下端管口,保持注射器活塞不动。
此时,可观察到的现象是。
(3)关闭b,集气瓶中持续产生气体,A中的现象是。
判断A中是否发生化学反应:
(若没有反应,写出理由;若发生反应,写出化学方程式)。
三、由现象推操作
1.某探究性学习小组,利用下列改进装置对物质燃烧的条件进行探究。
【查阅资料】①白磷有剧毒,可以用酸性高锰酸钾溶液除去白磷。
②五氧化二磷扩散到空气中,刺激人的呼吸道,影响健康、污染环境。
(1)打开止水夹,缓缓推动注射器活塞,观察到烧瓶中白磷周围产生火星.液面上方产生大量白烟。
该现象说明过氧化钠能与水反应生成,同时证明了燃烧的条件之一是。
(2)此实验充分体现了绿色化学的要求,对有害物质进行了处理。
氢氧化钠的作用是。
实验结束后为了处理掉残留的少量白磷,可以把氢氧化钠溶液换成酸性高锰酸钾溶液,然后(填操作方法),使溶液进入烧瓶中消除可能残留的白磷。
对比实验
一、单一因素对比实验
1.(3分)对比归纳是学习化学的重要方法。
请回答下列问题。
实验一实验二实验三
(1)实验一实验目的。
(2)实验二用于证明二氧化碳和氢氧化钠能否反应,该实验设计不符合对比实验的基本原则,理由是__________。
(3)实验三观察到A中固体几乎不溶,B中固体全部溶解,由此得到实验结论。
2.(3分)如下图所示的3个实验都采用了对比的方法。
实验一
实验二
实验三
洗脸笑脸扫把扫地种地没有许多许可冷热淡红淡绿
1、写自己想说的话,写想像中的事物,写出自己对周围事物的认识和感想。
(1)实验一是探究 对硝酸钾溶解性的影响。
慢——(快)(南)——(北)(古)——(今)闲——(忙)
(2)实验二是探究NaCl在不同溶剂中的溶解性,应该保持相同的物理量是_________________(填序号)。
A.温度B.NaCl的质量C.水和酒精的质量
3.(3分)某研究小组对影响过氧化氢分解反应速率的某些因素进行实验探究。
(1)探究H2O2溶液的浓度对其分解反应速率的影响
又白又胖又大又红又大又多【实验1】用50mL不同浓度的H2O2溶液进行实验,测定各次收集到100mL氧气时所用的时间,记录数据如下(其他实验条件如温度、催化剂种类和用量等均相同):
又细又长又白又胖又唱又跳又紫又亮实验次序
1
亮晶晶的眼睛绿油油的荷叶多彩的季节金黄的稻子2
美丽的风景精彩的球赛高远的蓝天雪白的肚皮3
4
3、把乱的词语连成一句通顺的话。
5
加两笔:
口——(只)(古)(石)(右)(可)(加)(叶)H2O2溶液浓度
各种句式的掌握1%
5%
15%
25%
30%
所用时间/s
660
205
25
4
3
通过分析得出结论 。
(2)【实验2】用30mL10%的H2O2溶液进行实验,测定各次收集到500mL氧气时所用的时间,结果如下(其他实验条件如温度等均相同):
实验次序
1
2
3
4
5
MnO2用量/g
0.2
0.4
0.6
0.8
1.0
所用时间/s
8
5
3
2
2
此实验的目的是探究对过氧化氢分解制氧气反应速率的影响。
4.某学习小组利用如图所示实验装置研究影响金属与硫酸反应速率的因素。
换不同溶质质量分数、不同体积的硫酸,与质量相同的同一种锌粒重复实验。
每次实验的数据记录如下表:
实验
1
2
3
4
5
6
硫酸用量/mL
10
20
40
10
20
40
硫酸的溶质质量分数/%
10
10
10
20
20
20
收集所用时间/s
106
102
97
45
41
40
(3)通过比较实验______(填数字)的数据可以得出,对金属与硫酸反应速率有显著影响的是_______________。
5.(4分)注射器在化学实验中替代实验仪器,既能优化设计思路,又能增强实验效果。
选用镁片、锌片与酸反应,利用图C所示装置探究镁、锌的活动性强弱。
从金属的角度说明需要控制的变量是。
从酸的角度说明需要控制的变量是;实验时通过测定来比较镁、锌的活动性。
7.(3分)某同学利用以下用品进行二氧化碳性质实验。
图1软塑料瓶图2点滴板
【实验2】在图2点滴板①②两个孔内各滴加2滴紫色石蕊溶液;再向①孔中滴加5滴实验
1塑料瓶中的液体,向②孔中滴加5滴蒸馏水,观察到①孔中紫色石蕊变红,②孔中滴加等量蒸馏水的目的是_______________________________________。
二、双因素对比实验
难点突破1:
描述现象、根据现象写结论
8.(4分)用下图所示装置进行实验,研究燃烧的条件。
已知:
白磷的着火点为40℃,红磷的着火点为240℃。
(1)当H2O2溶液与MnO2接触时,发生反应的化学方程式为______________________________。
(3)向Y型管中挤入H2O2溶液后,观察到导管口开始产生气泡时,烧杯中白磷不燃烧;一段时间后,白磷燃烧,此现象能够证明的可燃物燃烧的条件是____________________________________;
若证明可燃物燃烧的另一个条件,依据的现象是______________________________________。
9.(4分)某化学小组利用下图进行如下实验,实验前K1、K2均关闭。
(1)用甲、乙装置证明可燃物的燃烧条件。
甲、乙装置中分别放入一小块白磷,再向甲、乙装置中分别加入后,打开K2,从a处通入氧气,观察到甲中白磷不燃烧,乙中白磷燃烧,其反应的化学方程式为。
(2)用甲、乙装置证明二氧化碳能与水反应。
乙中放一朵干燥的紫色石蕊溶液浸泡过的小花,打开K2,从a处通入潮湿的二氧化碳气体,紫色小花不变红,甲瓶中所盛的试剂是。
为达到实验目的,后续的实验操作及现象是。
难点突破2:
设计对比实验
10.(4分)利用右图装置可做多个实验。
(1)若在左管中加入浓氨水,右管中加入酚酞溶液,可观察到的现象是。
(2)若将左管倾斜使其中的液体与右管中的固体暗暗暗暗啊接触,观察到有大量气泡
产生,气球鼓起,则左、右管中所加的药品可能为。
(3)利用右图装置设计实验,证明可燃物燃烧条件之一为“温度达到物质的着火点”。
可供选择的其他实验用品:
烧杯、、红磷、白磷、热水、冷水
实验操作(可用文字叙述,也可用图示)
实验现象
11-1.依据下图进行实验(夹持仪器略去)。
实验过程:
①通入N2,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通O2,a中无明显现象,b中红磷燃烧。
(1)实验过程②中,对比a、b中的实验现象,可知可燃物燃烧的条件之一是。
(2)实验过程中,能说明可燃物燃烧需要氧气的实验现象是。
(3)实验过程中,能说明可燃物燃烧需要温度达到着火点的实验现象是_____________。
11-2.(2分)依据下图进行实验(夹持仪器略去)。
(1)若a中放干燥的紫色石蕊试纸,b中放湿润的紫色石蕊试纸,实验时通入二氧化碳,观察到___________________,说明二氧化碳能与水反应。
(2)若a、b中分别放入红磷,b处下方放置酒精灯,可用于验证可燃物燃烧条件。
则后续实验的操作步骤及现象是___________________。
12.镁条在空气中久置表面会变黑。
某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号
主要实验操作
实验现象
1
先充满用NaOH浓溶液洗涤过的空气
再加入2mL浓硫酸
镁条始终无明显变化
2
加入2mLNaOH浓溶液
镁条始终无明显变化
3
先加入2mL浓硫酸
再通入约4mLCO2
镁条始终无明显变化
4
先加入4mL饱和Na2SO3溶液
再充满CO2
镁条始终无明显变化
5
先加入2mL蒸馏水
再通入约4mLCO2
镁条第3天开始变黑
至第20天全部变黑
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是。
(2)实验1的目的是。
(3)实验3中,试管内的气体主要含有CO2、。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是(填编号)。
(5)由上述实验可推知,镁条变黑的条件是。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸根,所需要的试剂是。
13.铜是生活中常见的一种金属。
小明观察到铜制眼镜框上常出现一层绿色物质,为此他请你一起探究:
探究铜生成铜绿的条件。
【提出问题】镜框上绿色物质出现的条件是什么?
【查阅资料】铜制镜框上的绿色物质俗称铜绿[化学式是Cu2(OH)2CO3],它受热会分解生成三种氧化物。
铜绿分解的化学方程式为___________________________________。
【猜想与假设】 根据铜绿的组成和查阅的资料判断,铜绿可能是铜与氧气及__________ 共同作用而形成的。
【设计与实验】借鉴课本“铁钉锈蚀条件的探究”实验,小梁设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“
”为铜片):
(1)实验较长时间后,发现_____试管中铜片最先生锈(填试管字母编号)。
(2)实验F中,试管内的气体主要含有。
(3)得出“铜片变黑一定与H2O有关”结论,依据的两个实验是(填编号)。
(4)得出“铜片变黑一定与O2有关”结论,依据的两个实验是(填编号)。
(5)得出“铜片变黑一定与CO2有关”结论,需观察到的实验现象是。
(6)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是____________________________。
【评价与改进】 小区认为小梁设计的实验还不够完善,要得出正确的结论,还要补充一个实验。
你认为要补充的一个实验是(用图表示亦可)______________。
【拓展与应用】
(1)小明发现从不同地点收集到的两个铜器(一个是纯铜做的,一个是青铜做的)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀。
小明的分析是否全面?
请你说明理由__________________________________。
(2)写出一种防止铁或铜等金属制品生锈的具体方法。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 初中化学 有关 压强 对比 实验 专项 训练
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
