 苏州届中考化学复习专题二元素物质的分类讲学案.docx
苏州届中考化学复习专题二元素物质的分类讲学案.docx
- 文档编号:5020330
- 上传时间:2022-12-12
- 格式:DOCX
- 页数:18
- 大小:220.96KB
苏州届中考化学复习专题二元素物质的分类讲学案.docx
《苏州届中考化学复习专题二元素物质的分类讲学案.docx》由会员分享,可在线阅读,更多相关《苏州届中考化学复习专题二元素物质的分类讲学案.docx(18页珍藏版)》请在冰豆网上搜索。
苏州届中考化学复习专题二元素物质的分类讲学案
第二讲:
元素、物质的分类
考纲要求:
1、知道物质由100多种元素组成;元素的简单分类,能根据原子序数在元素周期表中找到指定的元素。
2、掌握常见的元素符号、离子符号和名称;知道元素符号、离子符号和原子结构示意图表达的意义。
3、能看懂某些商品标签上标示的组成元素及其含量。
知道某些元素对人体健康的重要作用。
4、能区别典型的混合物、纯净物;能区别典型的有机物和无机物;判断典型的单质、化合物。
5、区别典型的酸、碱、盐、氧化物,能从元素组成上认识氧化物,识记典型物质的名称。
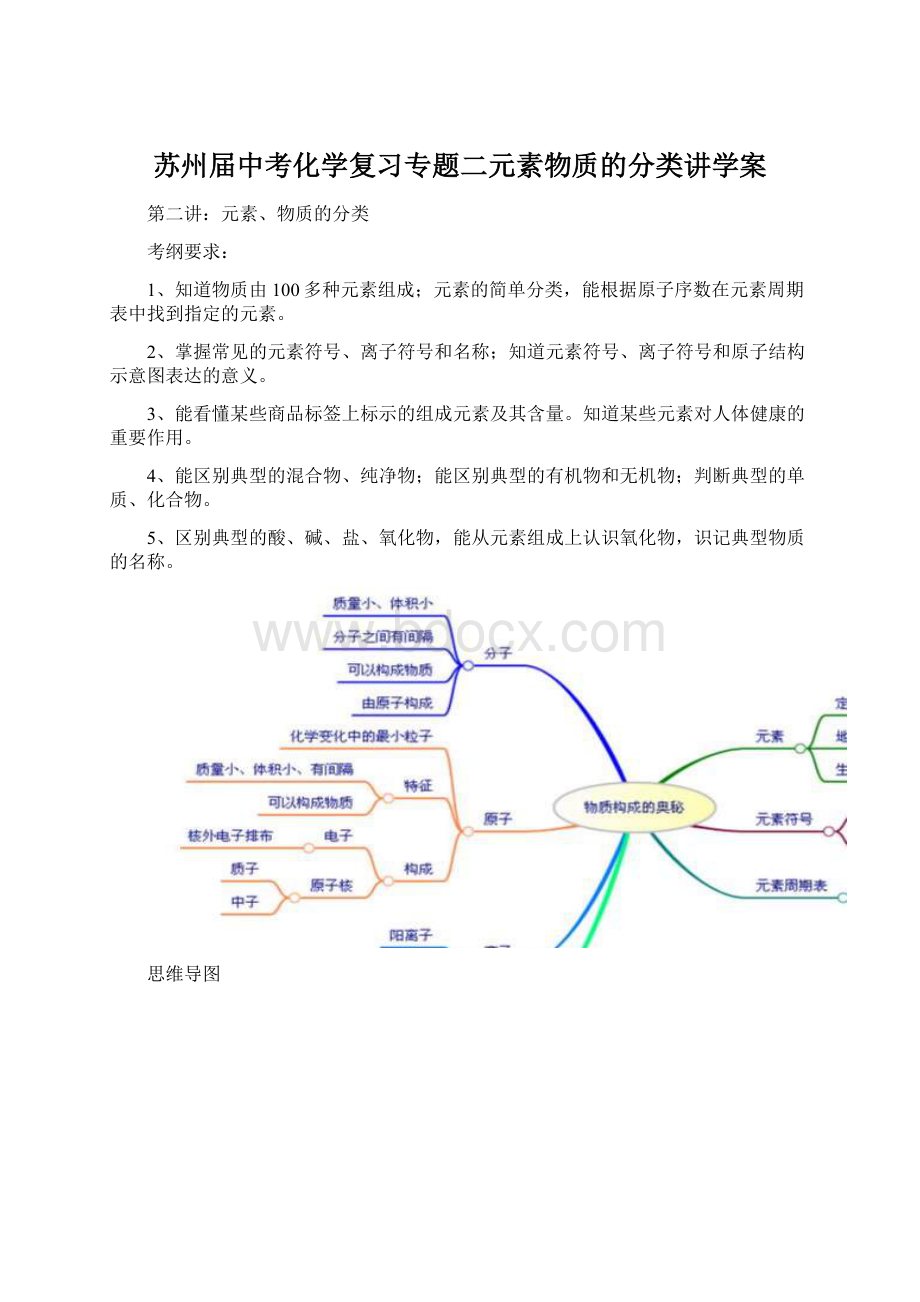
思维导图
中考重难点突破
1、元素
元素符号的写法:
①由一个字母表示的元素符号要大写,如:
H、C、S、P,K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。
如:
Na、Mg、Ca、Zn、Si。
元素周期表的结构:
①每一横行(周期):
元素周期表每一横行叫做一个周期.共有7个横行,即7个周期。
每个周期开头是金属元素(第一周期除外),靠近尾部是非金属元素,结尾的是稀有气体元素。
同一周期元素的原子具有相同的电子层数。
②每一纵行(族):
元素周期表共有18个纵行,每一个纵行叫做一个族(第8,9,10三个纵行共同组成一个族),共有16个族。
③每一格:
在元素周期表中,每一种元素均占据一格。
对于每一格,均包含元素的原子序数、元素符号、元素名称、相对原了质量等内容,如下图所示:
元素符号和化学式的关系:
化学用语
元素符号
化学式
意义
宏观
表示一种元素
表示一种物质(由原子构成的物质)
表示这种物质
表示这种物质由几种元素组成
微观
表示该元素的一个原子
表示这种物质的一个分子〔由分子构成的物质)表示一个分子含有各原子的个数(由分子构成的物质)
量的意义
——
表示这种物质的相对分子质量
表示这种物质中各元素的原子个数比和质量之比
表示物质中各组成元素的质量分数
举例
H
表示氢元素
表示一个氢原子
H2O
表示水
表示水是由氢元素和氧元素组成的
表示1个水分子
表示1个水分子中含有2个氢原子和1个氧原子
注意事项
单独的化学式和元素符号,既有宏观意义,又有微观意义化学式和元素符号前加上数字,则只表示微观意义,即只表示相应的粒子个数,如“2H”表示两个氢原子,"3H2O"表示三个水分子化学式中元素符号右下角的数字表示每个分子中所含该元素原子的个数,如“CO2”中的”2”表示一个二氧化碳分子中含有两个氧原子
二、物质的分类
1.混合物:
是由两种或两种以上的物质混合而成(或由不同种物质组成)例如,空气,溶液(盐酸、
澄清的石灰水、碘酒、矿泉水),矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)
注意:
氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
2.纯净物:
由一种物质组成的。
例如:
水、水银、蓝矾(CuSO4·5H2O)都是纯净物
冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
注意:
由同一种元素构成的物质不一定是纯净物(如O2、O3);具有相同组成(如最简式、分子式相同)的物质也不一定是纯净物,要充分考虑是否存在同素异形体或同分异构体。
3.单质:
由同种(或一种)元素组成的纯净物。
例如:
铁氧气(液氧)、氢气、水银。
4.化合物:
由不同种(两种或两种以上)元素组成的纯净物。
名称中有“某化某”“某酸某”的是化合物。
5.有机物(有机化合物):
含碳元素的化合物(除CO、CO2和含碳酸根化合物外)
无机物:
不含碳元素的化合物以及CO、CO2和含碳酸根的化合物
6.氧化物:
由两种元素组成,其中一种是氧元素的化合物。
7.酸:
电离时生成的阳离子全部是氢离子的化合物。
酸溶液的pH值小于7
酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H”,酸由氢和酸根离子组成
紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
根据酸的组成,通常有以下两种分类方法:
酸的电离方程式:
酸=nH++酸根离子n-
8.碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
碱通常由金属离子和氢氧根离子构成
溶碱有五种:
钾钙钠钡氨(KOH,Ca(OH)2,NaOH,Ba(OH)2,氨水)它们的溶液无色。
有颜色的碱(不溶于水):
红褐色的氢氧化铁(Fe(OH)3↓)、蓝色的氢氧化铜(Cu(OH)2↓)
其他固体碱是白色。
碱的名称通常有“氢氧化某”,化学式的最后面是“OH”
可溶性碱的溶液pH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红色
鉴定可溶性碱溶液(鉴定OH-)
方法一:
加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱.
方法二:
加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。
9.盐:
电离时生成金属离子和酸根离子的化合物。
第一种分类方法:
a.正盐(酸碱完全中和的产物,没有可电离的氢离子或氢氧根离子),例如NaCl、Na2SKNO3
无氧酸正盐叫“某化某”
含氧酸盐叫“某酸某”
b.酸式盐(多元酸里的氢部分被金属取代,H夹在中间)
NaHCO3、Ca(HCO3)2、NaH2PO4
常见的酸式盐的酸根有:
HCO3-、HSO4-、H2PO4-、HPO42-
c.碱式盐(化学式的中间有“OH”):
Cu2(OH)2CO3
第二种分类方法
按盐中相同部分的离子称为某类盐:
含碳酸根离子的盐称为碳酸盐、含硫酸根离子的盐称为硫酸盐、含硝酸根离子的盐称为硝酸盐、含铁离子的盐称为铁盐,等等。
10.酸碱指示剂(石蕊试液、无色酚酞)和pH值:
酸溶液的pH值小于7(如盐酸、稀硫酸、硝酸),酸性越强pH值越小,酸性越弱pH值越大。
水、中性的硫酸盐、硝酸盐和盐酸盐溶液不能使指示剂变色,pH值等于7。
不能使指示剂变色;可溶的碱溶液pH值大于7。
碱性越强pH值越大,碱性越弱pH越小
考点突破
例题1:
(2016•常德)中国科学院院士张青莲教授主持测定了铕、铱等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献,下列关于铕的说法中正确的是( )
A.原子序数为63B.属于非金属元素
C.原子核外电子数为89D.相对原子质量为152.0g
答案:
A
分析:
根据元素周期表中的一个小格所提供的信息进行分析解答本题.
解答:
A.由元素周期表的信息可知,其原子序数为63,故正确;
B.铕元素带“钅”字旁,属于金属元素,故错误;
C.在原子中,原子序数=质子数=核外电子数,所以铕原子核外有63个电子,故错误;
D.相对原子质量的单位不是“g”而是“1”,通常省略不写,故错误.
例题2:
不同种元素粒子之间肯定不相同的是( )
①核电荷数 ②电子数 ③质子数 ④电子层数 ⑤最外层电子数 ⑥存在的形态.
A.④⑤
B.①③
C.②③④
D.①③⑥
答案:
B
解析:
元素是具有相同核电荷数(即质子数)的一类原子的总称,在原子中,核电荷数=质子数=核外电子数;在离子中核电荷数不等于电子数.质子数决定元素种类.不同种元素之间核电荷数、原子序数肯定不同,但电子数、电子层数、最外层电子数、存在状态可能相同,如钠离子和镁离子质子数不同,属于不同元素,但电子数都为10,电子层数相同,都是两层,最外层电子数也相同,都是8个,存在状态也都以化合态存在.
例题3.教版九年级化学上册教材图3﹣12部分原子的结构示意图如下:
请回答:
(1)氧元素与硫元素化学性质相似的原因是 ;
(2)写出11号和17号元素组成化合物的化学式 ;
(3)同一周期(横行)的原子结构示意图具有共同的特点是 (任写一点).
答案:
(1)两种原子的最外层电子数相同;
(2)NaCl;(3)电子层数相同;
解析:
(1)由于元素的性质主要由最外层的电子数决定的,氧元素与硫元素化学性质相似的原因是:
两种原子的最外层电子数相同;
(2)原子序数为11元素为钠元素,原子序数为17的元素为氯元素,钠为+1价,氯为﹣1价,故组成化合物的化学式为NaCl.
(3)由原子结构示意图的特点可以看出,同一周期(横行)的原子结构示意图具有共同的特点是电子层数相同等.
例题4.“分类”可以使人们有序的研究物质,以下分类正确的是( )
A、合金:
生铁、锰钢、青铜
B、碱:
纯碱、烧碱、消石灰
C、盐:
氯化银、氯化钠、氯化氢
D、合成材料:
塑料、合成纤维、铝合金
答案:
A
解析:
A、合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,生铁、锰钢、青铜都属于合金,故选项正确;
B、纯碱、烧碱、消石灰中,纯碱属于盐,不属于碱,故选项错误;
C、氯化银、氯化钠、氯化氢中,氯化银、氯化钠属于盐,氯化氢不属于盐,故选项错误;
D、合成材料包括塑料、合成纤维、合成橡胶,铝合金属于金属材料,故选项错误;
例题5.(2016•乌鲁木齐)元素周期表是学习和研究化学的重要工具.表是元素周期表的一部分,A﹣F代表六种不同短周期元素.下列说法不正确的是( )
A、原子序数E<C
B、A、D同族
C、A、B同周期
D、C、F化学性质相似
答案:
A
解析:
A、同一族,从上到下核外电子层数逐渐增加,相邻的不同周期质子数相差8,所以C与E不可能相等,所以核内质子数:
E>C,说法错误,故A错误;
B、同一竖列,为同族,而A、D是同一列,即同族;故B正确;
C、同一周期,从左向右原子序数增加,所以原子序数C>B,故C正确;
D、同一竖列,为同族,化学性质相似,而C、F是同一列,即同族,C、F化学性质相似;
考点过关
1、如图为元素周期表的一部分.下列说法不正确的是( )
A.钠、镁、铝三种原子的电子层都有3个层
B.氢、锂、钠三种原子的最外层都有1个电子
C.铍、镁两种原子易得到电子变成离子
D.图中有5种金属元素
2、美国布法罗大学的研究人员发现,无需加热只要加水,直径约10纳米的球形硅粒子几乎在瞬间即可产生纯度高的氢气同时生成硅酸(无毒的副产品),未来可作为便携式设备能源供给的一个潜在来源.如图是硅元素的部分信息,下列说法错误的是( )
A.原子序数是14
B.硅元素是金属元素
C.原子核外有14个电子
D.相对原子质量是28.09
3.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.下列说法正确的是( )
A、钠、氯都属于金属元素
B、氯化钠是由a、d两种粒子构成的
C、氯的相对原子质量是35.45g
D、a表示的是一种阴离子
4.汞使用的历史很悠久,用途很广泛.在元素周期表中,汞元素的信息如图所示,对图中信息解释正确的是( )
A、汞属于金属元素
B、汞原子核外电子数是200.6
C、汞原子核内中子数是80
D、汞原子的相对原子质量是80
5.我国著名化学家张青莲教授主持测定的锌、锗等元素的相对原子质量数值,被国际原子量委员会采用为国际新标准.下表是元素周期表的一部分,下列说法正确的是( )
30Zn
锌
65.38
32Ge
锗
72.63
A、锌原子核内有32个质子
B、锌元素的相对原子质量为65.38
C、锗属于非金属元素
D、锗原子中的中子数为32
6、元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )
元素
Na
Mg
①
Si
P
②
Cl
原子的最外层电子数
1
2
3
4
5
6
7
原子半径(10﹣10m)
1.86
1.60
1.43
③
1.10
1.02
0.994
最高正价
最低负价
+1
+2
④
+4
﹣4
+5
﹣3
⑤
+7
﹣1
A、⑤处的最高正价是+6,最低负价是﹣2
B、③处的数值介于1.10﹣1.43之间
C、第三周期元素(Na﹣Cl)的最高正价数等于其原子的最外层电子数元素
D、①的原子序数是13,①和②形成的化合物的化学式为AlS
7.下列液态物质中,属于纯净物的是( )
A、食盐水
B、碘酒
C、液氢
D、矿泉水
8、氯元素在自然界中广泛存在,下列说法不正确的是( )
A、氯元素属于非金属元素
B、海水中含量最高的元素是氯元素
C、氯原子易得电子形成氯离子(Cl﹣)
D、氯气(Cl2)是由氯气分子构成
99.(2016•青岛)青岛是一座美丽的滨海城市,海洋资源非常丰富.如图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )
A.氯是一种非金属元素
B.钠元素的相对原子质量是22.99
C.钠原子的中子数为11
D.氯元素的原子序数为17
B.根据元素周期表中的一格中获取的信息,可知钠原子的相对原子质量为22.99,故正确;
C.根据元素周期表中的一格中获取的信息,钠元素的原子序数为11,即核内质子数为11,而不是中子数,故错误;
A、
10.如图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:
(1)上述六种元素中属于金属元素的是 (填元素名称),己元素的化学性质与 (填元素符号)元素相似.
(2)在化学反应中,戊元素的原子容易 (填“失去”或得到)电子形成阳离子,该元素的离子符号是 .该元素单质与氧气反应的化学方程式是 .
(3)甲、乙元素和碳元素、氧元素组成的一种常见氮肥的化学式为:
.
2、如图为元素周期表的一部分.下列说法不正确的是( )
B.钠、镁、铝三种原子的电子层都有3个层
B.氢、锂、钠三种原子的最外层都有1个电子
C.铍、镁两种原子易得到电子变成离子
D.图中有5种金属元素
1、答案:
C
解析:
A.钠、镁、铝三种原子位于第3周期,故核外都是三个电子层上有电子;故正确;
B.氢、锂、钠三种原子位于第一主族,最外层都有1个电子;
C.铍、镁两种原子的最外层有2个电子,故是易失去电子达到稳定结构;
D.根据元素名称可知图中锂、铍、钠、镁、铝5种金属元素.
2、美国布法罗大学的研究人员发现,无需加热只要加水,直径约10纳米的球形硅粒子几乎在瞬间即可产生纯度高的氢气同时生成硅酸(无毒的副产品),未来可作为便携式设备能源供给的一个潜在来源.如图是硅元素的部分信息,下列说法错误的是( )
A.原子序数是14
B.硅元素是金属元素
C.原子核外有14个电子
D.相对原子质量是28.09
2、答案:
B
解析:
A、根据元素周期表中硅元素的相关信息,可知硅的原子序数是14,故说法正确;
B、根据化学元素汉字名称的偏旁可辨别元素的种类,可知硅元素是非金属元素;故说法错误;
C、根据元素周期表中硅元素的相关信息可知,硅原子核外电子数=原子序数=14,故说法正确;
D、根据元素周期表中硅元素的相关信息可知,硅元素原子的相对原子质量是28.09,故说法正确.
3.如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.下列说法正确的是( )
A、钠、氯都属于金属元素
B、氯化钠是由a、d两种粒子构成的
C、氯的相对原子质量是35.45g
D、a表示的是一种阴离子
3、答案:
B
解析:
A.钠元素属于金属元素,而氯元素的偏旁是“气”,可见属于非金属元素,故错误;
B.氯化钠是由钠离子和氯离子构成的,a核内有11个质子,核外有10个电子,是钠离子,d核内有17个质子,核外有18个电子,是氯离子,故正确;
C.相对原子质量的单位是“1”,通常省略,而不是“g”,故错误;
D.a中,质子数>核外电子数,属于阳离子,故错误.
4.汞使用的历史很悠久,用途很广泛.在元素周期表中,汞元素的信息如图所示,对图中信息解释正确的是( )
A、汞属于金属元素
B、汞原子核外电子数是200.6
C、汞原子核内中子数是80
D、汞原子的相对原子质量是80
4、答案:
A
解析:
A.从该图中得到的信息可知,该元素的元素名称为“汞”,是金属元素,故正确;
B.200.6是汞的相对原子质量而不是电子数,故错误;
C.80是汞元素的原子序数,即核电荷数、质子数,而不是核内中子数,故错误;
D.由元素周期表可知,80是汞的原子序数、核电荷数、原子核内质子数,而不是相对原子质量,故错误.
5.我国著名化学家张青莲教授主持测定的锌、锗等元素的相对原子质量数值,被国际原子量委员会采用为国际新标准.下表是元素周期表的一部分,下列说法正确的是( )
30Zn
锌
65.38
32Ge
锗
72.63
E、锌原子核内有32个质子
F、锌元素的相对原子质量为65.38
G、锗属于非金属元素
H、锗原子中的中子数为32
5、答案:
B
解析:
A.原子序数=核内质子数,由元素周期表可知,锌的原子核内有30个质子,故错误;
B.由元素周期表可知,锌的相对原子质量为65.38,故正确;
C.由元素名称锗可知,其汉字名称的偏旁是“金”,属于金属元素,故错误;
D.由元素周期表可知,锗原子中的质子数为32而不是中子数,故错误.
6、元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正确的是( )
元素
Na
Mg
①
Si
P
②
Cl
原子的最外层电子数
1
2
3
4
5
6
7
原子半径(10﹣10m)
1.86
1.60
1.43
③
1.10
1.02
0.994
最高正价
最低负价
+1
+2
④
+4
﹣4
+5
﹣3
⑤
+7
﹣1
E、⑤处的最高正价是+6,最低负价是﹣2
F、③处的数值介于1.10﹣1.43之间
G、第三周期元素(Na﹣Cl)的最高正价数等于其原子的最外层电子数元素
H、①的原子序数是13,①和②形成的化合物的化学式为AlS
6、答案:
D
解析:
A、化合价从+1至+7依次增大,从Si开始有变价,负价逐渐减小,故④为+3,⑤为+6和﹣2,故A正确;
B、由表中信息可知:
元素原子的半径逐渐增大,③处的数值介于1.10﹣1.43之间,故B正确;
C、第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数,故C正确;
D、第三周期元素从左至右依次为Na、Mg、Al、Si、P、S、Cl,所以①是Al;②是S,①和②形成的化合物的化学式为Al2S3,故D错误;
7.下列液态物质中,属于纯净物的是( )
A、食盐水B、碘酒C、液氢D、矿泉水
7、答案:
C
解析:
A、食盐水中有食盐、水,属于混合物,故选项错误;
B、碘酒中有碘、酒精,因此碘酒属于混合物,故选项错误;
C、液氢中只有氢分子,属于纯净物中的单质,故选项正确;
D、矿泉水中有矿物质、水等物质,属于混合物,故选项错误;
8、氯元素在自然界中广泛存在,下列说法不正确的是( )
E、氯元素属于非金属元素
F、海水中含量最高的元素是氯元素
G、氯原子易得电子形成氯离子(Cl﹣)
H、氯气(Cl2)是由氯气分子构成
8、答案:
B
解析:
A、氯元素带“气”字旁,属于气态非金属元素,正确;
B、海水中含量最高的元素是氧元素,错误;
C、已知氯原子结构示意图是
,则每个氯原子易得到1个电子形成氯离子Cl﹣.正确
D、氯气(Cl2)是由氯气分子构成,正确
9.(2016•青岛)青岛是一座美丽的滨海城市,海洋资源非常丰富.如图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )
A.氯是一种非金属元素
B.钠元素的相对原子质量是22.99
C.钠原子的中子数为11
D.氯元素的原子序数为17
答案:
C
分析:
根据图中元素周期表可以获得的信息:
左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可.
解答:
A.氯元素的偏旁是“气”,可见属于非金属元素,故正确;
B.根据元素周期表中的一格中获取的信息,可知钠原子的相对原子质量为22.99,故正确;
C.根据元素周期表中的一格中获取的信息,钠元素的原子序数为11,即核内质子数为11,而不是中子数,故错误;
D.根据元素周期表中的一格中获取的信息,氯元素的原子序数为17,故正确.
10.如图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:
(1)上述六种元素中属于金属元素的是 (填元素名称),己元素的化学性质与 (填元素符号)元素相似.
(2)在化学反应中,戊元素的原子容易 (填“失去”或得到)电子形成阳离子,该元素的离子符号是 .该元素单质与氧气反应的化学方程式是 .
(3)甲、乙元素和碳元素、氧元素组成的一种常见氮肥的化学式为:
.
10、
答案
(1)钠、铝,丙.
(2)失去,Al3+.4Al+3O2═2Al2O3;(3)NH4HCO3[CO(NH2)2].
解析:
(1)由微粒的核内质子数可知,上述六种元素中丁、戊的质子数分别是11、13,分别是钠、铝,属于金属元素,由于己原子的最外层电子数与丙原子的元素的电子数相同都是7,化学性质相似.
(2)戊元素的原子的最外层电子数是3,小于4,容易失去电子形成阳离子,质子数是13,该元素的离子是铝离子,符号是Al3+.该元素单质是铝与氧气反应生成了氧化铝,化学方程式是:
4Al+3O2═2Al2O3.
(3)甲、乙元素分别是氢元素、氮元素,和碳元素、氧元素组成的常见氮肥的为碳酸氢铵和尿素,化学式为:
NH4HCO3、CO(NH2)2.
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 苏州 中考 化学 复习 专题 元素 物质 分类 讲学
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
