 九年级化学元素化合物知识点复习.docx
九年级化学元素化合物知识点复习.docx
- 文档编号:3942144
- 上传时间:2022-11-26
- 格式:DOCX
- 页数:15
- 大小:230.56KB
九年级化学元素化合物知识点复习.docx
《九年级化学元素化合物知识点复习.docx》由会员分享,可在线阅读,更多相关《九年级化学元素化合物知识点复习.docx(15页珍藏版)》请在冰豆网上搜索。
九年级化学元素化合物知识点复习
元素化合物知识点复习
第二单元《我们周围的空气》知识点
1、第一个对空气组成进行探究的化学家:
拉瓦锡(第一个用天平进行定量分析)。
2、空气的成分和组成
空气成分
O2
N2
CO2
稀有气体
其它气体和杂质
体积分数
21%
78%
0.03%
0.94%
0.03%
点燃
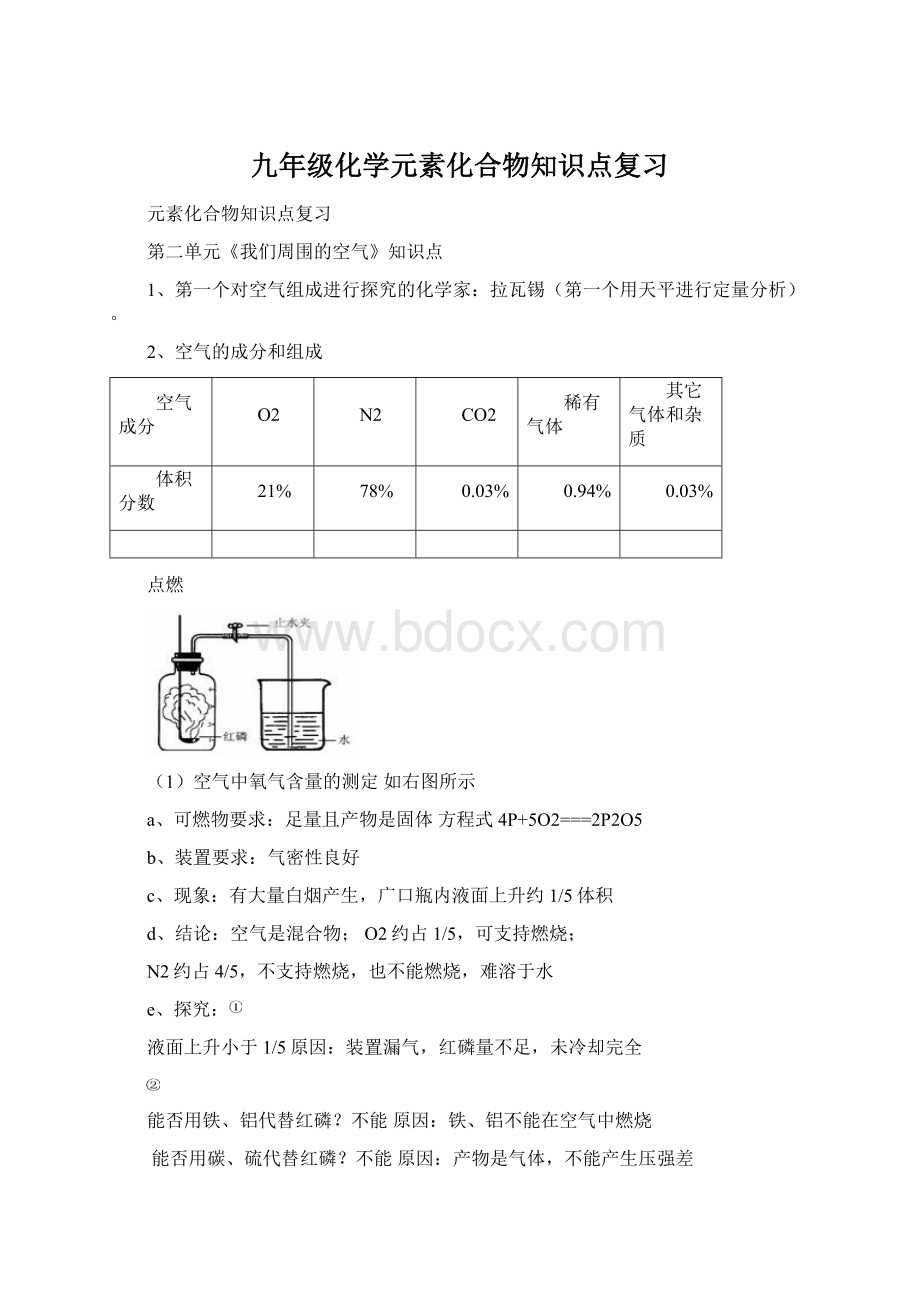
(1)空气中氧气含量的测定如右图所示
a、可燃物要求:
足量且产物是固体方程式4P+5O2===2P2O5
b、装置要求:
气密性良好
c、现象:
有大量白烟产生,广口瓶内液面上升约1/5体积
d、结论:
空气是混合物;O2约占1/5,可支持燃烧;
N2约占4/5,不支持燃烧,也不能燃烧,难溶于水
e、探究:
液面上升小于1/5原因:
装置漏气,红磷量不足,未冷却完全
能否用铁、铝代替红磷?
不能原因:
铁、铝不能在空气中燃烧
能否用碳、硫代替红磷?
不能原因:
产物是气体,不能产生压强差
(2)空气的污染及防治:
对空气造成污染的主要是有害气体(CO、SO2、氮的氧化物)和烟尘等
目前计入空气污染指数的项目为CO、SO2、NO2、O3和可吸入颗粒物等。
(3)空气污染的危害、保护:
危害:
严重损害人体健康,影响作物生长,破坏生态平衡.全球气候变暖,臭氧层破坏和酸雨等
保护:
加强大气质量监测,改善环境状况,使用清洁能源,工厂的废气经处理过后才能排放,积极植树、造林、种草等
(4)目前环境污染问题:
臭氧层破坏(氟里昂、氮的氧化物等)温室效应(CO2、CH4等)
酸雨(NO2、SO2等)白色污染(塑料垃圾等)
6.氧气
(1)氧气的化学性质:
特有的性质:
支持燃烧,供给呼吸
(2)氧气与下列物质反应现象
物质
现象
碳
放热,(在空气中发红光),在氧气中发出白光,产生使澄清石灰水变浑浊的气体
磷
放热,产生大量白烟,生成白色固体。
硫
放热,(在空气中发出微弱的淡蓝色火焰),在氧气中发出明亮的蓝紫色火焰,
产生有刺激性气味的气体
镁
放热,发出耀眼的白光,生成白色固体
铝
铁
剧烈燃烧,放热,火星四射,生成黑色固体(Fe3O4)
石蜡
在氧气中燃烧发出白光,瓶壁上有水珠生成,产生使澄清石灰水变浑浊的气体
*铁、铝燃烧要在集气瓶底部放少量水或细砂的目的:
防止溅落的高温熔化物炸裂瓶底
*铁、铝在空气中不可燃烧。
(3)氧气的制备:
工业制氧气——分离液态空气法(原理:
氮气和氧气的沸点不同物理变化)
实验室制氧气原理2H2O2MnO22H2O+O2↑
2KMnO4△K2MnO4+MnO2+O2↑
2KClO3MnO22KCl+3O2↑
(4)气体制取与收集装置的选择△
发生装置:
固固加热型、固液不加热型
收集装置:
根据物质的密度、溶解性。
氧气可用向上排空气法收集(密度比空气略大)、排水法收集(不易溶于水)
(5)制取氧气的操作步骤和注意点(以高锰酸钾制取氧气并用排水法收集为例)
a、步骤:
连—查—装—固—点—收—离—熄
b、注意点
①试管口略向下倾斜:
防止冷凝水倒流引起试管破裂
②药品平铺在试管的底部:
均匀受热
③铁夹夹在离管口约1/3处
④导管应稍露出橡皮塞:
便于气体排出
⑤试管口应放一团棉花:
防止高锰酸钾粉末进入导管
⑥排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气)
⑦实验结束时,先从水中移出导管再熄灭酒精灯:
防止水倒吸引起试管破裂
⑧用排空气法收集气体时,导管伸到集气瓶底部
(6)氧气的验满:
用带火星的木条放在集气瓶口
检验:
用带火星的木条伸入集气瓶内
7、催化剂(触媒):
在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
(一变两不变)
催化剂在化学反应中所起的作用叫催化作用。
8、常见气体的用途:
①氧气:
供给呼吸(如潜水、医疗急救)
支持燃烧(如燃料燃烧、炼钢、气焊)
②氮气:
惰性保护气(化性不活泼)、重要原料(硝酸、化肥)、液氮冷冻
③稀有气体(He、Ne、Ar、Kr、Xe等的总称):
保护气、电光源(通电发不同颜色的光)、激光技术
9、常见气体的检验方法
①氧气:
带火星的木条如右图所示
②二氧化碳:
澄清的石灰水
③氢气:
将气体点燃,用干冷的烧杯罩在火焰上方;
9、氧化反应:
物质与氧(氧元素)发生的反应。
剧烈氧化:
燃烧
缓慢氧化:
铁生锈、人的呼吸、事物腐烂、酒的酿造
共同点:
①都是氧化反应②都放热
第三单元《自然界的水》知识点
一、水
1、水的组成:
(1)电解水的实验如如
A.装置―――水电解器
B.电源种类---直流电
通电
C.加入硫酸或氢氧化钠的目的----------增强水的导电性
D.化学反应:
2H2O===2H2↑+O2↑
产生位置负极正极
体积比2:
1
质量比1:
8
F.检验:
O2---出气口置一根带火星的木条----木条复燃
H2---出气口置一根燃着的木条------气体燃烧,产生淡蓝色的火焰
(2)结论:
水是由氢、氧元素组成的。
一个水分子是由2个氢原子和1个氧原子构成的。
化学变化中,分子可分而原子不可分。
例:
根据水的化学式H2O,你能读到的信息
化学式的含义例:
H2O
①表示一种物质(宏观)水这种物质
②表示这种物质的组成(宏观)水是由氢元素和氧元素组成的
③表示这种物质的一个分子(微观)一个水分子
④表示这种物质的一个分子的构成(微观)一个水分子是由两个氢原子和一个氧原子构成的
通电
2、水的化学性质
(1)通电分解2H2O===2H2↑+O2↑
(2)水可遇碱性氧化物反应生成碱(可溶性碱),例如:
H2O+CaO==Ca(OH)2
(3)水可遇酸性氧化物反应生成酸,例如:
H2O+CO2==H2CO3
3、水的污染:
(1)水资源
A.地球表面71%被水覆盖,但供人类利用的淡水小于1%
B.海洋是地球上最大的储水库。
海水中含有80多种元素。
海水中含量最多的物质是H2O,最多的金属元素是Na,最多的元素是O。
C.我国水资源的状况分布不均,人均量少。
(2)水污染
A、水污染物:
工业“三废”(废渣、废液、废气);农药、化肥的不合理施用
生活污水的任意排放
B、防止水污染:
工业三废要经处理达标排放、提倡零排放;生活污水要集中处理达标排放、提倡零排放;合理施用农药、化肥,提倡使用农家肥;加强水质监测。
(3)爱护水资源:
节约用水,防止水体污染
4、水的净化
(1)水的净化效果由低到高的是沉淀、过滤、吸附、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。
(2)硬水与软水A.定义硬水是含有较多可溶性钙、镁化合物的水;
软水是不含或含较少可溶性钙、镁化合物的水。
B.鉴别方法:
用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水
C.硬水软化的方法:
蒸馏、煮沸
D.长期使用硬水的坏处:
浪费肥皂,洗不干净衣服;锅炉容易结成水垢,不仅浪费燃料,还易使管道变形甚至引起锅炉爆炸。
5、其他
(1)水是最常见的一种溶剂,是相对分子质量最小的氧化物。
(2)*水的检验:
用无水硫酸铜,若由白色变为蓝色,说明有水存在;CuSO4+5H2O=CuSO4·5H2O
*水的吸收:
常用浓硫酸、生石灰。
二、氢气 H2
1、物理性质:
密度最小的气体(向下排空气法);难溶于水(排水法)
2、化学性质:
点燃
可燃性(用途:
高能燃料;氢氧焰焊接,切割金属)
2H2+O2====2H2O点燃前,要验纯(方法?
)
现象:
发出淡蓝色火焰,放出热量,有水珠产生
3、氢气的实验室制法
原理:
Zn+H2SO4=ZnSO4+H2↑Zn+2HCl=ZnCl2+H2↑
不可用浓盐酸的原因浓盐酸有强挥发性;
4、氢能源 三大优点无污染、放热量高、来源广
第六单元碳和碳的氧化物
一、.单质碳的化学性质:
单质碳的种类众多,物理性质各异,而化学性质却相似!
1、常温下的稳定性强(用途:
书写档案材料)
2、可燃性:
(用途:
作燃料)
完全燃烧(氧气充足),生成CO2:
C+O2点燃CO2
不完全燃烧(氧气不充足),生成CO:
2C+O2点燃2CO
3、还原性:
(应用:
冶炼金属)
C+2CuO高温2Cu+CO2↑(置换反应)
实验现象:
黑色粉末变成红色,有气泡冒出,石灰水变浑浊。
二、一氧化碳
1、物理性质:
无色,无味的气体,密度比空气略小,难溶于水
2、有毒:
吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒。
3、化学性质:
(H2、CO、C具有相似的化学性质:
①可燃性②还原性)
1)可燃性:
2CO+O2点燃2CO2(可燃性气体点燃前一定要检验纯度)(用途:
作燃料)
H2和O2的燃烧火焰是:
发出淡蓝色的火焰。
CO和O2的燃烧火焰是:
发出蓝色的火焰。
*CH4和O2的燃烧火焰是:
发出明亮的蓝色火焰。
*鉴别:
H2、CO、CH4可燃性的气体:
看燃烧产物(不可根据火焰颜色)
(水煤气:
H2与CO的混合气体C+H2O高温H2+CO)
2)还原性:
CO+CuO△Cu+CO2(非置换反应)应用:
冶炼金属
实验现象:
黑色逐渐变成红色,有气泡冒出,石灰水变浑浊。
Fe2O3+3CO高温2Fe+3CO2
实验现象:
红棕色粉末逐渐变成黑色,有气泡冒出,石灰水变浑浊。
装置注意:
尾气点燃处理。
防止一氧化碳有毒,污染空气。
除杂:
CO[CO2]通入石灰水*或氢氧化钠溶液:
CO2+2NaOH==Na2CO3+H2O
CO2[CO]通过灼热的氧化铜CO+CuO△Cu+CO2
CaO[CaCO3]只能煅烧(不可加盐酸)CaCO3高温CaO+CO2↑
检验CaO是否含CaCO3加盐酸:
CaCO3+2HCl==CaCl2+H2O+CO2↑
CO32-的检验:
先加盐酸,然后将产生的气体通入澄清石灰水。
三、二氧化碳的性质
经典实验装置实验现象及结论
1、物理性质:
无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体----干冰
2、化学性质:
1)一般情况下不能燃烧,也不支持燃烧,不能供给呼吸
2)与水反应生成碳酸:
CO2+H2O==H2CO3生成的碳酸能使紫色的石蕊试液变红
H2CO3==H2O+CO2↑碳酸不稳定,易分解
3)与石灰水反应:
CO2+Ca(OH)2==CaCO3↓+H2O本反应可用于检验二氧化碳!
4)与灼热的碳反应:
C+CO2高温2CO(吸热反应,CO2是氧化剂,C是还原剂)
3、用途:
灭火(灭火器原理:
Na2CO3+2HCl==2NaCl+H2O+CO2↑)
既利用其物理性质,又利用其化学性质
干冰用于人工降雨、制冷剂、温室肥料、光合作用、气体肥料、制碳酸饮料
4、二氧化碳多对环境的影响:
过多排放引起温室效应。
五、二氧化碳的制法
1、实验室制取气体的思路:
(原理、装置、检验)
(1)发生装置:
由反应物状态及反应条件决定:
反应物是固体,需加热,制气体时则用高锰酸钾制O2(固固加热型)的发生装置。
如图A
反应物是固体与液体,不需要加热,制气体时则用固液不加热型的发生装置。
如图B
(2)收集方法:
气体的密度及溶解性决定:
难溶于水用排水法收集如图ECO只能用排水法
密度比空气大用向上排空气法如图CCO2只能用向上排空气法
密度比空气小用向下排空气法如图D
2、二氧化碳的实验室制法
1)原理:
用石灰石或大理石和稀盐酸反应:
CaCO3+2HCl==CaCl2+H2O+CO2↑
2)选用和双氧水制氧气相同的发生装置如图B(长颈漏斗伸到液面之下避免气体从漏斗跑出)
3)气体收集方法:
只能向上排空气法如图C
4)检验方法:
将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳。
验满方法:
用点燃的木条,放在集气瓶口,木条熄灭。
证明已集满二氧化碳气体。
5)步骤:
连—查—装—收—验(满)(与制氧气步骤对比记忆)
3、二氧化碳的工业制法:
煅烧石灰石:
CaCO3高温CaO+CO2↑
CaO+H2O=Ca(OH)2剧烈放热
生石灰熟石灰
第7单元燃烧及其利用
一、燃烧和灭火
1、燃烧的条件:
(缺一不可)
(1)可燃物
(2)氧气(或空气)
(3)温度达到着火点
2、灭火的原理:
(只要消除燃烧条件的任意一个即可)
(1)消除可燃物
(2)隔绝氧气(或空气)(3)降温到着火点以下
3、影响燃烧现象的因素:
可燃物的性质、氧气的浓度、与氧气的接触面积
使燃料充分燃烧的两个条件:
(1)要有足够多的空气
(2)燃料与空气有足够大的接触面积。
4、爆炸:
可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
二、燃料和能量
1、三大化石燃料:
煤、石油、天然气(都是混合物、均为不可再生能源)
(1)煤:
“工业的粮食”(主要含碳元素);
煤燃烧排放的污染物:
SO2、NO2(引起酸雨)、CO、烟尘等
(2)石油:
“工业的血液”(主要含碳、氢元素);
汽车尾气中污染物:
CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘
(3)天然气是气体矿物燃料(主要成分:
甲烷),是较清洁的能源。
2、两种绿色能源:
沼气、乙醇
(1)沼气的主要成分:
甲烷。
柴草、秸秆、人畜粪便密封发酵产生甲烷。
甲烷的化学式:
CH4(最简单的有机物,相对分子质量最小的有机物)
物理性质:
无色,无味的气体,密度比空气小,极难溶于水。
化学性质:
可燃性CH4+2O2点燃CO2+2H2O(发出蓝色火焰)
(2)乙醇(俗称:
酒精,化学式:
C2H5OH)乙醇由各种粮食发酵而成。
化学性质:
可燃性C2H5OH+3O2点燃2CO2+3H2O
工业酒精中常含有有毒的甲醇CH3OH,故不能用工业酒精配制酒!
乙醇汽油:
优点
(1)节约石油资源
(2)减少汽车尾气
(3)促进农业发展(4)乙醇可以再生
3、化学反应中的能量变化
(1)放热反应:
如所有的燃烧
(2)吸热反应:
如一般条件为“高温”的反应
4、新能源:
氢能源、太阳能、核能、风能、地热能、潮汐能
氢气是最理想的燃料:
(1)优点:
资源丰富,放热量多,无污染。
(3)需解决问题:
如何大量廉价的制取氢气?
如何安全地运输、贮存氢气?
五种气体的比较
化学式
H2
CH4
CO
O2
CO2
相对分子质量
2
16
28
32
44
密度(比空气)
小
小
略小
略大
大
色态
无气
无气
无气
无气
无气
溶解性
难溶于水
难溶于水
难溶于水
不易溶于水
能溶于水
与燃烧关系
可燃
可燃
可燃
助燃
灭火
第八单元知识点
一、金属材料
1、金属材料
纯金属(90多种)
合金(几千种)
2、金属的物理性质:
(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
3、金属之最:
(1)铝:
地壳中含量最多的金属元素
(2)钙:
人体中含量最多的金属元素
(3)铁:
目前世界年产量最多的金属(铁>铝>铜)
(4)银:
导电、导热性最好的金属(银>铜>金>铝)
(5)铬:
硬度最高的金属(6)钨:
熔点最高的金属
(7)汞:
熔点最低的金属(8)锇:
密度最大的金属
(9)锂:
密度最小的金属
4、合金:
由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。
合金是混合物。
★:
一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好
合金
铁的合金
铜合金
焊锡
钛和钛合金
形状记忆金属
生铁
钢
黄铜
青铜:
成分
含碳量
2%~4.3%
含碳量
0.03%~2%
铜锌
合金
铜锡
合金
铅锡
合金
钛镍合金
备注
不锈钢:
含铬、镍的钢
具有抗腐蚀性能
紫铜为纯铜
熔点低
注:
钛和钛合金:
被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。
(1)熔点高、密度小
优点
(2)可塑性好、易于加工、机械性能好
(3)抗腐蚀性能好
二、金属的化学性质
1、大多数金属可与氧气的反应
2、金属+酸→盐+H2↑(条件:
氢前金可反应)
3、金属+盐→另一金属+另一盐(条件:
“前换后,盐可溶”)
Fe+CuSO4==Cu+FeSO4(“湿法冶金”原理)
三、常见金属活动性顺序:
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(除K、Ca、Na、)
四、金属资源的保护和利用
1、铁的冶炼
(1)原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO+Fe2O3高温2Fe+3CO2
(2)原料:
铁矿石、焦炭、石灰石、空气
常见的铁矿石有磁铁矿(主要成分是Fe3O4)、赤铁矿(主要成分是Fe2O3)
2、铁的锈蚀
(1)铁生锈的条件是:
铁与O2、水接触(铁锈的主要成分:
Fe2O3)
(铜生铜绿的条件:
铜与O2、水、CO2接触。
铜绿的化学式:
Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:
如涂油、刷漆、电镀、烤蓝等
③制成不锈钢
铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀。
因而铁锈应及时除去。
可用稀盐酸稀硫酸除铁锈.
而铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
(4Al+3O2====2Al2O3)
3、金属资源的保护和利用:
保护金属资源的途径:
①防止金属腐蚀
②回收利用废旧金属
③合理开采矿物
④寻找金属的代用品
意义:
节约金属资源,减少环境污染
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 九年级 化学元素 化合物 知识点 复习
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 转基因粮食的危害资料摘编Word下载.docx
转基因粮食的危害资料摘编Word下载.docx
