 中药法规必考知识点.docx
中药法规必考知识点.docx
- 文档编号:3267976
- 上传时间:2022-11-21
- 格式:DOCX
- 页数:41
- 大小:39.49KB
中药法规必考知识点.docx
《中药法规必考知识点.docx》由会员分享,可在线阅读,更多相关《中药法规必考知识点.docx(41页珍藏版)》请在冰豆网上搜索。
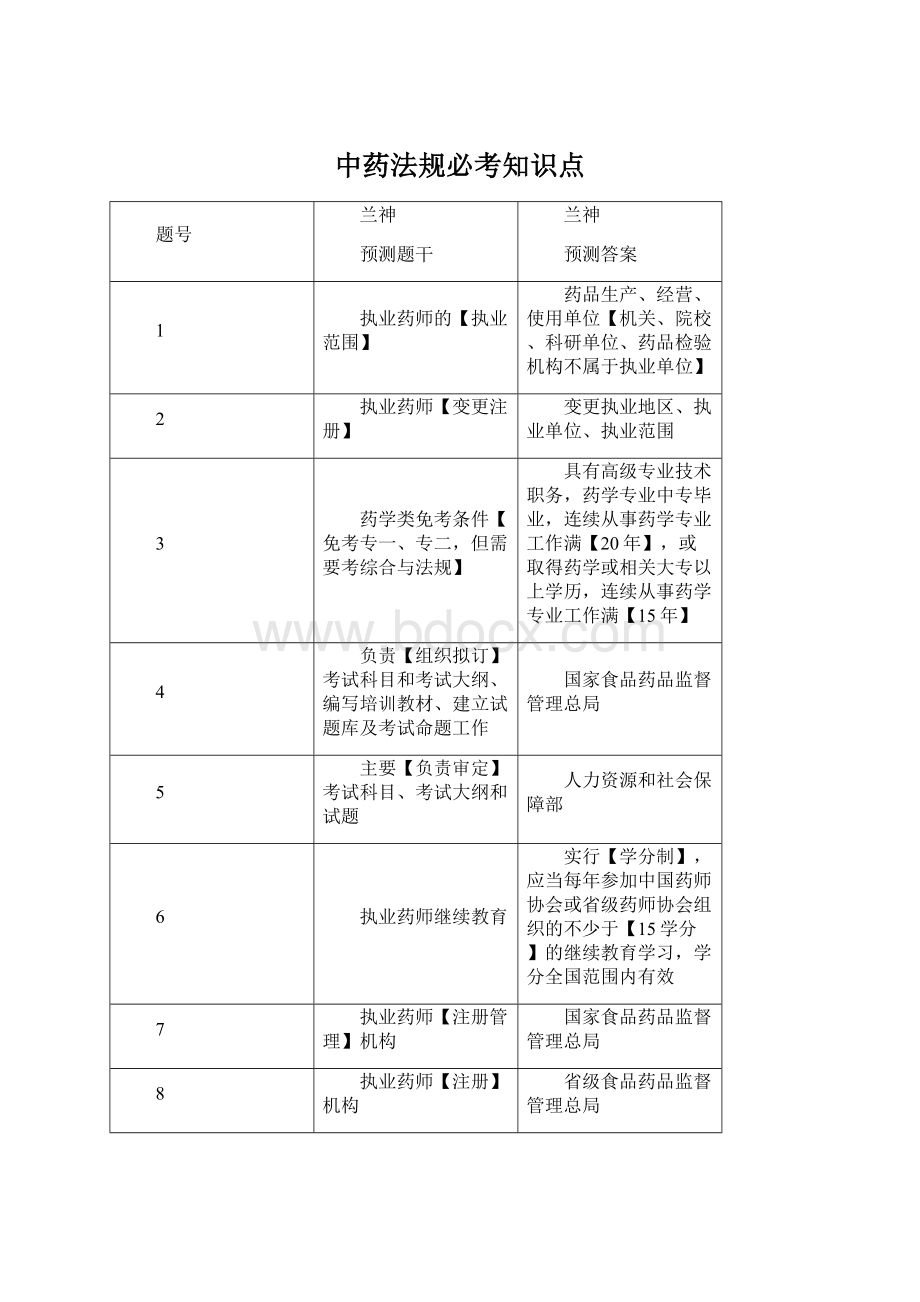
中药法规必考知识点
题号
兰神
预测题干
兰神
预测答案
1
执业药师的【执业范围】
药品生产、经营、使用单位【机关、院校、科研单位、药品检验机构不属于执业单位】
2
执业药师【变更注册】
变更执业地区、执业单位、执业范围
3
药学类免考条件【免考专一、专二,但需要考综合与法规】
具有高级专业技术职务,药学专业中专毕业,连续从事药学专业工作满【20年】,或取得药学或相关大专以上学历,连续从事药学专业工作满【15年】
4
负责【组织拟订】考试科目和考试大纲、编写培训教材、建立试题库及考试命题工作
国家食品药品监督管理总局
5
主要【负责审定】考试科目、考试大纲和试题
人力资源和社会保障部
6
执业药师继续教育
实行【学分制】,应当每年参加中国药师协会或省级药师协会组织的不少于【15学分】的继续教育学习,学分全国范围内有效
7
执业药师【注册管理】机构
国家食品药品监督管理总局
8
执业药师【注册】机构
省级食品药品监督管理总局
9
执业药师注册【有效期】
3年,在有效期满前3个月到原执业药师注册机构申请办理再次注册手续
10
药品的【定义】
指人用药品,不包含兽药和农药
11
药品的【质量特性】
安全性、有效性、稳定性、均一性
12
药品的【特殊性】
专属性、两重性、质量的重要性、时限性
13
药品的【安全风险】
复杂性、不可预见性、不可避免性
14
《十三五国家药品安全计划》的几个发展目标
分期分批对已上市的药品进行质量和疗效一致性评价,药品定期安全性更新报告评价率达到100%,执业药师服务水平显著提高,每万人口执业药师数【超4人】,所有零售药店主要管理者具有执业药师资格
15
深化医药卫生体制改革基本原则
坚持【以人为本】、坚持【立足国情】、坚【持公平与效率统一】、坚持【统筹兼顾】
16
基本医疗卫生制度【四大体系】
公共卫生服务、医疗服务、医疗保障、药品供应保障体系
17
两票制【鼓励医院与药品生产企业直接结算药品货款、药品生产企业与配送企业直接结算配送费用】
【产企业到流通企业】一次发票,【通企业到医疗机构】一次发票
18
【生产环节】的重大改革政策
加快推进已上市仿制药质量和疗效一致性评价、推进上市许可持有人制度试点
19
【流通环节】的重大改革政策
健全城乡药品流通网络,推行药品购销“两票制”,建立药品价格可追溯机制,发挥“互联网+药品流通”
20
【使用环节】的重大改革政策
进一步破除以药补医机制,强化医保规范行为和控制费用的作用,发挥药师作用
21
改革完善短缺药品供应保障机制
分级应对、分类管理、会商联动、保障供应
22
国家基本药物【遴选原则】
防治必需、安全有效、价格合理、使用方便、中西药并重、基本保障、临床首选和基层能配备
23
负责协调解决制定和实施国家基本药物制度过程各个环节的相关政策问题
国家基本药物工作委员会
24
除【急救、抢救用药】外
独家生产品种纳入国家基本药物目录应当经过【单独论证】
25
不能纳入国家基本药物目录药物
滋补、含濒危野生药材、非临床治疗首选
26
国家基本药物目录调整周期
原则上【每3年】调整一次
27
医疗服务体系
非盈利性医疗机构为主体、营利性医疗机构为补充,公立医疗机构为主导、非公立医疗机构共同发展的原则
28
国家基本药物制度【补偿模式】
收支两条线、多种渠道、以奖代补、政府全额补贴
29
基本药物全部纳入基本医疗保障药物报销目录
实行【100%报销】
30
全部配备和使用基本药物并实现零差率销售
基层医疗卫生机构
31
国务院食品药品监督管理部门
【评价性】抽验
32
省级食品药品监督管理部门
【监督性】抽验
33
组建【国家市场监督管理总局】,为国务院直属机构
考虑药品监管的特殊性,单独组建国家药品监督管理局,由国家市场监督管理总局管理
34
组建【国家卫生健康委员会】,为国务院组成部门
国家中医药管理局由国家卫生健康委员会管理,不再保留国家卫生和计划生育委员会,不再设立国务院深化医药卫生体制改革领导小组办公室
35
组建【国家医疗保障局】,为国务院直属机构
将人力资源和社会保障部的城镇职工和城镇居民基本医疗保险、生育保险职责,卫计委新型农村合作医疗职责、发改委价格管理职责、民政部医疗救助职责整合
36
制定中医药长期规划,负责组织制定国家基本药物政策和国家基本药物制度,组织制定基本药物目录
【卫生计生部门】职责
37
【中药资源普查】,促进【中药】资源保护、开发
【中医药管理部门】职责
38
药品【价格】行为的监督管理,负责监测和管理药品宏观经济
【发展和改革宏观调控部门】职责
39
统筹拟订【医疗保险】政策等
人力资源和社会保障部门
40
药品【广告监督、处罚发布虚假违法】药品广告的行为
【工商行政管理】部门
41
拟订和实施生物医药产业规划、政策和标准,承担中药材生产扶持项目管理和国家药品储备管理工作
工业和信息化管理部门
42
组织指导食品药品犯罪案件侦查
公安部门
43
研究制定药品【流通】行业发展规划等
商务部
44
承担仿制药质量和疗效一致性评价相关工作、承担食品、药品、化妆品、医疗器械等检测工作
中国食品药品检定研究所
45
国家药典委员会职责
组织编制与修订《中国药典》、药品标准制定
46
CFDA药品【审评中心】职责
技术审评、药品注册
47
CFDA食品药品【审核查验】中心
药品现场核查
48
CFDA药品【评价中心】
不良反应监测
49
国家中药品种保护审评委员会
中药品种、保健食品、化妆品审评
50
加挂【国家药品不良反应监测中心】牌子
药品评价中心
51
实施【行政许可】的四个原则
法定原则,公平、公开、公正原则
便民与效率原则,信赖保护原则
52
根本大法,具有【最高效力】
宪法
53
由【国务院制定】的规范性文件
行政法规
54
由【全国人大及其常委会制定】的规范性文件
法律
55
《中华人民共和国药品管理法》
属于【法律】
56
《药品管理法实施条例》
属于【行政法规】
57
《吉林省药品监督管理条例》
属于【地方性法规】
58
《药品注册管理办法》
属于【部门规章】
59
法律效力的层次
上位法的效力高于下位法、在同一位阶的法之间,特别规定优于一般规定,新的规定优于旧的规定
60
新一批取消的行政许可事项
取消了省级食品药品监督管理部门对药用辅料(不含新药用辅料和进口药用辅料)注册审批、取消了直接接触药品包装材料和容器审批、取消医疗器械临床试验机构资格认定、取消互联网药品交易服务企业(第三方)审批
61
【听证程序】的
1.责令停产停业2.吊销许可证或执照
3.较大数额罚款
62
【简易程序】的
【数额较小罚款】或者【警告】
63
行政复议申请
【60日】内向行政复议机关提出
64
行政诉讼申请
【6个月】内直接向人民法院提起
65
对行政复议决定不服的,在收到复议决定书之日起
【15日】内向人民法院起诉
66
不属于行政复议范围的事项
对【行政机关】做出的行政处分、对民事纠纷的调节
67
药品【非临床】研究质量管理规范
GLP
68
药品【临床试验】质量管理规范
GCP
69
药品【生产质量】管理规范
GMP
70
药品【经营质量】管理规范
GSP
71
【中药材】生产质量管理规范
GAP
72
初步的临床药理学及人体安全性评价阶段【I期】
观察人体的耐受程度和药动学
73
治疗作用的初步评价阶段【II期】
【初步观察】对患者的治疗作用和安全性
74
治疗作用的确证阶段【III期】
【进一步验证】治疗作用和安全性
75
上市后药品临床再评价阶段【IV期】
考察药品【广泛使用】时的疗效与不良反应
76
临床I期样本数
健康志愿者【20-30例】
77
临床II期样本数
目标适应症患者【不少于100例】
78
临床III期样本数
目标适应症患者【不少于300例】
79
临床IV期样本数
常见病≥2000例
80
临床试验机构资格认定实行【备案管理】
临床试验主要研究者应具有高级职称,参加过3个以上临床试验
81
药品【注册申请人】
境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构,境外申请人应当是境外合法制药厂商
82
仿与原研药品质量和疗效一致药品
仿制药
83
未在中国境内外上市销售的药品
新药
84
改变、增加或取消原批准事项
按照补充申请注册
85
改变剂型、改给药途径、增加适应症、防生物制品
按照【新药申请注册】
86
国外药品进口颁发
《进口药品注册证》
87
港澳台药品进口大陆
《医药产品注册证》
88
药品上市许可颁发
《药品注册证》
89
【1类】化学药品
境内外均未上市的创新药
90
批准生产的新药设立的监测期不超过
5年
91
《进口药品注册证》,《医药产品注册证》有效期
5年
92
药品上市许可持有人制度试点
允许【药品研发机构和科研人员】取得药品批准文号
93
药品【批准文号】格式
国药准字H(Z/S/J)+4位年号+4位顺序号,H代表化学药品,Z代表中药,S代表生物制品,J代表进口药品分包装
94
《进口药品注册证》证号格式
H(Z/S)+4位年号+4位顺序号
95
《医药产品注册证》证号格式
H(Z/S)C+4位年号+4位顺序号
对于境内分包装用大包装规格的注册证,在原注册证号前加个字母B
96
【新药证书号】格式
国药证字H(Z/S)+4位年号+4位顺序号
97
中国上市药品目录相关术语
参比制剂:
在我国批准上市,用于仿制药注册申请的参照药品
标准制剂:
在我国批准上市,用于人体等效性研究的对照药品
治疗等效药品:
药学等效药品如果同时还具有生物等效,即具有治疗等效
98
药品生产许可证的许可事项变更
企业负责人、生产范围、生产地址
99
企业关键人员至少包括
企业负责人、生产管理负责人、质量管理负责人和质量受权人
100
质量管理负责人和生产管理负责人
不得相互兼任
101
质量管理负责人和质量授权人
可以兼任
102
必须采用专用和独立的厂房、生产设施和设备
青霉素或生物制品
103
使用专用设施和设备,并与其他药品生产区严格分开
β内酰胺类药品和性激素类避孕药品
104
负责所有药品GMP认证工作
省级药品监督管理部门
105
需重新申请药品GMP认证的
新开办药品生产企业或药品生产企业新增生产范围、新建车间的
106
可能引起【严重危害】的药品
【一级】召回
107
可能引起【暂时的或可逆的】健康危害
【二级】召回
108
一般不会引起健康危害,但由于其他原因需要收回
【三级】召回
109
【不得委托生产】药品
中药注射剂和原料药、生物制品、麻精、易制毒、毒性药品、多组分生化药品、中药提取物
110
药品召回的【责任主体】
药品生产企业【进口药品的境外制药厂商与境内药品生产企业】
111
通知停止销售和使用药品,报告药监部门【一级召回】
24小时之内
112
通知停止销售和使用药品,报告药监部门【二级召回】
48小时之内
113
通知停止销售和使用药品,报告药监部门【三级召回】
72小时之内
114
调查评估报告,提交召回计划
1日内【一级召回】
115
调查评估报告,提交召回计划
3日内【二级召回】
116
调查评估报告,提交召回计划
7日内【三级召回】
117
药品经营企业、使用单位发现其经营、使用的药品存在安全隐患的
应当立即停止销售或者使用该药品,通知药品生产企业或供货商,并向药品监督管理部门报告
118
药品经营许可证【许可事项】变更
经营方式、经营范围、注册地址、企业法定代表人或负责人、质量负责人
119
企业分立、合并、改变经营方式、跨原辖区迁移
需【重新办理】《药品经营许可证》
120
开办药品【批发企业】需经过
企业所在地省、自治区、直辖市人民政府药品监督管理部门批准
121
开办药品【零售企业】需经过
企业所在地县级以上地方药品监督管理部门批准
122
批发【企业负责人】资质要求
专科以上学历或中级以上专业技术职称
123
批发【企业质量负责人】资质要求
本科以上+执业药师资格+3年以上药品经营质量管理工作经历
124
批发企业质量管理部门负责人资质要求
执业药师资格+3年以上药品经营质量管理工作经历
125
【验收、养护、采购】资质要求
药学或医学、生化、化学等相关专业中专以上学历
126
质量管理工作人员资质要求
药学中专或医学、生化、化学等相关专业大学专科以上学历或者具有药学初级以上技术职称
127
应当由高层管理人员担任、在企业内部对药品质量管理具有裁决权
企业质量负责人
128
药品生产、经营企业采购药品时的资料和销售凭证
至少保存【5年】
129
药品批发、零售企业的书面记录和相应凭证
至少保存【5年】
130
毒性药品生产记录
保存【5年】
131
生产、批发企业麻醉药品、精神药品的【专用账册】
自药品有效期满之日起不少于5年
132
疫苗的各种证明文件及购销记录
保存至超过疫苗有效期2年
133
医疗机构麻醉药品和精神药品
【专册】
保存期限为3年
134
药品储存按质量状态实行色标管理
合格药品为绿色、不合格药品为红色、待确定药品为黄色
135
【同一批号】的药品
应当【至少检查一个最小包装】
136
生产企业有特殊质量控制要求或打开包装影响质量的
可不打开最小包装
137
破损、污染、渗液等包装异常的
开箱检查至最小包装
138
外包装及封签完整的原料药、生物制品
可不开箱检查
139
药品储存的【相对湿度】
35%-75%
140
药品的储存要求
药品与非药品、外用药与其他药品【分开存放】,中药材与中药饮片【分库存放】,拆除外包装的零货药品应当【集中存放】
141
药品堆码距离
药品垛间距【不小于5cm】、药品与地面间距【不小于10cm】、药品与库房内墙、顶等设施间距【不小于30cm】
142
零售【企业负责人】资质要求
执业药师资格
143
零售企业质量管理、验收、采购人员资质要求
药学或医学、生物、化学等相关专业学历或者具有药学专业技术职称
144
【中药饮片调剂人员】资质要求
中药学中专以上学历或具备中药调剂员资格
145
【质量管理岗位】和【处方审核岗位】的职责
不得由其他岗位人员代为履行
146
不得采用【开架自选】的方式陈列和销售
处方药
147
第二类精神药品、罂粟壳、毒性中药品种
【不得陈列】
148
药店药品陈列要求
处方药、非处方药【分区陈列】,并有处方药、非处方药专用标识,外用药与其他药品【分开摆放】,拆零销售的药品【集中存放】在拆零专柜或者专区
149
药品拆零销售管理
人员专门培训、提供药品说明书原件或者复印件、拆零销售期间保留原包装和说明书
150
药品销售管理要求
对有配伍禁忌或者超剂量的处方,应当拒绝调配,但经处方医师更正或者重新签字确认的,可以调配
151
城乡集市贸易市场不得出售
【中药材以外】的药品
152
不得搭售、买药品赠药品、买商品赠药品等方式
向公众赠送【处方药或者甲类非处方药】
153
不得以展示会、博览会、交易会、订货会等方式
现货销售药品
154
不得采用邮售、互联网交易等方式直接
向公众销售【处方药】
155
对企业和医疗机构查实的违法违规行为
记录药品采购不良记录、企事业单位信用记录和个人信用记录并按规定公开,公立医院【2年内】不得购进相关企业药品
156
建立医药代表登记【备案制度】,备案信息及时公开
医药代表只能从事学术推广、技术咨询等活动,不得承担药品销售任务,其失信行为记入个人信用记录
157
药品生产企业、药品经营企业和医疗结构之间的交易服务
【第一类】互联网交易服务
158
药品生产、批发企业与其他企业之间的交易服务
【第二类】互联网交易服务
159
直接向个人消费者提供互联网交易服务
【第三类】互联网交易服务
160
互联网药品信息服务的网站【不得发布】的产品信息
麻精毒放、戒毒药品和医疗机构制剂
161
国务院三类互联网药品交易服务企业审批事项【都取消了】
将平台网站纳入监督检查范围,落实平台主体责任、建立黑名单制度、加大监督力度
162
向个人消费者提供互联网药品交易服务的企业只能在网上销售本企业经营的非处方药
不得向其他企业或者医疗机构销售药品
163
二级以上医院应当设立药事管理与药物治疗委员会,其他医疗机构应当成立药事管理与药物治疗学组
药师管理与药物治疗学委员会【既不是行政管理部门,也不属于常设机构】
164
药学部门药学专业技术人员配备比例
不得少于本机构卫生专业技术人员的【8%】
165
二级、三级综合医院药剂科人员具有高等医药院校临床药学专业或者药学专业全日制本科毕业以上学历的不低于
20%与30%
166
二级、三级综合医院药学专业技术人员中具有副高级以上不低于
6%与13%
167
个人设置的门诊部、诊所不得配备
【常用药品和急救药品以外】的其他药品
168
医疗机构药品购进记录、验收记录
超过【有效期1年,但不得少于3年】
169
医疗机构首次购进药品的有关证明文件的复印件
保存【不少于5年】
170
经药事管理与药物治疗学委员会(组)审核同意
核医学科可以调剂本专业所需放射性药品
171
临床用量大、采购金额高、多家企业生产的基本药物
【招标】采购
172
部分专利药品、独家生产药品
【谈判】采购
173
对临床必需、用量小、市场供应短缺的药品
国家【定点生产】
174
妇儿专科非专利药品、急救药品、基础输液等
【直接挂网】采购药品
175
药品发放应当遵循
【近效期先出】的原则
176
处方颜色
麻醉、精神一类【淡红色】
普通处方、精神二类【白色】
急诊处方【淡黄色】、儿科处方【淡绿色】
177
普通处方、急诊处方、儿科处方
保存【1年】
178
精神二类处方、毒性药品、蛋白同化制剂处方
保存【2年】
179
麻醉、精神一类处方
保存【3年】
180
麻醉、精神一类药品【注射剂】
一般患者【1次用量】
181
麻醉、精神一类药品【普通剂型】
一般患者【不得超过3天】
182
麻醉、精神一类药品【缓控释制剂】
一般患者【不得超过7天】
183
麻醉、精神一类药品【注射剂】
癌痛患者【不得超过3天】
184
麻醉、精神一类药品【普通剂型】
癌痛患者【不得超过7天】
185
麻醉、精神一类药品【缓控释制剂】
癌痛患者【不得超过15天】
186
【哌醋甲酯】治疗儿童多动症时
处方限量不超过15日
187
麻醉、一类精神药品处方限量
【住院患者】1日常用量
188
盐酸【二氢埃托啡】处方限量
1次常用量,仅限于二级以上医院使用
189
盐酸【哌替啶】处方限量
1次常用量,仅限于医疗机构内使用
190
四查十对
查处方:
对【科别、姓名、年龄】
查药品:
对【药品、剂型、规格、数量】
查配伍禁忌:
对【药品性状、用法用量】
查用药合理性:
对【临床诊断】
191
门急诊处方的抽样率不应少于总处方量的【1‰】
每月点评处方绝对数不应少于【100张】
192
除麻醉药品、精神药品、医疗用毒性药品和儿童处方
医疗机构不得限制门诊就诊人员持处方到药品零售企业购药
193
不得作为医疗机构制剂申报的品种
医疗用毒性药品、除变态反应原外的生物制品、中药注射剂、中药与化学药组成的复方制剂、已有供应药品、放射性药品、麻醉药品和精神药品【部分是可配制的】
194
医疗机构制剂【批准文号】有效期
3年
195
医疗机构获得《医疗机构制剂许可证》,如果要进行某种制剂的配制
还需取得【相应制剂的批准文号】
196
医疗机构制剂仅限于【临床需要而市场上没有供应】的品种
不得在市场上销售或者变相销售,不得发布医疗机构制剂广告
197
医疗机构制剂许可证【许可事项】变更
制剂室负责人、配制范围、配制地址
198
【委托配制】中药制剂
应当向委托方所在地省、自治区、直辖市人民政府药品监督管理部门【备案】
199
医疗机构配制中药制剂品种,应当依法取得【制剂批准文号】
但是仅应用传统工艺配制的中药制剂品种,向医疗机构所在地省、自治区、直辖市人民政府药品监督管理部门备案后即可配制,不需要取得制剂批准文号
200
医疗机构制剂批准文号格式
X药制字H(Z)+4位年号+4位流水号
201
发生【灾情、疫情】等特殊情况
医疗机构制剂在省内调剂由省局批准,省间调剂由国局批准
202
三级医院临床药师
不得少于5名
203
【非限制】使用级
抗菌药物安全有效、耐药性小、价格低
204
【限制】使用级
抗菌药物耐药性较大、价格相对较高
205
【特殊】使用级
抗菌药物具有严重不良反应、价格昂贵
206
授予特殊使用级抗菌药物处方权
高级专业技术职务任职资格的医师
207
授予限制使用级抗菌药物处方权
中级以上专业技术职务任职资格医师
208
授予非限制使用级抗菌药物处方权
初级专业技术职务任职资格的医师,在乡、民族乡、镇、村的医疗机构独立从事一般执业活动的执业助理医师以及乡村医生
209
抗菌药物应用【异常情况】
用量异常、半年居前、常超剂量、违规销售、频发不良反应
210
二级以上医院药师经【本机构】培训并考核合格
授予抗菌药物相应的调剂资格
211
特殊使用级抗菌药物
【不得在门诊使用】,临床应用需严格掌握用药指征,经抗菌药物管理工作组指定的专业技术人员会诊同意后使用
212
超过【30%】的抗菌药耐药
及时将预警信息【通报】本机构医务人员
213
超过【40%】的抗菌药耐药
慎重【经验用药】
214
超过【50%】的抗菌药耐药
参照【药敏试验】结果选用
215
超过【75%】的抗菌药耐药
【暂停】针对此目标细菌的临床应用
216
进一步加强抗菌药物临床应用管理遏制细菌耐药的通知
强化碳氢霉烯类抗菌药物以及替加环素等特殊抗菌药物管理,特殊使用级抗菌药物紧急情况下未经会诊同意或确需越处方权限使用的,处方量不得超1日用量
217
非处方药分为甲、乙类
根据药品【安全性】分类
218
【红色】专有标识用于
甲类非处方药
219
【绿色】专有标识用于
【乙类非处方药】和用作【指南性标志】
220
不需要凭执业医师和执业助理医师处方,消费者可以自行判断、购买和使用的药品
非处方药
221
非处方药标签以及说明书或者包装上必须印有警示语或者忠告语
请仔细阅读药品使用说明书并按说明使用或在药师指导下购买和使用
222
处方药的标签与说明书印有
凭医师处方销售、购买和使用
223
使用非处方药专有标识时,药品使用说明书和大包装
可以【单
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 中药 法规 必考 知识点
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
