 19.1 可编程医用电气系统(PEMS)文档自查表(GB9706.1-2020).docx
19.1 可编程医用电气系统(PEMS)文档自查表(GB9706.1-2020).docx
- 文档编号:30870361
- 上传时间:2024-09-12
- 格式:DOCX
- 页数:18
- 大小:56.99KB
19.1 可编程医用电气系统(PEMS)文档自查表(GB9706.1-2020).docx
《19.1 可编程医用电气系统(PEMS)文档自查表(GB9706.1-2020).docx》由会员分享,可在线阅读,更多相关《19.1 可编程医用电气系统(PEMS)文档自查表(GB9706.1-2020).docx(18页珍藏版)》请在冰豆网上搜索。
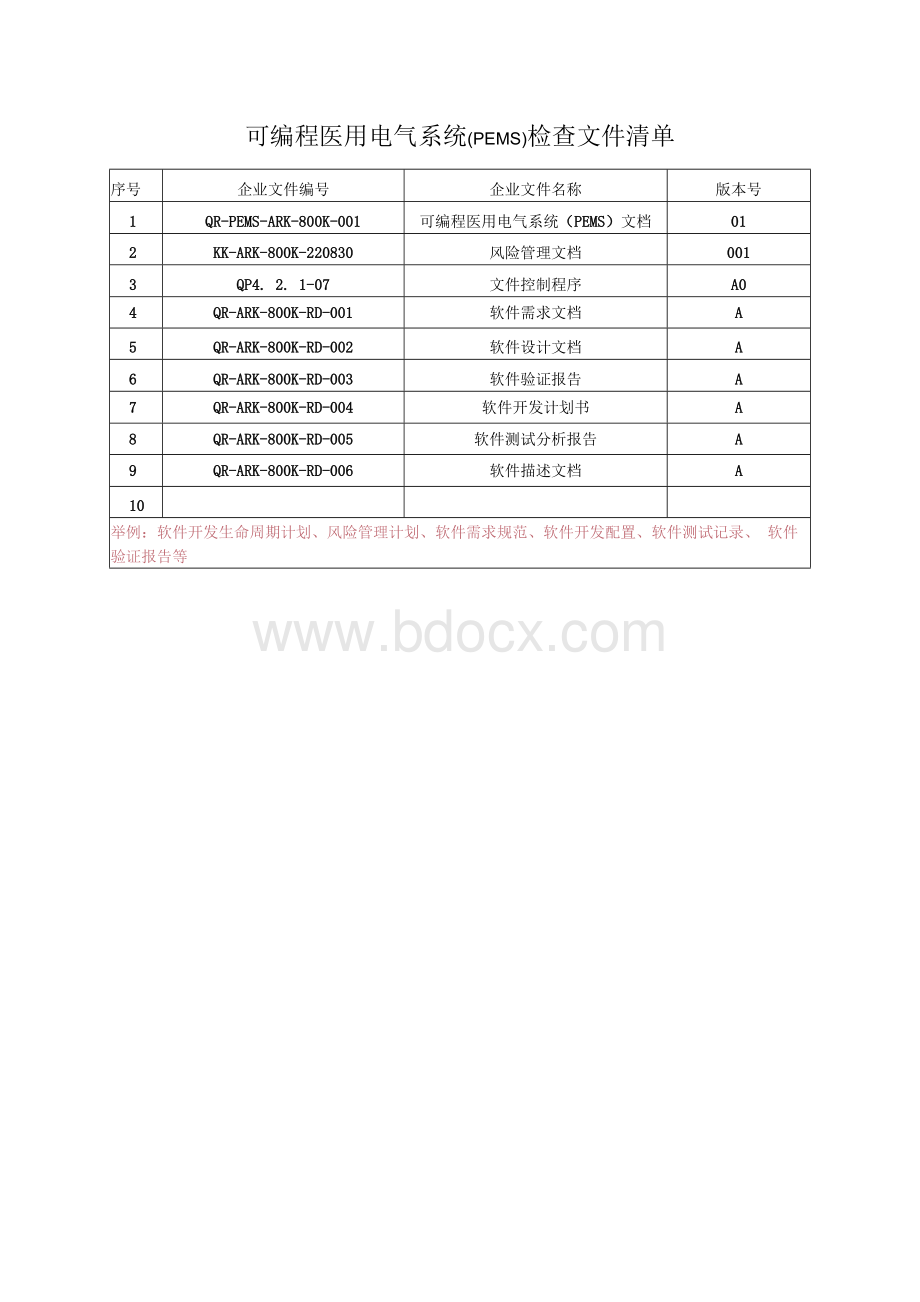
可编程医用电气系统(PEMS)检查文件清单
序号
企业文件编号
企业文件名称
版本号
1
QR-PEMS-ARK-800K-001
可编程医用电气系统(PEMS)文档
01
2
KK-ARK-800K-220830
风险管理文档
001
3
QP4.2.1-07
文件控制程序
A0
4
QR-ARK-800K-RD-001
软件需求文档
A
5
QR-ARK-800K-RD-002
软件设计文档
A
6
QR-ARK-800K-RD-003
软件验证报告
A
7
QR-ARK-800K-RD-004
软件开发计划书
A
8
QR-ARK-800K-RD-005
软件测试分析报告
A
9
QR-ARK-800K-RD-006
软件描述文档
A
10
举例:
软件开发生命周期计划、风险管理计划、软件需求规范、软件开发配置、软件测试记录、软件验证报告等
可编程医用电气系统(PEMS)自查表
检验项目
条款
标准要求
适用时:
文件编号+文件名称+章节
不适用:
注明不适用理由
GB9706.1-2020医用电气设备第1部分:
基本安全和基本性能的通用要求
文档
14.2
第14章要求的文档应按照正式的文档控制程序,进行评审、批准、发布和更改
QP4.2.1-07+文档控制程序+5.0。
风险管理计划
14.3
按4.2.2形成的风险管理计划应包括对PEMS确认计划(见14.11)的引用
KK-ARK-800K-220830+风险管理文档+4.3.1
PEMS开发生命周期
14.4
PEMS开发生命周期应文档化
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+编制说明
PEMS开发生命周期应当包含一组已定义的里程碑
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
在每个里程碑,应确定将要完成的活动和验证这些活动的方法
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
应确定每个活动,包括其输入和输出
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
每个里程碑应识别在此里程碑结束前一定有完成的风险管理活动
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
应通过制定详细的活动、里程碑和进度表计划,来为特定的开发定制PEMS开发生命周期
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
PEMS开发生命周期应包括对文档的要求
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+5.0
问题解决
14.5
适当时,应在PEMS开发生命周期的所有阶段和活动内或相互间建立和维护一个文档化的问题解决体系
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+6.0
风险管理过程
已知和可预见危险的识别
14.6
14.6.1
在编制已知或可预见的危险(源)列表时,制造商应考虑那些与PEMS软件和硬件方面相关的危险(源),包括PEMS接入IT-网络、第三方来源组件和遗留子系统的危险(源)
QR-PEMS-ARK-800K-00
1-01+可编程医用电气系统(PEMS)文档+7.2
风险控制
14.6.2
为实现每个风险控制措施,应选择和确定合适的已确认的工具和程序。
这些工具和程序应适用于确保每个风险控制措施能有效地降低已识别的风险
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+7.3
需求规格说明
14.7
对于PEMS及其各子系统(例如:
PEMS),应有文档化的需求规格说明
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+8.0
QR-ARK-800K-RD-001+验光需求文档+6.0
系统或者子系统的需求规格说明,应包含并区分由其自身实施的任何基本性能和任何风险控制措施
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+7.3
QR-ARK-800K-RD-001+验光需求文档+6.0
体系结构
14.8
对于PEMS及其各子系统,应明确规定符合需求规格说明的体系结构
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+9.0
设计和实现
14.9
适当时,设计应分解为各子系统,每个子系统都有设计和测试规格说明
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+10.3
关于设计环境的描述数据应形成文档
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+10.4
验证
14.10
所有实现基本安全、基本性能或风险控制措施的功能都需要得到验证
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+11.0
QR-ARK-800K-RD-002+RMK-800K验光仪嵌入式软件验证报告+4.2
应制定验证计划以表明这些功能是如何被验证的。
计划应包括:
——在每个里程碑,对各个功能进行验证
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+5.4
——验证策略、活动、技术及执行验证人员的适当独立程度的选择和形成文档
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+5.3
——验证工具的选择和运用
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+5.4
——验证的覆盖准则
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+5.4
验证应根据验证计划执行。
验证活动的结果应形成文档
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+5.4
QR-ARK-800K-RD-002+RMK-800K验光仪嵌入式软件验证报告+4.0
PEMS确认
14.11
PEMS确认计划应当包含基本安全和基本性能的确认
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+12.0
PEMS确认采用的方法应形成文档
QR-ARK-800K-RD-005+RMK-800K验光仪嵌入式软件验证报告+7.0
应根据PEMS确认计划实施PEMS确认。
PEMS确认活动的结果应形成文档
QR-ARK-800K-RD-005+RMK-800K验光仪嵌入式软件验证报告+6.0
全面负责PEMS确认的人员应独立于设计组。
制造商应将独立性程度的解释说明形成文档
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+12.1
QR-ARK-800K-RD-005+RMK-800K验光仪嵌入式软件验证报告+6.2
设计组成员不应承担其自己设计部分的确认工作
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+12.1
QR-ARK-800K-RD-005+RMK-800K验光仪嵌入式软件验证报告+6.2
风险管理文档中应记录PEMS确认组成员和设计组成员之间的所有专业关系
KK-ARK-800K-220830+风险
管理文档+3.0
修改
14.12
如果任何部分或者全部设计是对早期设计的修改,则作为全新设计适用本章所有条款,或任何早期设计文档的持续有效性应在文档化修改/更改程序下进行评估
不适用,软件属于首次开发
当软件被修改时,YY/T0664—2008中的4.3,第5章、第7章~第9章的要求也应适用于修改
预期接入IT-网络的PEMS
14.13
如果PEMS预期接入未经PEMS制造商确认过的IT-网络,制造商为实现这样的连接应提供有效的说明,包括以下内容:
a)PEMS连接到IT-网络的目的
/
不适用,本产品无需介入IT网络
b)与PEMS相连的IT-网络所要求的特性
不适用,本产品无需介入IT网络
c)与PEMS相连的IT-网络所需的配置
不适用,本产品无需介入IT网络
d)PEMS网络连接的技术规格说明,包括数据安全规格说明
不适用,本产品无需介入IT网络
e)在PEMS,IT-网络和IT-网络上的其他设备间的预期信息流,以及预期通过IT-网络的路由;和
不适用,本产品无需介入IT网络
f)为达到PEMS与IT-网络连接目的所需特性的IT-网络失效时的危险情况清单
不适用,本产品无需介入IT网络
在随附文件中,制造商应告知责任方:
——PEMS与包含其他设备的IT-网络的连接可能导致对患者、操作者、第三方带来以往没有识别的风险
不适用,本产品无需介入IT网络
——责任方宜识别、分析、评价和控制这些风险
不适用,本产品无需介入IT网络
——对IT-网络的后续修改可能引入新的风险,需要进行补充分析
不适用,本产品无需介入IT网络
——IT-网络的更改包括:
•IT-网络配置的更改
不适用,本产品无需介入IT网络
•与IT-网络连接的新增项
不适用,本产品无需介入IT网络
•与IT-网络连接中断的项
不适用,本产品无需介入IT网络
•与IT-网络连接的设备的更新
不适用,本产品无需介入IT网络
•与IT-网络连接的设备的升级
不适用,本产品无需介入IT网络
YY/T0664-2020医疗器械软件软件生存周期过程
软件安全分级
4.3
软件安全分级应满足如下准则和要求:
a)制造商应根据软件系统在最不利情况下(如图3所示)促成的危险情况引发的对患者、操作者或其他人员伤害的风险,赋予每个软件系统一个软件安全级别(A、B或C)
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+4.0
下列情况下软件系统的软件安全级别为A:
——软件系统不可能促成危险情况;或
不适用,软件的级别为B级
——在考虑外部风险控制措施后,软件系统可能促成不导致不可接受风险的危险情况
不适用,软件的级别为B级
下列情况下软件系统的软件安全级别为B:
——在考虑外部风险控制措施后,软件系统可能促成导致不可接受风险的危险情况,且导致的可能伤害是非严重损伤
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+4.2
下列情况下软件系统的软件安全级别为C:
——在考虑外部风险控制措施后,软件系统可能促成导致不可接受风险的危险情况,且导致的可能伤害是死亡或严重损伤
不适用,软件的级别为B级
对于最初分类为软件安全级别B或C的软件系统,制造商可以实施软件系统外部附加风险控制措施(包括修改含有软件系统的系统体系结构),并在随后为软件系统赋予新的软件安全级别
不适用.软件系统外部附加风险控制措施
b)制造商应在风险管理文档中将赋予每个软件系统的软件安全级别形成文件
QR-PEMS-ARK-800K-001-01+可编程医用电气系统(PEMS)文档+2.0
c)当一个软件系统分解为多个软件项,及当一个软件项又进一步分解为多个软件项时,此类软件项应继承原软件项(或软件系统)的软件安全级别,除非制造商以文件形式说明分类为不同软件安全级别的理由[根据4.3a)用"软件项"替换"软件系统"赋予的软件安全级别]。
此类理由说明应解释新的软件项如何被隔离,以便可对其单独分级
不适用.软件系统无多次分解成软件项
d)如果以分解方式产生的软件项的安全级别与其原软件项不同,制造商应将每个此类软件项的软件安全级别形成文件
不适用,无使用分解的方式产生
e)为符合本标准,当本标准应用于一组软件项时,制造商应使用此组中级别最高的软件项所要求的诸过程和任务,除非制造商在风险管理文档中将使用较低级别的理由说明形成文件
不适用,只有一个软件系统
f)对每个软件系统,在赋予软件安全级别以前,均应应用C级要求
不适用,只有一个软件系统
软件开发策划
软件开发计划
5.1
5.1.1
制造商应建立一项(或多项)软件开发计划,以便实施适合于拟开发软件系统的范围、规模和软件安全级别的软件开发过程相关活动。
在计划中应完整地定义或引用软件开发生存周期模型
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
计划应说明下列各项:
a)用于软件系统开发的过程
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)各项活动和任务的交付物(包括文档)
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
c)系统需求、软件需求、软件系统测试以及在软件中实施的风险控制措施之间的可追溯性
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
d)软件配置和变更管理,包括未知来源软件的配置项和用于支持开发的软件
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
e)软件问题解决方案,以处理在生弃周期各阶段的医疗器械软件,交付物和活动中所发现的问题
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
保持对软件开发计划的更新
5.1.2
适当时,制造商应随着开发的进行更新计划
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
引用系统设计和开发的软件开发计划
5.1.3
在软件开发计划中,制造商应
a)引用系统需求,作为软件开发的输入
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)包括或引用用于协调软件开发和系统开发所必需的规程以满足4.1的要求(例如系统的集成、验证和确认)
软件开发标准、方法和工具的策划
5.1.4
制造商应在软件开发计划中包括或引用与C级软件项开发有关的:
a)标准:
不适用,软件的级别为B级
b)方法
/
c)工具
/
软件集成和集成测试的策划
5.1.5
制造商应在软件开发计划中包括或引用一项计划,以集成软件项(包括未知来源软件)并在集成过程中完成测试
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
软件验证策划
5.1.6
制造商应在软件开发计划中包括或引用下列验证信息:
a)要求验证的交付物
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)每个生存周期活动所要求的验证任务
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
c)对交付物讲行验证的里程碑硬
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
d)验证交物的验收准则
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
软件风险管理策划
5.1.7
制造商应在软件开发计划中包括或引用一项计划,以实施软件风险管理过程的活动和任务,包括与未知来源软件有关的风险的管理
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
文档的策划
5.1.8
制造商应在软件开发计划中包括或引用有关在软件开发生存周期中要生成的文件的信息,对每个已识别的文件或文件类型,应包括或引用如下信息:
a)标题、名称或命名约定
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)目的
c)开发、评审、批准和修改的规程和职责
软件配置管理策划
5.1.9
制造商应在软件开发计划中包括或引用软件配置管理信息,软件配置管理信息应包括或引用:
a)拟受控项的级别、型式、类别或清单
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)软件配置管理活动和任务
c)负责实施软件配置管理活动的一个或多个组织
d)这些组织和其他诸如软件开发或维护组织的关系
e)何时将这些项目置于配置控制之下
f)何时使用问题解决过程
拟受控的支持项
5.1.10
拟受控项应包括用于医疗器械软件开发并对医疗器械软件可能有影响的工具、项目或设置
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
验证前软件配置项的控制
5.1.11
制造商应进行策划以将软件配置项在验证之前置于配置管理控制之下
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
识别和避免常见软件缺陷
5.1.12
制造商应在软件开发计划中包括或引用以下规程:
a)基干所选的与其软件系统相关的编程技术,识别可能引入的缺陷类别
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
b)证实这些缺陷不会促成不可接受风险的形成文件的证据
QR-ARK-8OOK-RD-OO4+软件开发计划书+5.
软件需求分析
定义来自系统需求的软件需求并将其形成文件
5.2
5.2.1
对医疗器械的每个软件系统,制造商应定义来自系统级需求的软件系统需求并形成文件
QR-ARK-800K-RD-001+验光需求文档+6.0
软件需求的内容
5.2.2
若适用于医疗器械软件,制造商应在软件需求中包括:
a)功能和性能需求
QR-ARK-800K-RD-001+验光需求文档+6.0
b)软件系统的输人和输出
c)软件系统和其他系统之间的接口
d)软件驱动的报警、警告和操作者信息
e)信息安全需求
f)由软件实现的用户界面需求
g)数据定义和数据库需求
h)已交付医疗器械软件在一个或多个操作和维护现场的安装和验收需求
i)与操作和维护方面有关的需求
j)与IT-网络方面有关的需求
k)用户维护需求
1)法规要求
将风险控制措施纳入软件需求
5.2.3
制造商应将在软件中实施的风险控制措施包含在适当的医疗器械软件需求中
QR-ARK-800K-RD-001+验光需求文档+6.0
医疗器械风险分析的再评价
5.2.4
制造商应在建立了软件需求后对医疗器械风险分析进行再评价,并在适当时予以更新
QR-ARK-800K-RD-001+验光需求文档+6.0
更新需求
5.2.5
作为软件需求分析活动的结果,制造商应确保现有需求(包括系统需求)得到再评价,并在适当时予以更新
QR-ARK-800K-RD-001+验光需求文档+6.0
验证软件需求
5.2.6
制造商应对软件需求进行以下验证并形成文件:
a)实现了系统需求,包括那些与风险控制有关的需求
QR-ARK-800K-RD-001+验光需求文档+6.0
b)彼此不互相矛盾
c)避免使用含糊不清的术语表述
d)以允许建立测试准则和实施测试的术语描述
e)可被唯一识别
f)可追溯至系统需求或其他来源
软件体系结构设计
将软件需求转换为体系结构
5.3
5.3.1
制造商应将对医疗器械软件的需求转换为形成文件的体系结构,该体系结构描述软件的结构并识别所有软件项
QR-ARK-800K-RD-002+验光需求文档+5.0
为软件项接口开发体系结构
5.3.2
制造商应为软件项与软件项的外部组件(软件和硬件)之间,以及软件项之间的接口开发一个体系结构并将其形成文件
QR-ARK-800K-RD-002+验光需求文档+5.0
规定未知来源软件项的功能和性能需求
5.3.3
如果软件项被识别为未知来源软件,制造商应规定未知来源软件项预期用途所必需的功能和性能需求
QR-ARK-800K-RD-002+验光需求文档+5.0
规定未知来源软件项所要求的系统硬件和软件
5.3.4
如果软件项被识别为未知来源软件,制造商应规定为支持未知来源软件项正常运行所必需的系统硬件和软件
QR-ARK-800K-RD-002+验光需求文档+5.0
确定风验控制所必需的隔离
5.3.5
制造商应确定风险控制所必需的软件项之间的任何隔离,并说明如何确保隔离有效
不适用,软件的级别为B级
验证软件体系结构
5.3.6
制造商应验证下列各项并形成文件:
a)软件体系结构实现系统和软件需求,包括与风险控制有关的需求
QR-ARK-800K-RD-002+验光需求文档+5.0
b)软件体系结构能够支持软件项之间、软件项与硬件之间的接口
c)医疗器械体系结构支持任何未知来源软件项的正常运行
软件详细设计
将软件细分为软件单元
5.4
5.4.1
制造商应将软件细分直至其呈现为软件单元
QR-ARK-800K-RD-002+验光需求文档+5.0
为每个软件单元开发详细设计
5.4.2
制造商应形成具有足够细节的设计文件,以正确实现每个软件单元
不适用,软件的级别为B级
为接口开发详细设计
5.4.3
制造商应为软件单元与外部组件(硬件或软件)之间的任何接口,以及软件单元之间的任何接口形成具有足够细节的设计文件,以正确实现每个软件单元及其接口
不适用,软件的级别为B级
验证详细设计
5.4.4
制造商应验证软件详细设计的下列各项并形成文件:
a)是否实现软件体系结构
不适用,软件的级别为B级
b)是否与软件体系结构不相矛盾
软件单元的实现
实现每个软件单元
5.5
5.5.1
制造商应实现每个软件单元
QR-ARK-800K-RD-002+验光需求文档+5.0
建立软件单元的验证过程
5.5.2
制造商应为验证软件单元建立策略、方法和规程。
在通过测试进行验证时,应评价测试规程的充分性
QR-ARK-800K-RD-002+验光需求文档+5.0
软件单元的验收准则
5.5.3
适当时,在集成为更大的软件项之前,制造商应为软件单元建立验收准则,并确保软件单元符合验收准则
QR-ARK-800K-RD-002+验光需求文档+5.0
附加的软件单元验收准则
5.5.4
当下列各项在设计中出现,适当时,制造商应包括附加的验收准则:
a)适当的事件序列
不适用,软件的级别为B级
b)数据和控制流
c)所计划的资源分配
d)故障处理(错误界定、隔离和恢复)
e)变量的初始化
f)自我诊断
g)存储管理和存储溢出
h)边界条件
软件单元的验证
5.5.5
制造商应实施软件单元验证并将结果形成文件
QR-ARK-800K-RD-002+验光需求文档+5.0
软件集成和集成测试
集成软件单元
5.6
5.6.1
制造商应按照集成计划(见5.1.5)集成软件单元
QR-ARK-800K-RD-002+验光需求文档+5.0
验证软件集成
5.6.2
制造商应验证软件单元已经按照集成计划(见5.1.5)集成到软
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 19.1 可编程医用电气系统PEMS文档自查表GB9706.1-2020 可编程 医用 电气 系统 PEMS 文档 自查 GB9706 2020
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 党组织、党员联系服务师生工作制度.docx
党组织、党员联系服务师生工作制度.docx
 物流与供应链管理 第七章 供应链综合计划.pptx
物流与供应链管理 第七章 供应链综合计划.pptx
 回弹仪检测多孔砖砖强度计算表.xls
回弹仪检测多孔砖砖强度计算表.xls
