 精品教案初中化学第十一章盐和化肥.docx
精品教案初中化学第十一章盐和化肥.docx
- 文档编号:3015952
- 上传时间:2022-11-17
- 格式:DOCX
- 页数:18
- 大小:187.67KB
精品教案初中化学第十一章盐和化肥.docx
《精品教案初中化学第十一章盐和化肥.docx》由会员分享,可在线阅读,更多相关《精品教案初中化学第十一章盐和化肥.docx(18页珍藏版)》请在冰豆网上搜索。
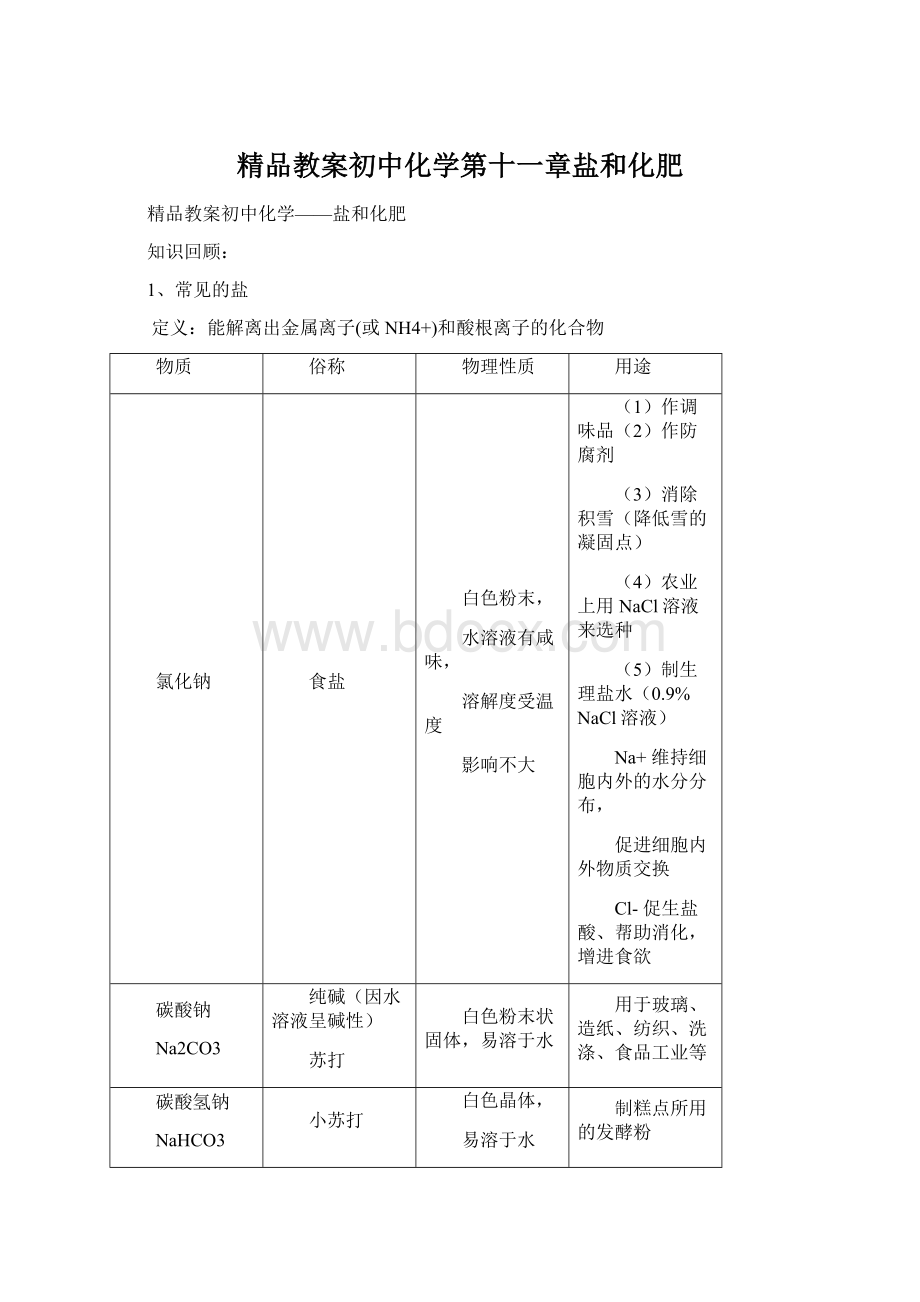
精品教案初中化学第十一章盐和化肥
精品教案初中化学——盐和化肥
知识回顾:
1、常见的盐
定义:
能解离出金属离子(或NH4+)和酸根离子的化合物
物质
俗称
物理性质
用途
氯化钠
食盐
白色粉末,
水溶液有咸味,
溶解度受温度
影响不大
(1)作调味品
(2)作防腐剂
(3)消除积雪(降低雪的凝固点)
(4)农业上用NaCl溶液来选种
(5)制生理盐水(0.9%NaCl溶液)
Na+维持细胞内外的水分分布,
促进细胞内外物质交换
Cl-促生盐酸、帮助消化,增进食欲
碳酸钠
Na2CO3
纯碱(因水溶液呈碱性)
苏打
白色粉末状固体,易溶于水
用于玻璃、造纸、纺织、洗涤、食品工业等
碳酸氢钠
NaHCO3
小苏打
白色晶体,
易溶于水
制糕点所用的发酵粉
医疗上,治疗胃酸过多
备注
(1)粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。
(无水氯化钙可用作干燥剂)
(2)碳酸钠从溶液中析出时,会结合一定数目的水分子,化学式为Na2CO3·10H2O。
碳酸钠晶体Na2CO3·10H2O(纯净物),俗称天然碱、石碱、口碱。
风化:
常温时在空气中放置一段时间后,失去结晶水而变成粉末。
(化学变化)
(3)2NaHCO3△Na2CO3+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑
二、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、实验步骤:
溶解、过滤、蒸发
2、实验仪器
实验步骤
实验仪器
其中玻璃棒的作用
溶解
烧杯、玻璃棒
加速溶解
过滤
铁架台(带铁圈)、漏斗、烧杯、玻璃棒
引流
蒸发
铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒
使液体受热均匀,防止液体飞溅
三、盐的化学性质
1、盐(可溶)+金属1→金属2+新盐(金属1比金属2活泼,K、Ca、Na除外)
2、盐+酸→新盐+新酸
3、盐+碱→新盐+新碱(反应物需都可溶,且满足复分解反应的条件)
4、盐+盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)
四、酸、碱、盐的溶解性
1、酸:
大多数都可溶(除硅酸H2SiO3不溶)
2、碱:
只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀
3、盐:
钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除AgCl难溶外,其余多数均可溶;
硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:
BaSO4、、AgCl不溶于水,也不溶于酸
五、化学肥料
1、
农家肥料:
营养元素含量少,肥效慢而持久、价廉、能改良土壤结构
2、化学肥料(氮肥、钾肥、磷肥)
(
1)氮肥作用:
促进植物茎、叶生长茂盛、叶色浓绿(促苗)。
缺氮:
叶黄
a、常用氮肥
尿素CO(NH2)2:
含氮量最高的氮肥(有机物)46.7%
含N量
使用注意事项
NH4HCO317.7%
易分解,施用时深埋
铵态氮肥防晒防潮,且均不能与碱性物质(如草木灰、熟石灰等)混合施用
NH4NO335%
易爆,结块不可用铁锤砸
(NH4)2SO421.2%
长期使用会使土壤酸化、板结
NH4Cl26.2%
NH3.H2O
加水稀释后施用
NaNO3
b、NH4+的检验
试剂:
碱(NaOH、Ca(OH)2等)、湿润的红色石蕊试纸
NH4NO3+NaOH=NaNO3+NH3↑+H2O
c、生物固氮:
豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收
(2)钾肥作用:
促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。
缺钾:
叶尖发黄
常用钾肥KCl
草木灰:
农村最常用钾肥(主要成分为K2CO3),呈碱性
K2SO4:
长期使用会使土壤酸化、板结
(3)磷肥作用:
促进植物根系发达,穗粒增多,饱满(催果)
缺磷:
生长迟缓,产量降低,根系不发达
常用磷肥磷矿粉Ca3(PO4)2
钙镁磷肥(钙和镁的磷酸盐)
过磷酸钙Ca(H2PO4)2和CaSO4不能与碱性物质混合施用。
重过磷酸钙Ca(H2PO4)2如草木灰、熟石灰
4、复合肥:
含N、P、K中的两种或三种
KNO3
NH4H2PO4
(NH4)2HPO4不能与碱性物质混合施用
三、使用化肥、农药对环境的影响
1、土壤污染:
重金属元素、有毒有机物、放射性物质
2、大气污染:
N20、NH3、H2S
3、引起水体污染:
N、P过多,导致水体富营养化,赤潮、水华等现象
四、合理使用化肥
1、
根据土壤情况和农作物种类选择化肥2、农家肥和化肥合理配用
1、
五、氮、磷、钾三种化肥的区别方法
氮肥
钾肥
磷肥
看外观
白色晶体
灰白色粉末
加水
全部溶于水
大多数不溶于水
灼烧
可燃烧,熔化有气泡或冒烟
不燃烧,跳动或有爆裂声
加熟石灰
放出具有刺激性气味的氨气
无气味放出
中考考点:
考点一、常见的盐
物质
俗称
物理性质
用途
氯化钠
食盐
白色粉末,水溶液有咸味,
溶解度受温度影响不大
(1)作调味品
(2)作防腐剂
(3)消除积雪(降低雪的熔点)
(4)农业上用NaCl溶液来选种
(5)制生理盐水(0.9%NaCl溶液)
Na+维持细胞内外的水分分布,促进细胞内外物质交换
Cl-促生盐酸、帮助消化,增进食欲
碳酸钠
Na2CO3
纯碱(因水溶液呈碱性)、苏打
白色粉末状固体,易溶于水
用于玻璃、造纸、纺织、洗涤、食品工业等
碳酸氢钠
NaHCO3
小苏打
白色晶体,
易溶于水
制糕点所用的发酵粉
医疗上,治疗胃酸过多
碳酸钙
CaCO3
石灰石、大理石
白色固体
难溶于水
建筑材料、补钙剂
备注
1、粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。
(无水氯化钙可用作干燥剂)
2、碳酸钠从溶液中析出时,会结合一定数目的水分子,化学式为Na2CO3·10H2O。
碳酸钠晶体Na2CO3·10H2O(纯净物),俗称天然碱、石碱、口碱。
风化:
常温时在空气中放置一段时间后,失去结晶水而变成粉末。
(化学变化)
Na2CO3·10H2O=Na2CO3+10H2O
3、2NaHCO3△Na2CO3+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑
考点二、粗盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、实验步骤:
溶解、过滤、蒸发
2、实验仪器
实验步骤
实验仪器
其中玻璃棒的作用
溶解
烧杯、玻璃棒
加速溶解
过滤
铁架台(带铁圈)、漏斗、烧杯、玻璃棒
引流,防止液体溅出漏斗外
蒸发
铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒
使液体受热均匀,防止液体飞溅
考点三、碳酸钠、碳酸氢钠、碳酸钙的化学性质
1、碳酸钙的化学性质:
①与酸的反应:
2HCl+CaCO3=CaCl2+H2O+CO2↑
②高温分解:
CaCO3
CaO+CO2↑
2、碳酸钠的化学性质:
(1)与酸的反应:
2HCl+Na2CO3=2NaCl+H2O+CO2↑
(2)与碱溶液的反应;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
这两个反应可用于检验NaOH是否变质
3、碳酸氢钠的化学性质:
与酸的反应;
HCl+NaHCO3=NaCl+H2O+CO2↑
4、检验溶液中存在CO32-的方法:
⑴取样少许与试管中,加入稀HCl,若有无色气泡产生,然后将该气体通入澄清石灰水中,石灰水变浑浊,则证明存在CO32-
2HCl+CaCO3=CaCl2+H2O+CO2↑Ca(OH)2+CO2====CaCO3↓+H2O
⑵加入石灰水或Ba(OH)2溶液,若溶液变浑浊,然后加入稀盐酸浑浊消失,则存在CO32-Ca(OH)2+Na2CO3=CaCO3↓+2NaOH2HCl+CaCO3=CaCl2+H2O+CO2↑
⑶加入CaCl2或Ca(NO3)2溶液,若液体变浑浊,则有存在CO32-
CaCl2+Na2CO3=CaCO3↓+2NaClCa(NO3)2+Na2CO3=CaCO3↓+2Na(NO3)2
考点四、盐的性质
(一)、酸、碱、盐的溶解性
1、酸:
大多数都可溶(除硅酸H2SiO3不溶)
2、碱:
只有氨水、氢氧化钠、氢氧化钾、氢氧化钡可溶于水,氢氧化钙微溶于水,其余均为沉淀
3、盐:
钾盐、钠盐、硝酸盐、铵盐都可溶;
硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;
氯化物除AgCl难溶外,其余多数均可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:
BaSO4、、AgCl不溶于水,也不溶于酸。
(二)、盐的化学性质
1、盐(可溶)+金属1→金属2+新盐(金属1比金属2活泼,K、Ca、Na除外)
反应类型:
置换反应
Fe+CuSO4==Cu+FeSO4(“古代湿法炼铜”原理)
2Al+3CuSO4=Al2(SO4)3+3CuCu+2AgNO3=Cu(NO3)2+2Ag
2、盐+酸→新盐+新酸(满足复分解反应的条件)反应类型:
复分解反应
H2SO4+BaCl2=BaSO4↓+2HCl(注BaSO4沉淀:
白色,不溶于稀硝酸)
2HCl+Na2CO3=2NaCl+CO2↑+H2O
2HCl+CaCO3=CO2↑+CaCl2+H2O
HCl+NaHCO3=H2O+NaCl+CO2↑
HCl+AgNO3=HNO3+AgCl↓(注AgCl沉淀:
白色,不溶于稀硝酸)
3、盐+碱→新盐+新碱(反应物需都可溶,且满足复分解反应的条件)
反应类型:
复分解反应
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4现象:
出现蓝色沉淀
(注:
CuSO4溶液:
蓝色Cu(OH)2沉淀:
蓝色)
3NaOH+FeCl3=Fe(OH)3↓+3NaCl现象:
出现红褐色沉淀
(注:
FeCl3溶液:
黄色Fe(OH)3沉淀:
红褐色)
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH现象:
澄清石灰水变浑浊
4、盐+盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)
反应类型:
复分解反应
NaCl+AgNO3=AgCl↓+NaNO3现象:
出现白色沉淀
Na2SO4+BaCl2=BaSO4↓+2NaCl现象:
出现白色沉淀
考点五、复分解反应
1、概念:
由两种化合物互相交换成分,生成另外两种化合物的反应
2、特点:
首尾相交换,各元素的化合价不变
3、条件:
生成物:
有沉淀或有气体或有水生成时,复分解反应才可以发生.
4、反应物:
有酸酸必溶,无酸碱盐溶
由于初中常见的酸是可溶性的,因此:
金属氧化物+酸→盐+水
碱+酸→盐+水
RHCO3/RCO3+酸→另一种盐+CO2+H2O
考点六、特殊离子鉴别:
离子种类
检验方法(所加试剂)
现象
Cl-
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 精品 教案 初中化学 第十一 化肥
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
