 浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一.docx
浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一.docx
- 文档编号:29597197
- 上传时间:2023-07-25
- 格式:DOCX
- 页数:58
- 大小:185.53KB
浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一.docx
《浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一.docx》由会员分享,可在线阅读,更多相关《浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一.docx(58页珍藏版)》请在冰豆网上搜索。
浙江省学考选考大二轮步步高配套课件学案第三编专题十一专题十一
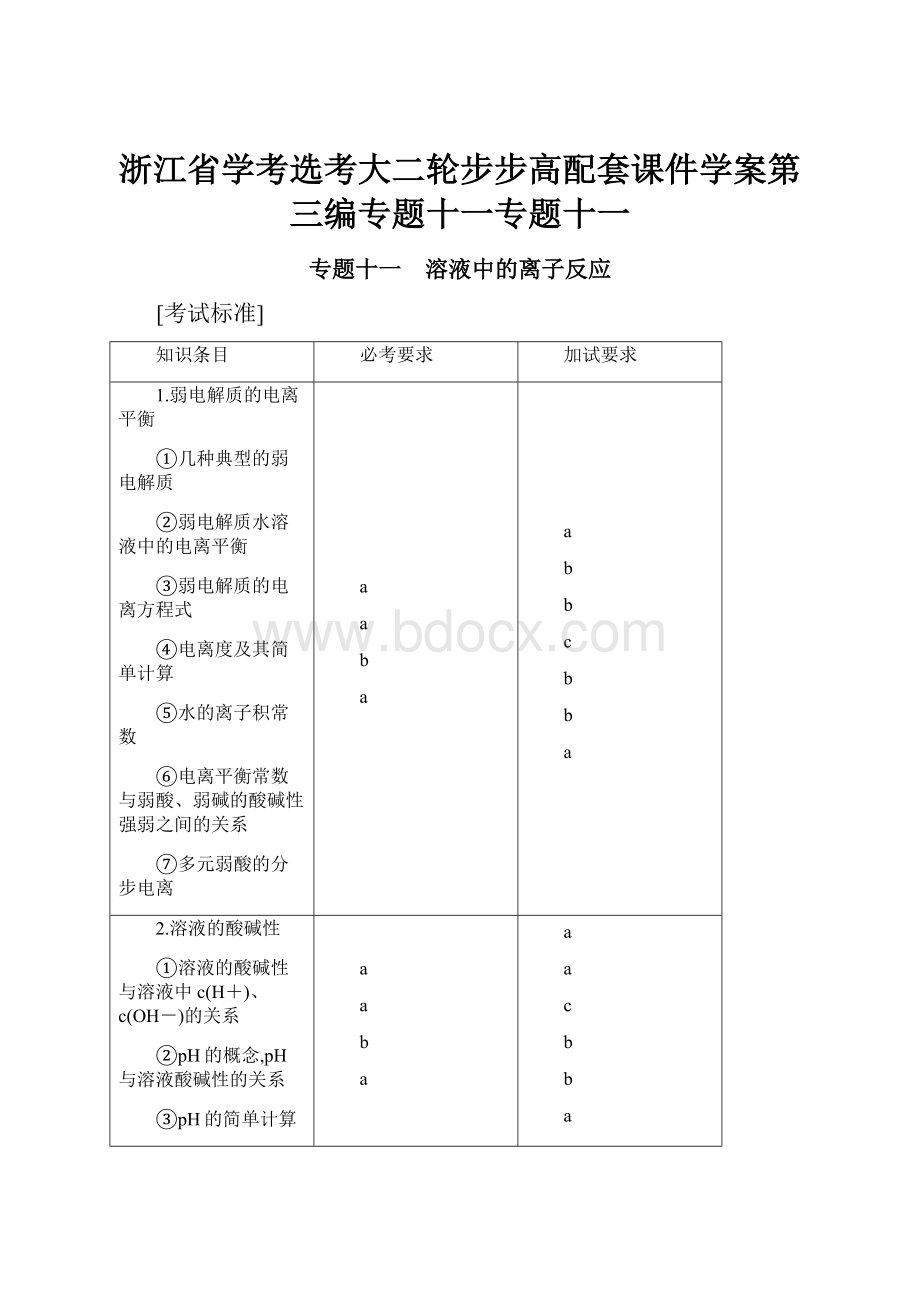
专题十一 溶液中的离子反应
[考试标准]
知识条目
必考要求
加试要求
1.弱电解质的电离平衡
①几种典型的弱电解质
②弱电解质水溶液中的电离平衡
③弱电解质的电离方程式
④电离度及其简单计算
⑤水的离子积常数
⑥电离平衡常数与弱酸、弱碱的酸碱性强弱之间的关系
⑦多元弱酸的分步电离
a
a
b
a
a
b
b
c
b
b
a
2.溶液的酸碱性
①溶液的酸碱性与溶液中c(H+)、c(OH-)的关系
②pH的概念,pH与溶液酸碱性的关系
③pH的简单计算
④测定溶液酸碱性的方法,用pH试纸、pH计测定溶液的pH
⑤中和滴定原理及其操作方法
⑥几种常见酸碱指示剂的变色范围
a
a
b
a
a
a
c
b
b
a
3.盐类的水解
①盐类的水解原理,常见盐溶液的酸碱性的判断
②盐类水解的简单应用
③盐类水解的离子反应方程式
④多元弱酸盐的分步水解
⑤影响盐类水解的因素
⑥常见酸式盐溶液的酸碱性判断
a
b
b
b
b
b
b
b
考点一 弱电解质的电离平衡
一、弱电解质
1.弱电解质
(1)概念
(2)与化合物类型的关系
强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
(3)常见的弱电解质
试写出水、氢氟酸、醋酸、次氯酸、氢氰酸、一水合氨的电离方程式。
H2O:
H2OH++OH-;
HF:
HFH++F-;
CH3COOH:
CH3COOHCH3COO-+H+;
HClO:
HClOH++ClO-;
HCN:
HCNH++CN-;
NH3·H2O:
NH3·H2ONH
+OH-。
2.弱电解质的电离平衡
(1)电离平衡的特征
(2)外界条件对电离平衡的影响
①内因:
弱电解质本身的性质。
②外因:
浓度、温度、加入试剂等。
(3)电离过程是可逆过程,可直接用化学平衡移动原理分析电离平衡。
以0.1mol·L-1CH3COOH溶液为例:
CH3COOHCH3COO-+H+(正向吸热)。
实例(稀溶液)
CH3COOHH++CH3COO-ΔH>0
改变条件
平衡移动方向
n(H+)
c(H+)
导电能力
Ka
加水稀释
→
增大
减小
减弱
不变
加入少量冰醋酸
→
增大
增大
增强
不变
通入HCl(g)
←
增大
增大
增强
不变
加NaOH(s)
→
减小
减小
增强
不变
加入镁粉
→
减小
减小
增强
不变
升高温度
→
增大
增大
增强
增大
加CH3COONa(s)
←
减小
减小
增强
不变
二、电离度、电离平衡常数
1.电离度
(1)电离度概念与表达式
一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中已经电离的电解质分子数占电解质分子总数的百分数。
(常用符号α表示)
可用数学式表达:
α=
×100%
或α=
×100%
或α=
×100%
即α=
×100%(c:
电解质浓度,Δc:
已电离电解质浓度)
注意 ①电离度适用于达到平衡的电解质溶液。
②在相同温度和相同浓度下,电离度大小可表示弱电解质的相对强弱。
电离度越小,电解质越弱。
(2)影响电离度的因素
①温度:
在其他条件不变时,升高溶液温度,电离平衡向电离方向移动,电离度增大。
②浓度:
其他条件不变时,增大弱电解质溶液浓度,平衡向电离方向移动,但电离度减小。
若降低弱电解质溶液浓度,平衡向电离方向移动,电离度增大。
③其他电解质的加入:
如同离子效应,加入与弱电解质电离有相同离子的强电解质时,会使弱电解质电离度降低。
2.电离平衡常数
(1)电离平衡常数的表达式
弱酸的电离常数用Ka来表示,弱碱的电离常数用Kb来表示。
例如:
H2S的电离常数表达式为
第一步电离:
H2SH++HS- Ka1=
第二步电离:
HS-H++S2- Ka2=
NH3·H2O的电离常数表达式为
NH3·H2ONH
+OH- Kb=
(2)K的意义
①K值越大,电离程度越大。
②多元弱酸中,Ka1≫Ka2≫Ka3,即以第一步电离为主。
以H2S电离为例,从HS-中电离出一个H+,要比从H2S中电离出一个H+难,因为第一步电离出的H+抑制了第二步电离。
(3)影响K值的因素
对于某电解质来说,影响K值的只有温度。
通常电离过程是吸热的,所以升温会使K值增大。
3.电离平衡常数(Ka)与电离度(α)的关系
常温下,cmol·L-1的CH3COOH,其电离度为α,则该CH3COOH的电离平衡常数Ka为________。
答案 cα2
解析 CH3COOHCH3COO- + H+
起始/mol·L-1c00
平衡/mol·L-1c-cαcαcα
Ka=
≈cα2。
三、一强一弱的图像分析
1.相同体积、相同浓度的HCl(a)和CH3COOH(b),分别与足量的锌粉发生反应,按要求画出图像。
(1)产生H2的体积V(H2)随时间(t)的变化图像;
(2)产生H2的速率v(H2)随时间(t)的变化图像;
(3)溶液的pH随时间(t)的变化图像。
答案
(1)
(2)
(3)
2.若把HCl(a)、CH3COOH(b)均改成相同体积、相同pH,则①②③的图像又怎样?
答案
(1)
(2)
(3)
图像法理解一强一弱的稀释规律
(1)相同体积、相同浓度的盐酸、醋酸
①加水稀释相同的倍数,醋酸的pH大。
②加水稀释到相同的pH,盐酸加入的水多。
(2)相同体积、相同pH的盐酸、醋酸
①加水稀释相同的倍数,盐酸的pH大。
②加水稀释到相同的pH,醋酸加入的水多。
题组一 弱电解质的电离平衡
1.(2018·宁波市第二中学高考专题训练)氨气溶于水达平衡后,若只改变某一条件,下列说法正确的是( )
A.继续通入氨气,
会减小
B.NH4Cl水解显酸性,所以向溶液中加入NH4Cl固体,会促进NH3·H2O电离
C.向溶液中通入HCl气体,则一定有c(NH
)=c(Cl-)
D.实验室中可以通过将浓氨水加入到碱石灰中来制取氨气
答案 D
2.将10mL0.1mol·L-1的氨水加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH
数目增多 ④c(OH-)增大 ⑤导电性增强
⑥
增大
A.①②③B.①③⑤
C.①③⑥D.②④⑥
答案 C
解析 氨水加水稀释,电离程度增大,则c(NH3·H2O)减小,NH
数目增多,①对,②错,③对;溶液中n(OH-)增大,但c(OH-)减小,④错;溶液稀释时,c(NH
)、c(OH-)均减小,溶液导电性减弱,⑤错;根据Kb=
则
=
由于温度不变,Kb不变,而c(OH-)减小,则
增大,⑥对。
3.(2017·衢州市高三1月教学质量检测)下列事实不能说明CH3COOH为弱酸的是( )
A.测得0.10mol·L-1CH3COOH溶液中存在较多的CH3COOH分子
B.比较等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成H2的体积
C.比较等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量
D.0.10mol·L-1NH4Cl溶液呈酸性,0.10mol·L-1CH3COONH4溶液呈中性
答案 B
解析 测得0.10mol·L-1CH3COOH溶液中存在较多的CH3COOH分子,说明醋酸未完全电离,是弱酸,故A正确;等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成的H2一样多,无法判断醋酸是弱酸,故B错误;等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量,醋酸放出的热量少,说明中和反应过程中存在醋酸的电离,电离过程吸热,可说明醋酸是弱酸,故C正确;0.10mol·L-1NH4Cl溶液呈酸性,0.10mol·L-1CH3COONH4溶液呈中性,均说明CH3COO-在水溶液中发生了水解,可知醋酸是弱酸,故D正确。
4.在相同温度下,100mL0.01mol·L-1的醋酸溶液与10mL0.1mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离的程度
C.H+的物质的量浓度
D.CH3COOH的物质的量
答案 B
解析 100mL0.01mol·L-1的醋酸溶液与10mL0.1mol·L-1的醋酸溶液中含有的醋酸的物质的量相同,中和时所需NaOH的量相同,A项错误;根据浓度对电离平衡的影响规律:
越稀越电离,0.01mol·L-1的醋酸溶液中醋酸电离的程度大于0.1mol·L-1的醋酸溶液中醋酸的电离程度,B项正确;H+的物质的量浓度:
前者小于后者,C项错误。
5.某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
A.a点导电能力比b点强
B.b点的Kw值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
答案 D
解析 pH:
b点大于a点,所以溶液中的离子浓度b点大于a点,即导电能力b点大于a点,A错误;b点和c点的温度相同,其Kw相等,B错误;由图像中曲线的变化趋势知,a点是NaOH溶液,c点是氨水,pH相同时c(NH3·H2O)远大于c(NaOH),结合溶液的体积c点大于a点,故消耗盐酸体积Va 题组二 电离度、电离平衡常数的应用 6.已知25℃时几种物质的电离度(溶液浓度均为0.1mol·L-1)如下表(已知硫酸的第一步电离是完全的): ①H2SO4溶液HSO H++SO ②NaHSO4溶液 HSO H++SO ③醋酸溶液 CH3COOHH++CH3COO- ④盐酸 HCl===H++Cl- 10% 29% 1.33% 100% (1)25℃时,0.1mol·L-1上述几种溶液中c(H+)由大到小的顺序是_________(填序号,下同)。 (2)25℃时,c(H+)相同的上述溶液,其物质的量浓度由大到小的顺序是_______________。 (3)25℃时,0.1mol·L-1H2SO4溶液中的HSO 的电离度小于0.1mol·L-1NaHSO4溶液中HSO 的电离度的原因是_____________________________________________________________。 答案 (1)①>④>②>③ (2)③>②>④>① (3)0.1mol·L-1的H2SO4溶液中,H2SO4第一步电离产生的H+抑制了第二步的电离,所以H2SO4中HSO 的电离度小于NaHSO4中HSO 的电离度 7. (1)N2H4易溶于水,是与氨相类似的弱碱,已知其常温下的电离常数K1=1.0×10-6。 常温下,将0.2mol·L-1N2H4·H2O与0.1mol·L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH等于________(忽略N2H4的二级电离)。 (2)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为______。 (3)已知某温度下,H2SO3的电离常数为Ka1≈1.5×10-2,Ka2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO 、SO 相等时,溶液的pH值约为______。 答案 (1)8 (2) (3)7 解析 (1)若将0.2mol·L-1N2H4·H2O溶液与0.1mol·L-1HCl溶液等体积混合,得到物质的量浓度相等的N2H5Cl和N2H4·H2O,N2H +H2ON2H4·H2O+H+,N2H4·H2ON2H +OH-,K1= 已知c(N2H )=c(N2H4·H2O),得K1=c(OH-),c(H+)= = mol·L-1=1×10-8mol·L-1,pH=8。 (2)将amol·L-1的氨水与bmol·L-1的盐酸等体积混合,反应后溶液显中性,则溶液中c(H+)=c(OH-)=1×10-7mol·L-1,根据电荷守恒c(Cl-)+c(OH-)=c(NH )+c(H+),溶液中c(NH )=c(Cl-)= mol·L-1,混合后反应前c(NH3·H2O)= mol·L-1,则反应后c(NH3·H2O)=( - )mol·L-1,Kb= = 。 (3)根据HSO SO +H+平衡常数Ka2= =1.0×10-7,此时HSO 、SO 相等,则c(H+)=1.0×10-7mol·L-1,溶液的pH=7。 考点二 水的电离、溶液的酸碱性 1.水的电离 (1)水的电离 水是极弱的电解质,水的电离方程式为H2O+H2OH3O++OH-或H2OH++OH-。 (2)水的离子积常数 Kw=c(H+)·c(OH-)。 ①室温下: Kw=1×10-14。 ②影响因素: 只与温度有关,升高温度,Kw增大。 ③适用范围: Kw不仅适用于纯水,也适用于稀的电解质水溶液。 ④Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。 注意 (1)水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。 即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。 不管哪种溶液均有c(H+) =c(OH-) 。 (2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。 (3)影响水电离平衡的因素 ①升高温度,水的电离程度增大,Kw增大。 ②加入酸或碱,水的电离程度减小,Kw不变。 ③加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,Kw不变。 (4)外界条件对水的电离平衡的影响 体系变化 条件 平衡移动方向 Kw 水的电离程度 c(OH-) c(H+) 酸 逆 不变 减小 减小 增大 碱 逆 不变 减小 增大 减小 可水解的盐 Na2CO3 正 不变 增大 增大 减小 NH4Cl 正 不变 增大 减小 增大 温度 升温 正 增大 增大 增大 增大 降温 逆 减小 减小 减小 减小 其他: 如加入Na 正 不变 增大 增大 减小 注意 在水中加入H2SO4,水的电离平衡向左移动,是因为加入H2SO4后,c(H+)增大,平衡左移。 2.溶液的酸碱性 (1)溶液的酸碱性 溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。 a.酸性溶液: c(H+)>c(OH-),常温下,pH<7。 b.中性溶液: c(H+)=c(OH-),常温下,pH=7。 c.碱性溶液: c(H+) 试判断下列溶液在常温下的酸、碱性(在括号中填“酸性”“碱性”或“中性”)。 ①相同浓度的HCl和NaOH溶液等体积混合( ) ②相同浓度的CH3COOH和NaOH溶液等体积混合( ) ③相同浓度的NH3·H2O和HCl溶液等体积混合( ) ④pH=2的HCl和pH=12的NaOH溶液等体积混合( ) ⑤pH=3的HCl和pH=10的NaOH溶液等体积混合( ) ⑥pH=3的HCl和pH=12的NaOH溶液等体积混合( ) ⑦pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( ) ⑧pH=2的HCl和pH=12的NH3·H2O等体积混合( ) 答案 ①中性 ②碱性 ③酸性 ④中性 ⑤酸性⑥碱性 ⑦酸性 ⑧碱性 (2)pH的测定方法 ①pH试纸法: 用镊子夹取一小块pH试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH。 pH试纸使用注意事项: pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;用广范pH试纸读出的pH值只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈酸性的同时呈现强氧化性(漂白性)。 ②pH计测量法。 1.(2018·浙江省“七彩阳光”新高考研究联盟高三上学期考试)已知: H2OOH-+H+,在25℃和100℃时水的Kw分别为1.0×10-14、2.5×10-13。 下列说法不正确的是( ) A.25℃时,纯水的pH=7,呈中性 B.100℃时,纯水的pH<7,呈酸性 C.纯水的c(H+): 100℃大于25℃ D.100℃的纯水中c(H+)=c(OH-) 答案 B 解析 A项,25℃时,Kw=c(H+)·c(OH-)=1.0×10-14,25℃时,c(H+)=10-7mol·L-1,pH=7,水呈中性,正确;B项,100℃时,Kw=c(H+)·c(OH-)=2.5×10-13,c(H+)>10-7mol·L-1,pH<7,水呈中性,错误;C项,根据上述分析,25℃时,c(H+)=10-7mol·L-1,100℃时c(H+)>10-7mol·L-1,所以纯水的c(H+): 100℃大于25℃,正确;D项,纯水呈中性,c(H+)=c(OH-),正确。 2.水的电离平衡曲线如图所示: (1)若以A点表示25℃时水的电离平衡时的离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________,造成水的离子积增大的原因是________________________________________________________________________。 (2)结合上图所示,下列有关说法正确的是______(填字母)。 A.图中四点Kw间的关系: A=D<C<B B.若从A点到D点,可采用温度不变在水中加入少量酸 C.若从A点到C点,可采用温度不变在水中加入少量NH4Cl固体 D.若从A点到D点,可采用温度不变在水中加入少量NaCl固体 (3)100℃时,0.01mol·L-1的NaOH溶液中由水电离出的c(OH-)为________。 答案 (1)10-14 10-12 升高温度促进了水的电离 (2)AB (3)10-10mol·L-1 解析 (1)从图中可知,B点时c(OH-)=c(H+)=10-6mol·L-1,则Kw=10-12,Kw增大的原因是升高温度,促进了水的电离。 (2)Kw只受温度影响,随着温度升高而增大,A、D点温度相同,B点温度高于C点温度,所以A项正确;从A点到D点,温度不变,酸性增强,B项正确,D项错误;A、C代表的点的温度不同,C项错误。 (3)100℃时,Kw=10-12,而0.01mol·L-1的NaOH溶液中c(OH-)=10-2mol·L-1,则由水电离出的c(OH-)=c(H+)= mol·L-1=10-10mol·L-1。 3.(2017·杭州市西湖高级中学高二12月月考) (1)一定条件下,在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示。 100℃时,若盐酸中c(H+)=5×10-4mol·L-1,则由水电离产生的c(H+)=__________。 (2)pH=3的盐酸与pH=5的盐酸等体积混合,pH=________。 (3)25℃时,在0.5L0.2mol·L-1的HA溶液中,有0.02mol的HA电离成离子,则该温度下的电离常数为__________。 答案 (1)2×10-9mol·L-1 (2)3.3 (3)0.01 解析 (1)由图中信息可知,100℃时,c(H+)=c(OH-)=10-6mol·L-1,Kw=c(H+)·c(OH-)=10-12,由水电离产生的c(H+)等于溶液中氢氧根离子浓度,盐酸中c(H+)=5×10-4mol·L-1,则c(H+)水=c(OH-)= = mol·L-1=2×10-9mol·L-1。 (2)①pH=3和pH=5的两种盐酸等体积混合,则c(H+)= ≈5×10-4mol·L-1,所以pH=-lgc(H+)=4-lg5≈3.3。 (3)在0.5L0.2mol·L-1的HA溶液中,有0.02mol的HA电离成离子,即c(A-)=c(H+)= =0.04mol·L-1,则K= = =0.01。 考点三 酸碱中和滴定 1.“中和滴定”考点归纳 (1)“考”实验仪器 酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。 其中常考的是滴定管,如正确选择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。 (2)“考”操作步骤 ①滴定前的准备: 查漏、洗涤、润洗、充液(赶气泡)、调液面、读数; ②滴定: 移液、滴加指示剂、滴定至终点、读数; ③计算。 (3)“考”指示剂的选择 ①强酸强碱相互滴定,可选用甲基橙或酚酞; ②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞); ③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。 (4)“考”误差分析 写出计算式,分析操作对V标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背结论。 此外对读数视线问题要学会画图分析。 如: 用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”“偏低”或“无影响”填空。 ①酸式滴定管未用标准溶液润洗( ) ②锥形瓶用待测溶液润洗( ) ③锥形瓶洗净后还留有蒸馏水( ) ④放出碱液的滴定管开始有气泡,放出液体后气泡消失( ) ⑤酸式滴定管滴定前有气泡,滴定终点时气泡消失( ) ⑥部分酸液滴出锥形瓶外( ) ⑦酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( ) ⑧酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( ) 答案 (1)偏高 (2)偏高 (3)无影响 (4)偏低(5)偏高 (6)偏高 (7)偏低 (8)偏高 2.“中和滴定”的注意事项 (1)锥形瓶不能用待测液润洗,酸式滴定管不能盛放碱性溶液和氢氟酸,碱式滴定管不能盛放酸性和强氧化性溶液。 (2)滴速要先快后慢,但不能成流,应一滴一滴地滴加,当接近终点时,应一滴一摇。 (3)滴定过程中,锥形瓶口不能碰滴定管下端尖嘴且眼睛注视锥形瓶中溶液颜色的变化。 (4)当最后一滴滴入使指示剂恰好变色且半分钟内不恢复原色,表示达到滴定终点。 (5)滴定的误差分析要依据公式c待= 来判断。 其中V待为准确量取的待测液体积,c标为准确配制的标准液浓度,这两者在误差分析时看为定值;因各种原因使得所耗标准液体积V标变大或变小,V标变大,则c待偏高,V标变小,则c待偏低。 1.某学习小组用“间接碘量法”测定某CuCl2晶体试样的纯度,试样不含其他能与I-发生反应的氧化性杂质,已知: 2Cu2++4I-===2CuI↓+I2,I2+2S2O ===S4O +2I-。 取mg试样溶于水,加入过量KI固体,充分反应
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 浙江省 学考选考大 二轮 步步高 配套 课件 第三 专题 十一
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 #2机组现场施工用电布置措施.docx
#2机组现场施工用电布置措施.docx
