 秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数.docx
秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数.docx
- 文档编号:28665280
- 上传时间:2023-07-19
- 格式:DOCX
- 页数:4
- 大小:45.92KB
秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数.docx
《秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数.docx》由会员分享,可在线阅读,更多相关《秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数.docx(4页珍藏版)》请在冰豆网上搜索。
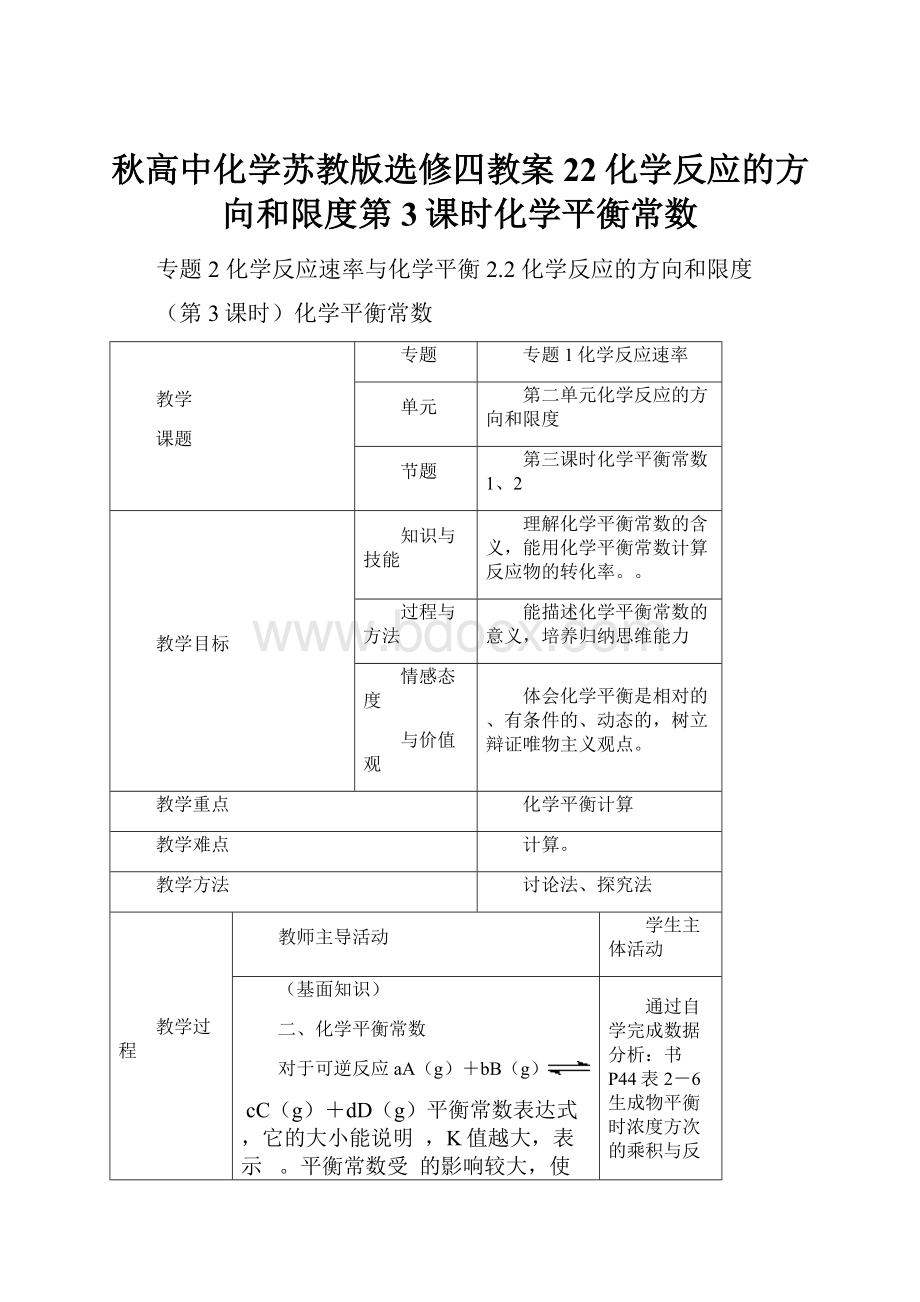
秋高中化学苏教版选修四教案22化学反应的方向和限度第3课时化学平衡常数
专题2化学反应速率与化学平衡2.2化学反应的方向和限度
(第3课时)化学平衡常数
教学
课题
专题
专题1化学反应速率
单元
第二单元化学反应的方向和限度
节题
第三课时化学平衡常数1、2
教学目标
知识与技能
理解化学平衡常数的含义,能用化学平衡常数计算反应物的转化率。
。
过程与方法
能描述化学平衡常数的意义,培养归纳思维能力
情感态度
与价值观
体会化学平衡是相对的、有条件的、动态的,树立辩证唯物主义观点。
教学重点
化学平衡计算
教学难点
计算。
教学方法
讨论法、探究法
教学过程
教师主导活动
学生主体活动
(基面知识)
二、化学平衡常数
对于可逆反应aA(g)+bB(g)
cC(g)+dD(g)平衡常数表达式,它的大小能说明,K值越大,表示。
平衡常数受的影响较大,使用时要注明。
因为和的浓度可视为定值,所以在平衡常数的表达式中不计算。
(小结)对反应mA+nBpC+qD
一、化学平衡常数
1、表达式:
平衡常数K=
2、影响因素及注意:
K受温度影响
3、意义:
越大,反应进行的越完全
4、作用:
(1)进行定量计算
(2)判断化学平衡移动方向
Q(浓度积)>K(平衡常数)化学平衡向逆反应方向移动
Q(浓度积)==K(平衡常数)化学平衡不动
Q(浓度积) (讲解) 通过自学完成数据分析: 书P44表2-6生成物平衡时浓度方次的乘积与反应物浓度方次乘积之比 放热反应—升高温度—平衡常数减小) 吸热反应—升高温度—平衡常数增大)反应中有固体和纯液体化, 教 学 过 程 教师主导活动 学生主体活动 因此其浓度不计算在表达式中。 如: CaCO3(s)CaO(s)+CO2(g) CO2(g)+H2(g)CO(g)+H2O(l) K= 5.稀溶液中反应物有水参加,水的浓度也不计算在内。 如: Cr2O72-+H2O2CrO42-+2H+ K= 6.对同一个化学反应,不同的化学方程式对应不同如: N2O4(g)2NO2(g)K= N2O4(g)NO2(g)K= 7.对于气体反应,可以用平衡时物质的量浓度表示,也可以用平衡时气体的分压表示。 N2O4(g)2NO2(g)K= 二、化学平衡常数有关计算 1、模式(初—转—平)注意: 单位 2、步骤: [例题1]1.在某温度下,可逆反应mA+nBpC+ qD的平衡常数为K,下列说法正确的是() A.K越大,达到平衡时,反应进行的程度越大。 B.K越小,达到平衡时,反应物的转化率越大。 C.K随反应物浓度的改变而改变。 D.K随温度的改变而改变。 E.K越大,反应的速率越大。 K=c(CO2)边讨论,边理解因化学计量数变而变 对应方次理解思维方法AD
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 苏教版 选修 教案 22 化学反应 方向 限度 课时 化学平衡 常数
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《贝的故事》教案4.docx
《贝的故事》教案4.docx
