 高考化学原电池和电解池的工作原理.docx
高考化学原电池和电解池的工作原理.docx
- 文档编号:2859087
- 上传时间:2022-11-16
- 格式:DOCX
- 页数:9
- 大小:182.12KB
高考化学原电池和电解池的工作原理.docx
《高考化学原电池和电解池的工作原理.docx》由会员分享,可在线阅读,更多相关《高考化学原电池和电解池的工作原理.docx(9页珍藏版)》请在冰豆网上搜索。
高考化学原电池和电解池的工作原理
【化学】高考化学:
原电池和电解池的工作原理
电化学基础
【考纲展示】
1.了解原电池和电解池的工作原理。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施。
【知识回扣】
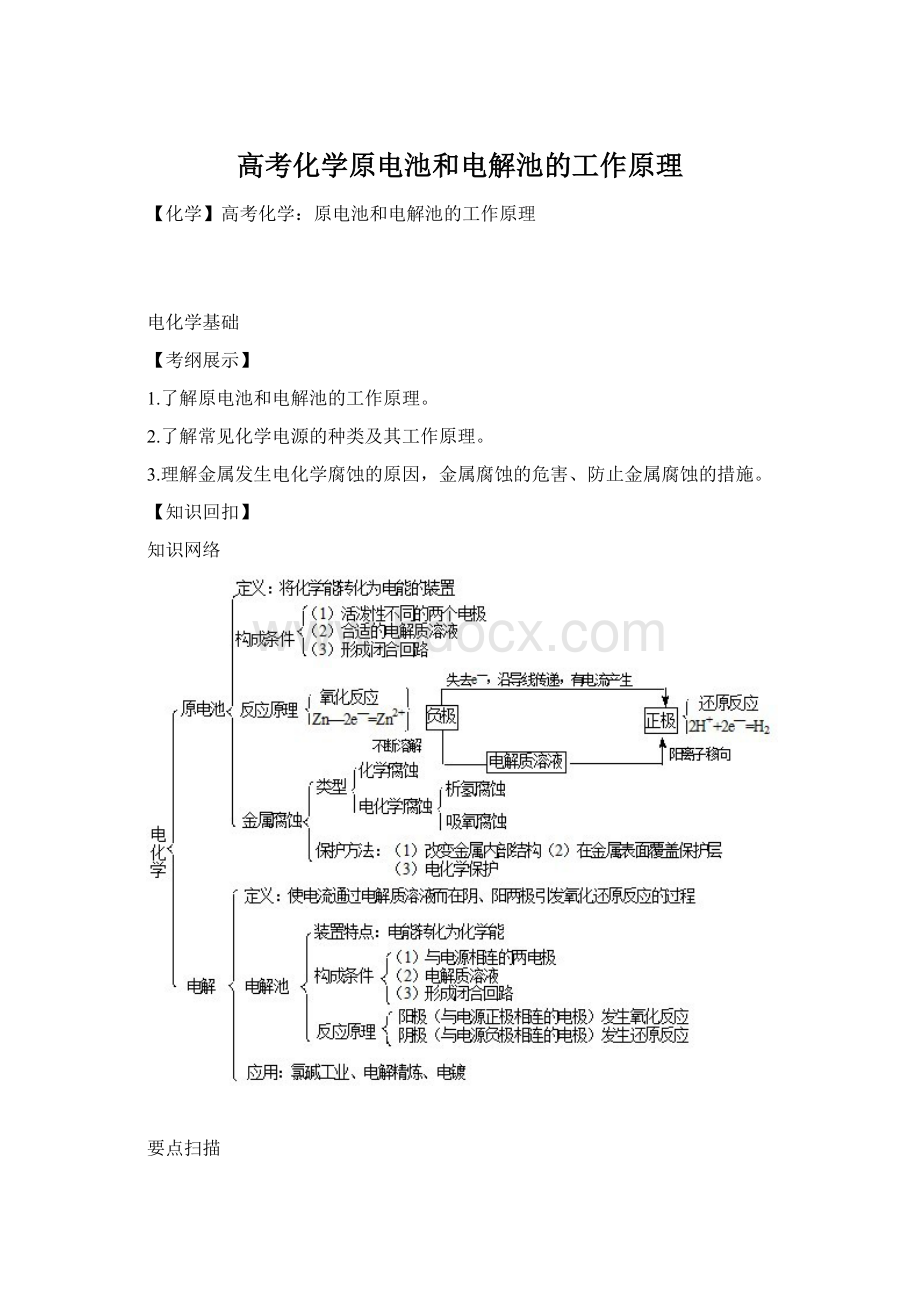
知识网络
要点扫描
一、原电池和电解池电极确定的方法
电化学中电极的确定是电池反应式正确书写的前提,判断的方法有:
1.根据反应本质速判电极
不论是原电池还是电解池,阳极总是发生氧化反应,阴极总是发生还原反应(原电池负极发生氧化反应,正极发生还原反应),若能找出电极发生的反应是氧化反应,还是还原反应,则可迅速确定电极。
2.根据电子、离子移动方向判断电极
不论是在原电池还是在电解池中,电子总是从阳极(负极)流向外电路;电解液中总是阳离子移向阴极(正极),阴离子移向阳极(负极)。
3.根据溶液pH变化或电极现象判断电极
无论是在原电池还是在电解池中,只要是有H2生成的电极,该电极区溶液的pH就增大,该电极上发生还原反应,该电极为正极;只要是有O2生成的电极,该电极区pH就减小,该电极发生氧化反应,该电极为负极(阳极)。
二、电极反应式的书写
1.原电池电极反应式的书写
(1)一般电极反应式的书写
(2)复杂电极反应式的书写
2.电解池电极反应式的书写
首先分析电解质水溶液的组成,找全离子并分为阴、阳两组;然后分别对阴阳离子排出放电顺序,写出两极上的电极反应式;最后合并两个电极反应式得出电解总方程式。
注意事项:
(1)书写电解池中电极反应式时,要以实际参加放电的离子表示,但书写总方程式时,弱电解质要写成分子式;
(2)要确保两极电子转移数目相等,且注明条件“电解”。
三、电解计算
1.根据电子守恒法计算:
用于串联电路、阴、阳两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算:
凡是总反应式反映出的物质的量关系都可以列比例式计算。
3.根据关系计算:
由得失电子守恒定律关系建立已知量与未知量之间的桥梁,建立计算的关系式,如
物质:
H2~O2~Cl2~Cu~Ag~H+~OH—~e—
mol 2 1 2 2 4 4 4 4
【热点透视】
热点题型
【典例1】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是
A.液滴中的Cl—由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:
O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b
区迁移,与b区的OH—形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,
则负极发生的电极反应为:
Cu-2e-=Cu2+
解析:
液滴边缘O2多,在碳粒上发生正极反应O2+2H2O+4e-=4OH-。
液滴下的Fe发生负极反应,Fe-2e-=Fe2+,为腐蚀区(a)。
A.错误。
Cl-由b区向a区迁移;B.正确;C.错误。
液滴下的Fe因发生氧化反应而被腐蚀;D.错误。
Cu更稳定,作正极,反应为O2+2H2O+4e-=4OH-。
答案:
B
命题意图:
本题考查电化学内容中金属吸氧腐蚀的原理的分析。
老知识换新面孔,高考试题,万变不离其宗,关键的知识内容一定要让学生自己想懂,而不是死记硬背。
学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能回答。
【典例2】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积:
;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因
甲溶液 ;乙溶液 ;丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
。
解析:
(1)①乙中C电极质量增加,则c处发生的反应为:
Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。
丙中为K2SO4,相当于电解水,设电解的水的质量为xg。
由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。
由方程式2H2+O2
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转移0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。
②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑。
③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。
④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2×64=16g。
⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。
乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。
丙中为电解水,对于K2SO4而言,其pH几乎不变。
(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
答案:
(1)①正极 ②4OH--4e-=2H2O+O2↑。
③2.8L ④16g ⑤甲增大,因为相当于电解水;乙减小,OH-放电,H+增多。
丙不变,相当于电解水。
(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
技巧点拨:
电化学知识是氧化还原反应知识的延续和深入,在分析电化学题目时,要注意氧化还原反应知识的运用。
热点预测
【预测1】一种充电电池放电时的电极反应为( )
H2+2OH-—2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH-
当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原 B.NiO(OH)的还原
C.H2的氧化 D.Ni(OH)2的氧化
解析:
由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充电时H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以
“Ni(OH)2的氧化”正确。
答案:
D
命题立意:
考查二次电池中的氧化还原问题
技巧点拨:
关于充电电池的氧化还原问题是常考点,这类题有规律。
原电池时,先要分析氧化剂与还原剂,氧化剂被还原、还原剂被氧化;充电时(电解池),原电池负极反应反着写为还原过程,发生在阴极,原电池中的正极反应反着写为氧化过程,发生在阳极。
【预测2】有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。
电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
A.每消耗1molCH4可以向外电路转移4mol电子
B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e—
C.负极上是O2获得电子,电极反应式为:
O2+2H2O+4e—=4OH—
D.电池放电后,溶液pH不断升高
解析:
判断电池正负极的方法是确定在该电极上的电子得失情况。
若得电子,则为正极,反之则为负极。
CH4在电极上发生的反应类似于燃烧反应,即CH4→CO2,(确切地说生成的CO2继续与KOH反应生成K2CO3和H2O),碳元素价态升高,失去电子,是电池的负极。
电极反应式为CH4+10OH—=CO32—+7H2O+8e—,B项正确;每当有1molCH4被氧化时,失去电子8mol,A项错误;O2在正极上得到电子,电极反应式为O2+2H2O+4e—=4OH—,C项错误;总反应式为:
CH4+2O2+2KOH=K2CO3+3H2O反应中消耗KOH,所以放电时pH不断下降,D项错误。
答案:
B
技巧点拨:
燃料电池属于新型化学电源,因其电池总反应类似于可燃物燃烧而得名。
在书写(包括判断)燃料电池的电极反应时,可分为三个步骤:
一、写出可燃物燃烧的化学方程式,分析元素的氧化、还原。
二、写出氧化剂→还原产物,还原剂→氧化产物的表达式(可能不完整或重复)。
三、结合电解液成分与还原产物或氧化产物的反应确定电极反应的最终表达式。
【直击高考】
1.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
2.以ZnCl2和KCl为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无关
C.电镀时保持电流恒定,升高温度不会改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
3.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。
下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:
O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:
Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
4.如下图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:
断开K2,闭合K1一段时间(上为K2,下为K1),观察到两只玻璃管内部有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转,下列说法不正确的是( )
A.断开K2,闭合K1时,a极上的电极反应式为:
4OH——4e—=O2↑+2H2O
B.断开K2,闭合K1一段时间,溶液的pH要变大
C.断开K1,闭合K2时,b极上的电极反应为:
2H++2e—=H2↑
D.断开K1,闭合K2时,OH—向b移动
5.氢氧燃料电池以氢气为还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。
以下数种说法:
①负极反应为:
O2+2H2O+4e—=2OH—;②负极反应为:
H2+4OH——4e—=4H2O;③电池工作时正极区碱性增强,负极区碱性减弱;④电池工作时溶液中阴离子移向正极。
正确的组合是( )
A.①④ B.②④ C.①③④ D.②③
6.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高考 化学 原电池 电解池 工作 原理
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
