 高中化学复习知识点原电池原理理解.docx
高中化学复习知识点原电池原理理解.docx
- 文档编号:27971117
- 上传时间:2023-07-07
- 格式:DOCX
- 页数:18
- 大小:170.75KB
高中化学复习知识点原电池原理理解.docx
《高中化学复习知识点原电池原理理解.docx》由会员分享,可在线阅读,更多相关《高中化学复习知识点原电池原理理解.docx(18页珍藏版)》请在冰豆网上搜索。
高中化学复习知识点原电池原理理解
高中化学复习知识点:
原电池原理理解
一、单选题
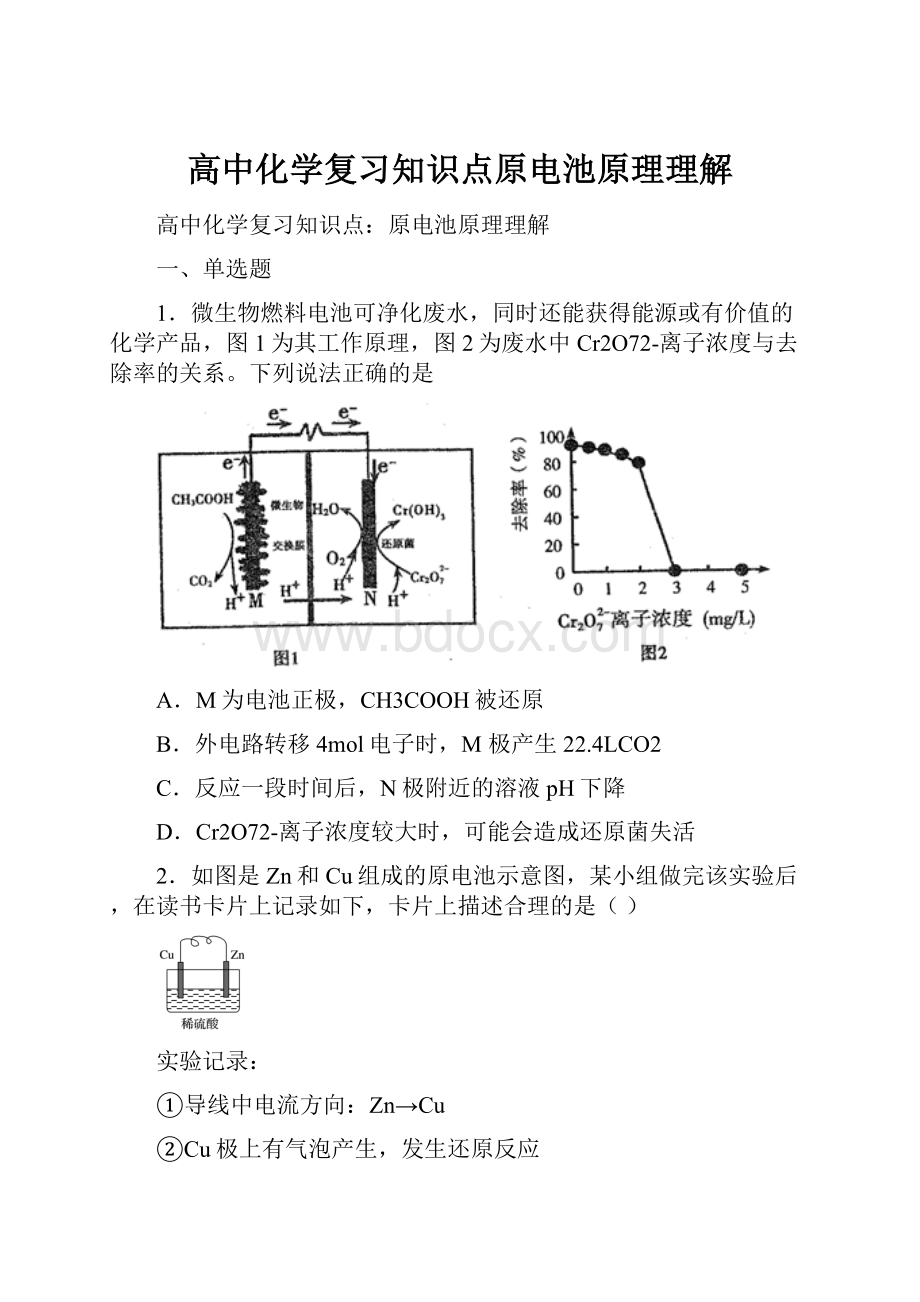
1.微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。
下列说法正确的是
A.M为电池正极,CH3COOH被还原
B.外电路转移4mol电子时,M极产生22.4LCO2
C.反应一段时间后,N极附近的溶液pH下降
D.Cr2O72-离子浓度较大时,可能会造成还原菌失活
2.如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是()
实验记录:
①导线中电流方向:
Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:
Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
3.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为30%H2SO4溶液,放电时的电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列说法正确的是()
A.Pb为正极,被氧化
B.溶液的pH不断减小
C.SO42-向PbO2极移动
D.溶液的pH不断增大
4.在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是()
A.碳棒上有气体放出,溶液的pH增大
B.导线中有电子流动,电子从a极流到b极
C.a是正极,b是负极
D.a极上发生了氧化反应
5.如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法正确的是()
A.X为负极,电极反应式为Si-4e-=Si4+
B.X为正极,电极反应式为4H2O+4e-=4OH-+2H2↑
C.X为负极,电极反应式为Si+6OH--4e-=SiO
+3H2O
D.Y为负极,电极反应式为Fe-2e-=Fe2+
6.原电池产生电流的本质原因是( )
A.原电池中溶液能电离出自由移动的离子
B.有两根导线将两个活动性不同的电极连接
C.电极上进行的氧化还原反应的生成物为电子
D.电极上进行的氧化还原反应中会有电子的转移
7.下列关于能量转化的认识不正确的是()
A.绿色植物的光合作用是将光能转化为化学能
B.煤燃烧时化学能转化成热能和光能
C.原电池工作时,化学能转化为电能
D.白炽灯工作时,电能全部转化为光能
8.如图为番茄电池,下列说法正确的是()
A.锌电极是该电池的正极
B.铜电极附近会出现蓝色
C.一段时间后,锌电极质量会变小
D.电子由铜电极经过导线流向铸电极
9.某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。
下列有关该电池的说法正确的是()
A.铜片上的电极反应:
Cu—2e﹣=Cu2+
B.锌片为电池的负极
C.外电路中电子由铜片经导线流向锌片
D.电池工作时电能直接转化为化学能
10.某同学根据化学反应
,并利用实验室材料制备原电池.下列关于该原电池的组成及现象描述正确的是()
选项
A
B
C
D
正极
碳棒
碳棒
铁棒
碳棒
负极
铁棒
铁棒
锌片
铁棒
电解质溶液
溶液
溶液
溶液
溶液
现象
铁棒变细,碳棒周围溶液黄色变浅
铁棒变细,碳棒变粗
锌棒变细,铁棒变粗
铁棒变细,碳棒不变
A.AB.BC.CD.D
二、综合题
11.燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ•mol-1
③H2O(g)=H2O(l) △H=-44kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式______________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:
NO(g)+O3(g)
NO2(g)+O2(g) △H1 =-200.9kJ•mol-1 Ea1 =3.2kJ•mol-1
反应Ⅱ:
SO2(g)+O3(g)
SO3(g)+O2(g) △H2 =-241.6kJ•mol-1 Ea2 =58kJ•mol-1
已知该体系中臭氧发生分解反应:
2O3(g)
3O2(g)。
请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0molNO、1.0molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是____________。
AP点一定为平衡状态点
B温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______;反应Ⅱ在此时的平衡常数为______。
(3)用电化学法模拟工业处理SO2。
将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
①M极发生的电极反应式为____________。
②当外电路通过0.2mol电子时,质子交换膜左侧的溶液质量_______(填“增大”或“减小”)_______克。
12.国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。
如图是该反应生成1mol水蒸气的能量变化示意图。
写出该反应的热化学方程式__________。
(2)2NO(g)+O2(g)
2NO2(g)的反应历程如下:
反应Ⅰ:
2NO(g)
N2O2(g)(快)ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:
N2O2(g)+O2(g)
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
①一定条件下,反应2NO(g)+O2(g)
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__________(填“大于”“小于”或“等于”)k2逆增大的倍数。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:
H2S+O2=H2O2+S↓。
①装置中H+向_______池迁移。
②乙池溶液中发生反应的离子方程式:
_______。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。
25℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为_______(已知:
Ksp(MnS)=5.0×10-14,H2S的电离常数:
Ka1=1.5×10-7,Ka2=6.0×10-15,lg6=0.8)。
参考答案
1.D
【解析】
【详解】
A.由图中信息可知,电子由M极流向N极,则M为电池负极,CH3COOH被氧化,选项A错误;
B.根据负极电极反应式CH3COOH-8e-+2H2O=2CO2↑+8H+可知,外电路转移4mol电子时,标准状况下M极产生22.4LCO2(忽略CO2溶解),但题干中没有说明标准状况,选项B错误;
C.根据图中信息可知,N极消耗氢离子,反应一段时间后,氢离子浓度降低,N极附近pH增大,选项C错误;
D.强氧化剂能使蛋白质变性,故Cr2O72-离子浓度较大时,可能会造成还原菌失活,选项D正确;
答案选D。
2.A
【解析】
【分析】
【详解】
①一般情况下活泼金属作负极,即锌为负极,而原电池中电流是从正极经外电路流向负极的,①错误;
②铜为正极,
在正极上得电子变成氢气,②正确;
③锌作为负极材料被消耗,质量减少,③正确;
④锌作负极,铜作正极,④错误;
⑤正极首先发生还原反应而不是氧化反应,其次是
得电子变成氢气,⑤错误;
⑥原电池工作时,阳离子向正极移动,阴离子向负极移动,⑥正确;
②③⑥正确,答案选A。
【点睛】
绝大多数情况下,活泼的金属作电源负极,但如果是镁、铝、氢氧化钠溶液组成的原电池,因镁不具有两性而铝具有两性,则是铝失电子作阴极。
3.D
【解析】
【分析】
铅蓄电池放电时总反应为:
Pb+PbO2+2H2SO4=2PbSO4+2H2O,Pb单质中Pb化合价升高,失电子,被氧化,Pb作负极,PbO2中Pb化合价降低,得电子,被还原,PbO2作正极。
【详解】
A.由上面分析可知,Pb作负极,被氧化,A错误;
B.从总反应看,硫酸被消耗,酸性减弱,溶液的pH不断增大,B错误;
C.原电池电解液中,阴离子向负极移动,所以,SO42-向Pb极移动,C错误;
D.从总反应看,硫酸被消耗,酸性减弱,溶液的pH不断增大,D正确。
答案选D。
4.C
【解析】
【分析】
a的活动性比氢要强,b为碳棒,该装置能发生自发的氧化还原反应,构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,据此分析解答。
【详解】
A.该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子发生还原反应,碳棒上有气体放出,溶液中氢离子浓度减小,溶液的pH增大,故A正确;
B.该装置是原电池,有电流产生,电子从负极a沿导线流向正极b,故B正确;
C.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故C错误;
D.a作负极,负极上金属失电子发生氧化反应,故D正确;
答案选C。
5.C
【解析】
【详解】
试题分析:
硅、铁、NaOH溶液组成原电池时,由于Si能自发地和NaOH溶液发生氧化还原反应,所以Si为负极,电极反应式为:
Si-4e-+6OH-=SiO32—+3H2O;铁为正极,电极反应式为:
4H2O+4e-=4OH-+2H2↑,总反应:
Si+2NaOH+H2O=Na2SiO3+2H2↑,据此判断选C。
6.D
【解析】
试题分析:
原电池的本质是氧化还原反应,所以电极上进行的氧化还原反应中会有电子的转移,从而形成电流,答案选D。
考点:
考查原电池的有关判断
点评:
该题是基础性试题的考查,学生只需要记住即可。
该题有利于培养学生良好的学习习惯,有利于调动学生的学习兴趣。
7.D
【解析】
【分析】
【详解】
A.绿色植物可以通过光合作用将太阳能转化为化学能储存起来,供植物生长,正确,A不符合题意;
B.煤燃烧时,放出大量的热且发光,在此过程中将化学能转化为热能和光能,正确,B不符合题意;
C.原电池工作时,将化学能转化为电能,正确,C不符合题意;
D.白炽灯工作时,电能并没有全部转化为光能,而是大部分电能转化为光能,还有一部分电能转化为热能,错误,D符合题意。
答案选D。
8.C
【解析】
【分析】
根据金属的活泼性知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极。
【详解】
A.Zn失电子作电池负极,A错误;
B.Cu电极上H+得电子,无Cu2+生成,B错误;
C.Zn失电子生成Zn2+,Zn逐渐溶解,质量会逐渐减小,C正确;
D.Zn电极失去的电子经导线流向Cu电极,D错误。
答案选C。
9.B
【解析】
【分析】
该装置为原电池,锌为活泼金属,易失电子而作负极,铜为不活泼金属作正极,正极上氢离子得电子发生还原反应,电子从负极沿外电路流向正极。
【详解】
A项、原电池工作时,铜作正极,正极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故A错误;
B项、锌为活泼金属,易失电子而作负极,故B正确;
C项、外电路中电子从负极锌沿导线流向正极铜,故C错误;
D项、该装置是将化学能转化为电能的装置,为原电池,故D错误。
故选B。
【点睛】
本题考查原电池的工作原理,根据原电池概念、电子流向、正负极的判断方法、电极反应式等知识点来分析是解答关键,注意原电池的电极反应式中电极材料不一定参与反应。
10.A
【解析】
【分析】
【详解】
根据反应
,可知该原电池中Fe为负极,正极选用比铁不活泼的金属或者碳棒;反应过程中
在正极得电子生成
,故正极区
的浓度降低,正极如碳棒周围溶液黄色变浅;由电池反应可知电解液为含
的溶液。
综上所述,A项正确。
故选A.
【点睛】
将一过程设计成原电池,方法和步骤如下:
(1)将此过程分解成氧化反应和还原反应两部分,总反应与该过程相同。
(2)将氧化反应部分作为负极,还原反应部分作为正极,从左到右写出电池表示式。
对于气体电极,电极材料应是惰性的,如Pt等。
11.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应BC0.650.0425mol/(L·min)0.96SO2+2H2O-2e-=SO42-+4H+增大6.2
【解析】
【分析】
【详解】
(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,③H2O(g)═H2O(l)△H=-44.0kJ•mol-1,根据盖斯定律,将
×(①+②+③×4)得:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=
×[(-574kJ•mol-1)+(-1160kJ•mol-1)+(-44.0kJ•mol-1)×4]=-955kJ•mol-1,故答案为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1;
(2)①反应Ⅰ:
NO(g)+O3(g)
NO2(g)+O2(g)△H1=-200.9kJ•mol-1Ea1=3.2kJ•mol-1
反应Ⅱ:
SO2(g)+O3(g)
SO3(g)+O2(g)△H2=-241.6kJ•mol-1Ea2=58kJ•mol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图中曲线属于描点法所得图像,P点不一定为图像的最高点,即不一定为平衡状态点,可能是建立平衡过程中的一点,故A错误;B.根据图像,温度高于200℃后,2O3(g)
3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g)
3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:
NO(g)+O3(g)
NO2(g)+O2(g)和反应Ⅱ:
SO2(g)+O3(g)
SO3(g)+O2(g)平衡正向移动,NO和SO2的转化率提高,故C正确;故选BC;
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
③反应Ⅰ:
NO(g)+O3(g)
NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:
SO2(g)+O3(g)
SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g)
3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol,则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol;NO的平均反应速率=
=0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=
=0.96,故答案为0.65;0.0425mol/(L·min);0.96;
(3)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:
SO2+2H2O-2e-═SO42-+4H+,故答案为SO2+2H2O-2e-═SO42-+4H+;
②负极反应式为:
SO2+2H2O-2e-═SO42-+4H+,正极反应式为O2+4e--+4H+==2H2O,当外电路通过0.2mol电子时,负极反应的二氧化硫为0.1mol,质量为6.4g,同时有0.2mol氢离子通过质子交换膜进入右侧,左侧溶液质量增大6.4g-0.2g=6.2g,故答案为增大;6.2。
【点睛】
本题综合考查了化学反应原理。
本题的易错点为(3),要注意根据原电池的总反应判断电极反应方程式的书写,②中要注意氢离子的移动对溶液质量的影响。
12.2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2)kJ·mol-1或2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=-2(E2-E1)kJ·mol-1或H2(g)+NO(g)=
N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或H2(g)+NO(g)=
N2(g)+H2O(g) ΔH=-(E2-E1)kJ·mol-1
<小于甲H2S+I3-=3I-+S↓+2H+5.2
【解析】
【分析】
(1)根据能量变化图,反应热=正反应的活化能-逆反应的活化能,再根据热化学反应方程式的书写解答;
(2)①2NO(g)⇌N2O2(g)①;②N2O2(g)+O2(g)⇌2NO2(g)②,根据盖斯定律,①+②得2NO(g)+O2(g)⇌2NO2(g),平衡常数K=
,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆;因为决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;
②根据应②为放热反应,温度升高平衡向着逆向移动分析;
(3)①原电池中阳离子移向正极;
②在乙池中,硫化氢失电子生成硫单质,碘单质得电子生成I-,据物质的变化确定发生的反应;
(4)当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合Ka1×Ka2=
=1.5×10-7×6.0×10-15=9.0×10-22计算出c(H+),然后可计算出溶液的pH。
【详解】
(1)正反应活化能为E3-E2,逆反应活化能为E3-E1;生成1mol水蒸气,该反应的反应热为ΔH=(E3-E2)-(E3-E1)=(E1-E2)kJ·mol-1,所以该反应的热化学方程式:
H2(g)+NO(g)=
N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或为2H2(g)+2NO(g)=N2(g)+2H2O(g)ΔH=2(E1-E2)kJ·mol-1;
(2)①Ⅰ:
2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2)ΔH1<0;
Ⅱ:
N2O2(g)+O2(g)⇌2NO2(g)(慢);v2正=k2正·c(N2O2)·c(O2);v2逆=k2逆·c2(NO2) ΔH2<0;由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正·c2(NO)×k2正·c(N2O2)·c(O2)=k1逆·c(N2O2)×k2逆·c2(NO2),则有K=
=
;因为决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应Ⅱ,所以反应Ⅰ的活化能EⅠ远小于反应Ⅱ的活化能EⅡ;
②k随温度升高而增大,则升高温度后k2正增大的倍数小于k2逆增大的倍数;
(3)①从示意图中看出,电子流向碳棒一极,该极为正极,氢离子从乙池移向甲池;
②乙池溶液中,硫化氢与I3-发生氧化还原反应:
硫化氢失电子变为硫单质,I3-得电子变为I-,离子反应为H2S+I3-=3I-+S↓+2H+;
(4)25℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,c(S2-)=
=
=2.5×10-12mol·L-1,
=Ka1×Ka2,c(H+)=
=
=6×10-6mol·L-1,pH=5.2。
【点睛】
难溶电解质溶解平衡时的计算中关于计算氢离子浓度时,需要利用溶度积进行计算。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 复习 知识点 原电池 原理 理解
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 #2机组现场施工用电布置措施.docx
#2机组现场施工用电布置措施.docx
