 第二节常见的酸与碱.docx
第二节常见的酸与碱.docx
- 文档编号:27351984
- 上传时间:2023-06-29
- 格式:DOCX
- 页数:22
- 大小:25.38KB
第二节常见的酸与碱.docx
《第二节常见的酸与碱.docx》由会员分享,可在线阅读,更多相关《第二节常见的酸与碱.docx(22页珍藏版)》请在冰豆网上搜索。
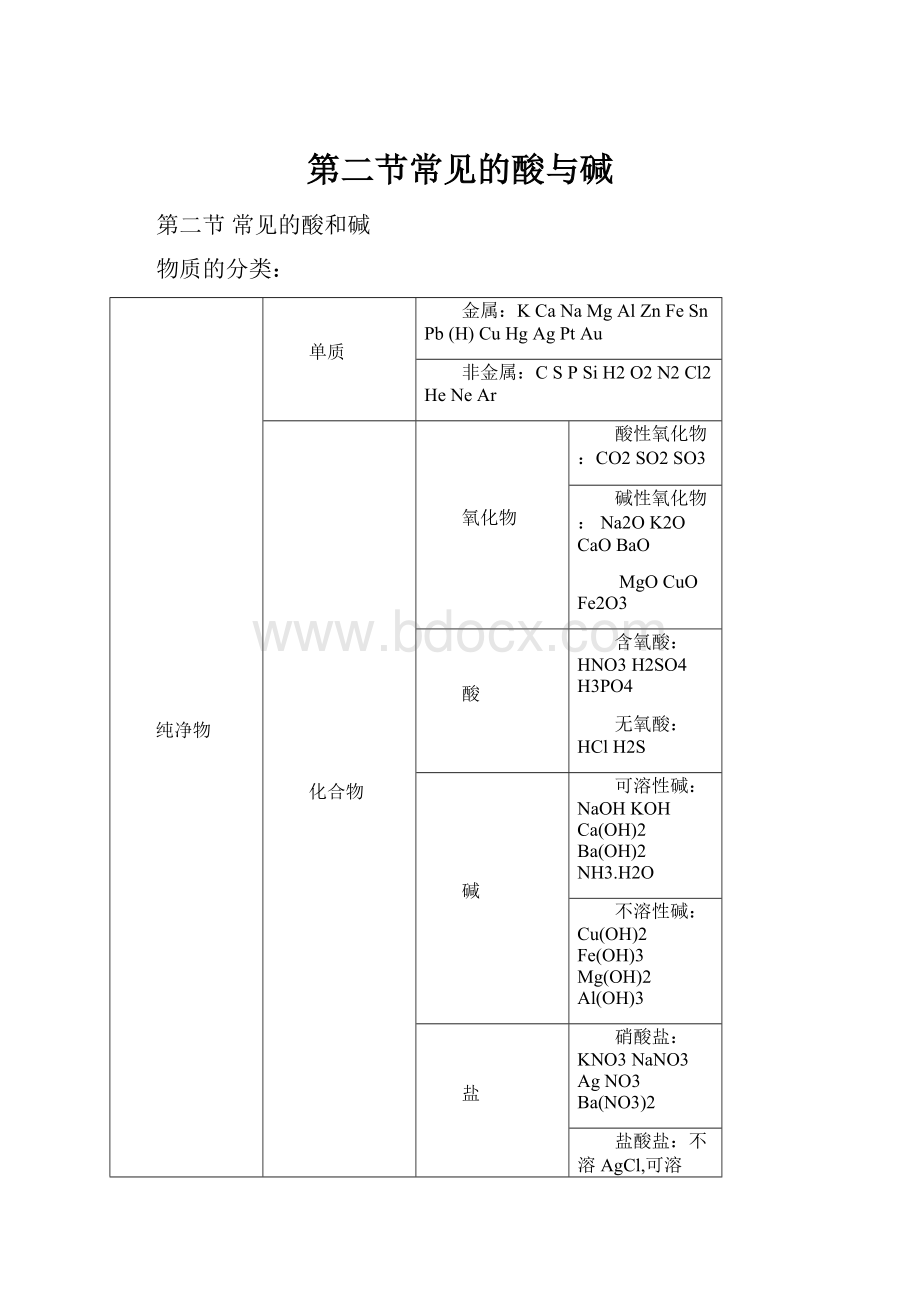
第二节常见的酸与碱
第二节常见的酸和碱
物质的分类:
纯净物
单质
金属:
KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu
非金属:
CSPSiH2O2N2Cl2HeNeAr
化合物
氧化物
酸性氧化物:
CO2SO2SO3
碱性氧化物:
Na2OK2OCaOBaO
MgOCuOFe2O3
酸
含氧酸:
HNO3H2SO4H3PO4
无氧酸:
HClH2S
碱
可溶性碱:
NaOHKOHCa(OH)2Ba(OH)2NH3.H2O
不溶性碱:
Cu(OH)2Fe(OH)3Mg(OH)2Al(OH)3
盐
硝酸盐:
KNO3NaNO3AgNO3Ba(NO3)2
盐酸盐:
不溶AgCl,可溶NaClKClMgCl2CaCl2BaCl2FeCl2FeCl3
硫酸盐:
不溶BaSO4,可溶Na2SO4K2SO4MgSO4ZnSO4(NH4)2SO4
碳酸盐:
可溶Na2CO3、K2CO3、(NH4)2CO3,
不溶CaCO3BaCO3Ag2CO3MgCO3
铵盐:
NH4ClNH4NO3(NH4)2SO4
电离方程式:
1、溶液能导电的原因:
在水溶液中有自由移动的离子存在。
2、电离:
物质溶于水,离解成自由移动的离子的过程。
3、在溶液中所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等。
如溶液中含aFe2+、bFe3+、cSO42—,则2a+3b=2c
酸、碱、盐的概念及酸碱盐的溶解性
1、在酸、碱、盐溶液中,由于电离,以离子的形式存在
酸:
电离时生成的阳离子全部是H+的化合物,如HCl、HNO3、H2SO4、H3PO4
由H+与酸根离子组成:
HnR=nH++Rn-
碱:
电离时生成的阳离子全部是OH-的化合物,如NaOH、KOH、Ba(OH)2、Ca(OH)2
由金属离子与OH—组成:
R(OH)n=Rn++nOH—
盐:
电离时生成金属离子与酸根离子的化合物,如NaCl、Na2CO3、AgNO3、CuSO4
2、酸碱盐的溶解性:
可溶性碱:
KOHNaOHCa(OH)2Ba(OH)2NH3.H2O
可溶性盐:
所有的硝酸盐、钾盐、钠盐、铵盐都易溶,盐酸盐(除AgCl外)硫酸盐(除BaSO4外)也可溶
不溶于水,但溶于酸的沉淀:
不溶性碱Cu(OH)2,Fe(OH)3,Mg(OH)2,Al(OH)3
不溶性碳酸盐CaCO3,BaCO3,MgCO3,
既不溶于水,也不溶于酸的沉淀:
AgCl、BaSO4
酸、碱、盐溶液的导电性
小结:
NaCl固体(不导电)NaCl溶液(导电)
KNO3固体(不导电)KNO3溶液(导电)
NaOH固体(不导电)NaOH溶液(导电)
蔗糖固体(不导电)蔗糖溶液(不导电)
酒精(不导电)酒精溶液(不导电)
蒸馏水(不导电)
设问:
为什么有的物质(如NaCl固体)本身不导电,而它的水溶液能导电呢?
而有的物质(如蔗糖固体)本身不导电,把它配成水溶液还是不导电?
在水分子作用下
分析:
NaCl固体Na++Cl-
(离子不能自由移动)(离子能自由移动)
不导电导电
小结:
要点:
有些物质的水溶液能导电的原因是在水溶液中有自由移支的离子存在。
讲解:
物质溶于水时,离解成自由移动离了的过程叫电离。
(引出电离的概念)
分析:
电离是在溶于水的条件下发生的,与通电与否无关,电离可用电离方程式表示。
书写方法如下:
(1)正确写出该物质的化学式
(2)离解通常发生在正价元素(或原子团)和负价元素(或原子团)之间的联接处。
(3)阴、阳离子所带电荷数与该元素或原子团的化合价相同,但写法不同。
例:
NaCl=Na++Cl-
KNO3=K++NO3-
NaOH=Na++OH-
(NH4)2SO4=2NH4++SO42-
(4)根据阳离子所带电荷总数与阴离子所带电荷总数一定相等来检查电离方程式正误。
1.酸
小结:
盐酸、硫酸、硝酸的水溶液都能导电,依照它们在水溶液中存在自由移动的离子提问:
这三种物质的电离产物有何共同特点?
分析:
从而得出酸的定义。
强调“全部是H+”介绍酸根的概念和酸的电离通式:
HnR=nH++Rn-
小结:
酸根离子所带负电荷总数等于酸分子电离子时生成的氢离子总数
2.碱
小结:
KOH、Ba(OH)2的溶液能导电,依照它们的水溶液中存在自由移动的离子
提问:
这几种物质的电离产物有何共同特点?
分析:
从而得出碱的定义,强调“全部是OH-”
介绍碱的电离通式:
M(OH)m=Mm++mOH-
小结:
在碱里,跟一个金属离子结合的氢氧根离子数目,等于这种金属所带的正电荷数目。
3.盐
小结:
Na2CO3、MgSO4、BaCl2等物质的水溶液都能导电,说明它们的水溶液中存在着自由移动的离子。
分析:
电离产物的特点,得出盐的定义
小结:
(1)酸、碱、盐的定义及组成特点
(2)物质的分类
一、常见的酸
(一)常见的酸——盐酸
知识目标:
1.掌握盐酸的化学性质及有关方程式的书写,了解它的用途。
2.了解石蕊,酚酞两种指示剂在酸碱溶液中的颜色。
3.理解复分解反应的概念。
教学重点:
1.盐酸的化学性质
2.指示剂在酸、碱溶液中的颜色变化
3.复分解反应的概念
教学难点:
有关盐酸化学性质的化学方程式的书写
教学过程:
盐酸、硫酸和硝酸是三种常见的生要的酸,在工业生产和科研中有重要用途,本节课来学习盐酸的性质和用途。
[讲授新课]
盐酸───氯化氢气体的水溶液
1.物理性质
(1)总结盐酸的物理性质,浓盐酸挥发出的氯化氢气体遇空气中的水蒸气形成的白雾。
(2)小结:
浓盐酸是无色,有刺激性气味和酸味的液体,具有挥发性和腐蚀性。
浓盐酸挥发出的氯化氢气体遇空气中的水蒸气形成白雾(盐酸小液滴)。
2.化学性质
(1)盐酸跟指示剂的作用
(2)盐酸跟某些金属的反应
①引导学生回忆实验室制氢气的反应
②小结:
盐酸+金属────→盐+水
Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑
(3)盐酸跟金属氧化物反应
(增加CuO+HCl的实验)
①演示[实验P187],现象:
铁锈溶解,溶液呈黄色
②小结:
盐酸+金属氧化物────→盐+水
6HCl+Fe2O3=2FeCl3+3H2O
2HCl+CuO=CuCl2+H2O
(4)盐酸跟碱的反应
(增:
NaOH+酚酞+HCl的实验)
小结:
盐酸+碱───→盐+水
2HCl+Cu2(OH)2=CuCl2+2H2O,
HCl+NaOH=NaCl+H2O
(5)盐酸跟某些碱反应
(增:
NaCl+AgNO3的实验)
小结:
盐酸+某些盐───→新酸+新盐
HCl+AgNO3=HNO3+AgCl↓NaCl+AgNO3=NaNO3+AgCl↓
③讨论:
HCl和NaCl的水溶液中有无相同的离子?
④小结:
Cl-的检验方法:
取示知溶液,滴加AgNO3和稀HNO3,若有白色沉淀产生,则证明原溶液中含有Cl-
(1)跟指示剂作用:
酸性中性碱性
石蕊红色紫色蓝色
酚酞无无红色
(2)盐酸+金属───→盐+H2:
2HCl+Zn+ZnCl2+H2↑;2HCl+Fe=FeCl2+H2↑
(3)盐酸+金属氧化物──→盐+H2O
6HCl+Fe2O3=2FeCl3+3H2O;2HCl+CuO=CuCl2+H2O
(4)盐酸+碱───→盐+H2
2HCl+Cu(OH)2=CuCl2+2H2O;HCl+NaOH=NaCl+H2O
(5)盐酸+某些盐──→新酸+新盐
HCl+AgNO3=HNO3+AgCl↓;NaCl+AgNO3=NaNO3+AgCl↓
此反应可用于检验溶液中是否含有Cl-
3.复分解反应
①复习复分解反应的概念和表达方法
②比较四种化学反应基本类型的不同之处
4.盐酸的用途
[总结]①盐酸的物理性质
②指示剂及其遇酸碱的变色情况
③盐酸的化学性质
④复分解反应的概念
(二)常见的酸——硫酸
知识目标:
1.掌握稀H2SO4的物理性质,了解浓H2SO4和HNO3的性质及浓H2SO4的稀释方法。
2.掌握稀H2SO4的化学性质,能准确描述典型反应的实验现象和准确书写相应的化学方程式,了解H2SO4的用途。
3.了解SO42-的检验方法。
教学重点:
硫酸的化学性质
教学难点:
1、有关硫酸化学性质方程式的书写
2、SO42-的检验
教学过程:
[复习提问]
1.浓HCl的物理性质,稀HCl的化学性质。
2.酸碱指示剂及其在酸碱溶液中的颜色。
3.Cl-的检验方法。
[讲授新课]硫酸
1.物理性质
纯净的浓硫酸是无色、粘绸油状液体,不易挥发,有吸水性和脱水性,易溶于水,溶解时放出大量的热。
(强调稀释方法)
2.化学性质
①演示:
稀H2SO4与石蕊与酚酞的作用,得出:
稀H2SO4能使紫色石蕊浅液变红,不能使无色酚酞变色。
②演示实验得出:
硫酸+金属──→盐+H2↑;H2SO4+Zn=ZnSO4+H2↑
③演示及稀H2SO4+CuO,得出:
硫酸+金属氧化物────→盐+H2O
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
H2SO4+CuO=CuSO4+H2O
④演示及:
NaOH+酚酞+H2SO4,得出:
硫酸+碱───→盐+H2O
H2SO4+Cu(OH)2=CuSO4+2H2O
H2SO4+2NaOH=(Na)2SO4+2H2O
⑤演示及Na2SO4+BaCl2+稀HNO3,得出:
a.硫酸+盐───→新酸+新盐H2SO4+BaCl2=2HCl+BaSO4↑
讨论:
H2SO4及Na2SO4溶液中是否含有相同的离子?
得出SO42-的检验方法
b.小结
3.用途:
阅读浓硫酸的特性,P188拓展视野。
4.硝酸和磷酸:
硝酸的物理性质及氧化性。
[总结]⑴浓H2SO4的物理性质
⑵稀H2SO4的化学性质
⑶SO42-的检验方法
(三)酸的通性
知识目标:
1.了解酸的分类方法和命名。
2.了解酸的通性,能熟练书写一些典型反应的化学方程式。
3.了解并记住金属活动顺序表,并能用它来判断金属能否与酸发生置换反应。
教学重点:
酸的通性及方程式的书写。
教学难点:
金属活动顺序表的应用。
教学过程:
[复习提问]什么叫酸,写出已学过的酸的化学式。
酸的分类和命名:
引学生阅读课文,相应内容,讨论下列问题:
1.酸有几种分类方法?
根据是什么?
2.酸是如何命名的?
3.硫酸和氢硫酸是不是同一种酸?
为什么?
练习:
说出下列各种酸所属类别和名称:
HF、HBr、HCl、HClO3、H3BO3
酸的通性:
石蕊:
变红
提问:
酸为什么会具有相似的化学性质呢?
请写出HCl、H2SO4、HNO3的电离方程式,并找出它们电离产物的共同点。
小结:
酸的水溶液中都存在相同的阳离子──H+,故它们有相似的化学性质,我们称之为酸的通性。
总结出酸的通性:
酸的通性
(1)
石蕊───→:
紫──→红
+指示剂
酞酚───→:
无现象
+活泼金属────→盐+H2
酸+碱性氧化物+盐+H2O
+碱───→盐─→H2(中和反应及其应用)
+某些盐─→新酸+新盐
1.紫色石蕊试液遇酸变红色,无色酚酞遇酸不变色
2.活泼金属+酸→盐+H2
提问:
为何要强调“活泼”二字?
是否有些金属不能与酸反应生成氢气?
结论:
铜及银跟酸不反应。
小结:
并非所有的金属都能跟酸反应生成盐和氢气,金属能否与酸反应与金属本身的活动性有关。
金属活动性顺序:
KCaNaMgAl,ZnFeSnPb(H),CuHgAgPtAu
失电子能力强─────→弱
活动性强─────→弱
讲解:
①金属跟酸反应的条件:
只有排在氢前面的金属才能置换出酸中的氢。
②硝酸及浓硫酸跟金属反应一般不生成H2而生成H2O(它们有很强的氧化性)
3.金属氧化物+酸──→盐+H2O
讲解:
①碱性氧化物的定义
②大多数金属氧化物是碱性氧化物,常见的如Fe2O3CuOCaOK2ONa2O等
4.碱+酸──→盐+H2O
提问:
(1)中和反应的定义
(2)中和反应在工农业生产上的应用
讨论:
中和反应属何种基本反应类型?
生成盐和水的反应都是中和反应吗?
举例说明。
5.盐+酸──→新盐+新酸
(1)写出①CaCO3+HCl②AgNO3+HCl③BaCl2+H2SO4的反应方程式
(2)讲解:
方程式①可用于检验CO32-②可用于检验Cl-③可用于检验SO42-
酸的通性
(2)
知识目标:
了解PH是溶液酸碱度的表示方法,会用PH试纸测定溶液的PH,了解PH对生产的意义。
复习提问:
1、如何测定溶液的酸碱性?
2、酸有哪些通性?
分别以HCl、H2SO4为例说明
3、熟记金属活动性顺序及简单应用
[导入新课]:
利用酸碱指示剂的颜色变化,只能确认溶液到底是酸性、碱性,还是中性,但是如果两种溶液都是酸溶液或碱溶液,指示剂就不能告诉我们两种酸溶液或碱溶液的酸碱性强弱程度了。
为此,我们今天学习溶液酸碱度的表示方法。
[讲授新课]:
PH-溶液酸碱度的表示方法
1.PH的范围:
0-14
2.PH与酸碱性的关系:
0──────7─────14
←─────中性──────→
酸性增强碱性增强
即PH=7时,溶液呈中性,PH<7时,溶液呈酸性,PH>7时,溶液呈碱性。
3.PH的测定
总结出测定PH的方法(将待测试液滴在PH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便知溶液的PH)
①现象:
在不同酸碱度的溶液中,PH试纸会显示不同的颜色。
②结论:
由PH试纸的颜色变化结果,可知溶液的酸碱度-PH
讨论题:
(1)溶液的酸碱性和酸碱度分别如何测定?
能否用指示剂测定溶液的酸碱度?
能否用PH试纸测定溶液的酸碱性?
(2)能否将试纸先用蒸馏水湿润,然后再测试?
(3)能否将PH试纸浸入溶液中测定?
为什么?
4、了解溶液酸碱度的实际意义:
①化工生产中,许多反应必须在一定酸碱度的溶液中进行。
②农业生产中:
作物的生长须在接近中性的土壤,PH大于8或小于4.5时,一般作物将难以生长。
③测定空气的污染情况
④了解人体的健康情况
1.了解溶液酸碱度的意义
二、常见的碱
常见的碱、碱的通性
(1)
知识目标:
1.了解NaOH的物理性质,俗称用途和使用注意事项。
2.掌握NaOH的化学性质,能正确书写有关反应的化学方程式。
3.了解酸性氧化物的概念。
教学重点、难点:
NaOH的化学性质及有关化学方程式的书写
补充:
NaOH与CO2的反应
教学过程:
[复习提问]
1.什么叫碱?
2.在我们接触过的物质中,有一种物质叫氢氧化钠,它能跟什么物质起反应?
写出化学方程式。
[学习新课]:
学习几种常见的重要的碱。
氢氧化钠就是一种常见的、重要的碱。
氢氧化钠
1.物理性质
(1)引导学生分析、总结NaOH的物理性质及俗称。
2.化学性质
(1)通过复习酸碱指示剂的变色情况及阅读NaOH使指示剂的变色情况,得出NaOH能使指示剂变色的结论。
(2)NaOH与CO2等非金属氧化物反应:
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
(3)NaOH+酚酞+H2SO4(HCl),得出NaOH与酸反应
2NaOH+H2SO4=Na2SO4+2H2ONaOH+HCl=NaCl+H2O
(4)NaOH与盐的反应:
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(蓝色)
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
(红褐色)
小结:
氢氧化钠跟盐类(含钠、钾或铵的盐除外)起反应,一般生成不溶于水的碱。
3.酸性氧化物的概念:
(1)凡是能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物,如CO2、SO2、SO3等。
(2)非金属氧化物大多数是酸性氧化物
(3)酸性氧化物大多数能溶于水,跟水化合生成酸,如:
H2O+CO2=H2CO3H2O+SO2=H2SO3H2O+SO3=H2SO4
4.NaOH的用途
总结:
①NaOH的物理性质、化学性质
②有关化学方程式的书写技巧
③NaOH的用途
④酸性氧化物的概念及特点
常见的碱、碱的通性
(2)
1.了解Ca(OH)2、NaOH的制法,物理性质及主要用途。
2.掌握Ca(OH)2的化学性质,掌握鉴别NaOH和Ca(OH)2的方法。
3.了解碱的分类和命名及通性。
教学重难点:
有关化学方程式的书写
[复习提问]
1.NaOH有哪些物理性质和化学性质?
2.分别写出下列物质与NaOH反应的方程式:
CO2、SO2、SO3、HCl、H2SO4、CuSO4、FeCl3
[讲授新课]
氢氧化钙
1.制法:
由学生说出实验现象并写出化学方程式
CaO+H2O=Ca(OH)2(俗称熟石灰或消石灰)
2.物理性质
氢氧化钙是白色粉末状固体,微溶于水,它的不溶液俗称石灰水,氢氧化钙对皮肤、衣服等有腐蚀作用。
3.化学性质
(1)使指示剂变色:
能使紫色石蕊试液变蓝,使无色酚酞试液变红。
(2)跟酸性氧化物反应生成盐和水
回忆CO2通入澄清石灰水的现象并写出化学方程式
Ca(OH)2+CO2=CaCO3↓+H2O
(3)跟酸起中和反应
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
4.用途
(1)建筑材料
(2)制造NaOH,漂白粉(3)改良酸性土壤
(4)配制农药波尔多液[CuSO4+Ca(OH)2]石硫合剂[Ca(OH)2+S]
三、碱的命名:
由学生总结出碱的命名的一般方法。
四、碱的通性
指导学生复习碱的概念及NaOH、Ca(OH)2相似的化学性质,总结得出碱的通性。
总结:
1.Ca(OH)2的制法、性质和用途。
2.碱的命名
3.碱的通性
阅读:
P190烧碱与蛋白质、油脂的作用
两种化合物相互交换成分,生成两种新的化合物,这类反应称为复分解反应。
第三节酸和碱的反应
一、中和反应
定义:
酸与碱反应的结果是酸和碱各自的特性都消失,生成了盐和水,这一反应称为中和反应。
反应实质:
酸+碱→盐+水
二、盐
知识目标:
1.了解食盐、纯碱、胆矾的化学成分、化学式学名及色、态特性和用途。
2.了解结晶水、结晶水合物,介绍风化、潮解概念。
3.掌握结晶水合物相对分子质量的计算,理解结晶水合物属于化合物。
教学重点:
NaCl、Na2CO3及CuSO4的有关知识,CO32-的检验。
教学难点:
结晶水合物是化合物的理解及相对分子质量计算。
教学过程:
[复习提问]
1.什么叫盐?
2.尽可能多的列举我们知道的盐的化学式。
[引入新课]:
盐是无机化合物中种类最多、用途最广的一类物质,本节课我们主要学习食盐、纯碱、胆矾等几种重要的盐,了解结晶水合物的概念,掌握结晶水合物的相对分子质量的计算方法及CO32-检验方法。
[讲授新课]
几种常见的盐:
1.氯化钠
(1)介绍氯化的化学式及俗称(食盐)
(2)引导学生结合生活经验、溶液的有关知识及阅读的有关内容,了解食盐的重要用途、NaCl在自然界的分布及海水晒盐的一般原理,搞清“盐”与“食盐”的关系。
2.碳酸钠
(1)介绍碳酸钠的化学式名称(纯碱)
(2)指导学生阅读书籍及注释,了解纯碱的水溶液为什么显碱性。
(3)介绍结晶水合物的概念及结晶水合物相对分子质量的计算方法
例:
求FeSO4·7H2O的相对分子质量
(4)常识性介绍风化和潮解的概念。
(5)共同总结出CO32-的检验方法。
(6)介绍纯碱在自然界里的存在及重要用途。
(7)介绍侯德榜对制碱工业的贡献。
3.硫酸铜
(1)介绍硫酸铜的简单知识及胆矾的化学式
(2)介绍实验
得出:
CuSO4·5H2O──→CuSO4+5H2O
蓝色白色
介绍白色的无水硫酸铜可用于检验气体或液体中是否含有水份。
例如:
①检验“无水”酒精中是否含水②检验某气体混合中是否含水蒸气等。
总结:
1、NaCl、Na2CO3、CuSO4的化学名称,俗称及主要用途。
2、结晶水合物的概念及有关相对分子质量的计算。
3、CO32-的检验方法
三、知识目标:
1、通过复习金属活动性顺序及酸和碱的有关性质,得出盐的化学性质。
2、帮助学生理解并记忆部分酸碱和盐的溶解性表。
3、了解复分解反应发生的条件。
4、简介盐的分类和命名
教学重点:
1、金属与盐溶液之间的置换反应。
2、复分解反应发生的条件。
教学过程:
补充:
BaCl2+Na2SO4、NaCl+AgNO3
[复习提问]:
NaCl、Na2CO3、CuSO4各有哪些物理性质?
一、盐的性质
1.酸碱盐的溶解性
(1)(说明:
了解部分酸碱和盐的溶解性,对判断复分解反应能否发生有很大帮助。
)
(2)指导学生阅读附录Ⅲ,让学生在理解的基础上记忆下列口决:
钾、钠、铵盐水中溶,硝酸盐入水影无踪,盐酸盐除去银亚汞,硫酸钡铅水不溶。
2.盐的化学性质
(1)盐+金属→盐+金属
1复习金属活动性顺序,Fe与CuSO4的反应,
②结论:
活泼金属+盐(可溶)→新盐+不活泼金属
Zn+CuSO4=Cu+ZnSO4
Cu+Hg(NO3)2=Cu(NO3)2+Hg
③小结:
在金属活动性顺序里,只有排在前面的金属,才能把排在后面的金属从它们的盐溶液中置换出来(即参加反应的金属1、比反应生成的金属活泼,参加反应的盐须可溶于水)
(2)盐1+酸1→盐2+酸2
①复习盐酸与硝酸银,硫酸与氯化钡、实验室制CO2的反应
②结论:
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
CaCO3+2HCl=CaCl2↓+H2+CO2↑
③小结:
有“↓”或“↑”或水生成
(3)盐1+碱1→盐2+碱2
①复习氢氧化钠跟氯化铁、氢氧化钙跟碳酸钠、硫酸铜与氢氧化钠的反应
②结论:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
CuSO4+2NaOH=Cu(OH)2↓+Na2CO3
③小结:
盐1、碱1、须可溶,盐3、盐4至少有一个不溶
三、复分解反应发生的条件:
1.(练习)写出下列反应的化学方程式,并判断反应物类别及反应反属类型。
①NaOH+H2SO4=Cu(OH)2+HCl=
②CaCO3+HCl=Ba(NO3)2+H2SO4=
③FeCl3+Ba(OH)2=Ca(OH)2+Na2CO3=
④AgNO3+BaCl2=Ba(NO3)2+K2SO4=
2.通过以上练习总结复分解反应发生的条件:
两种物质(酸、碱或盐)在溶液中相互交换离子,生成物中如果有沉淀析出或有气体放出或有水生成,那么,复分解反应就可以发生,否则就不能发生。
以上练习中各反应均能发生,是因为有特殊生成物产生。
但象如NaCl+KNO3、NaOH+KNO3、NaOH+KNO3、HNO3+NaCl等,它们之间就不能发生复分解反应。
3.讨论:
在已学过的反应中,有哪些反应是可以生成盐类物质的?
举例说明:
(1)金属+酸─→盐+H2
(2)金
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 第二 常见
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《C12343098汽轮机操作规程》要点.docx
《C12343098汽轮机操作规程》要点.docx
