 配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习.docx
配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习.docx
- 文档编号:25403614
- 上传时间:2023-06-08
- 格式:DOCX
- 页数:30
- 大小:2.30MB
配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习.docx
《配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习.docx》由会员分享,可在线阅读,更多相关《配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习.docx(30页珍藏版)》请在冰豆网上搜索。
配套K12高考化学一轮复习酸碱中和滴定曲线大全专题05物质的量分数曲线练习
专题05物质的量分数曲线
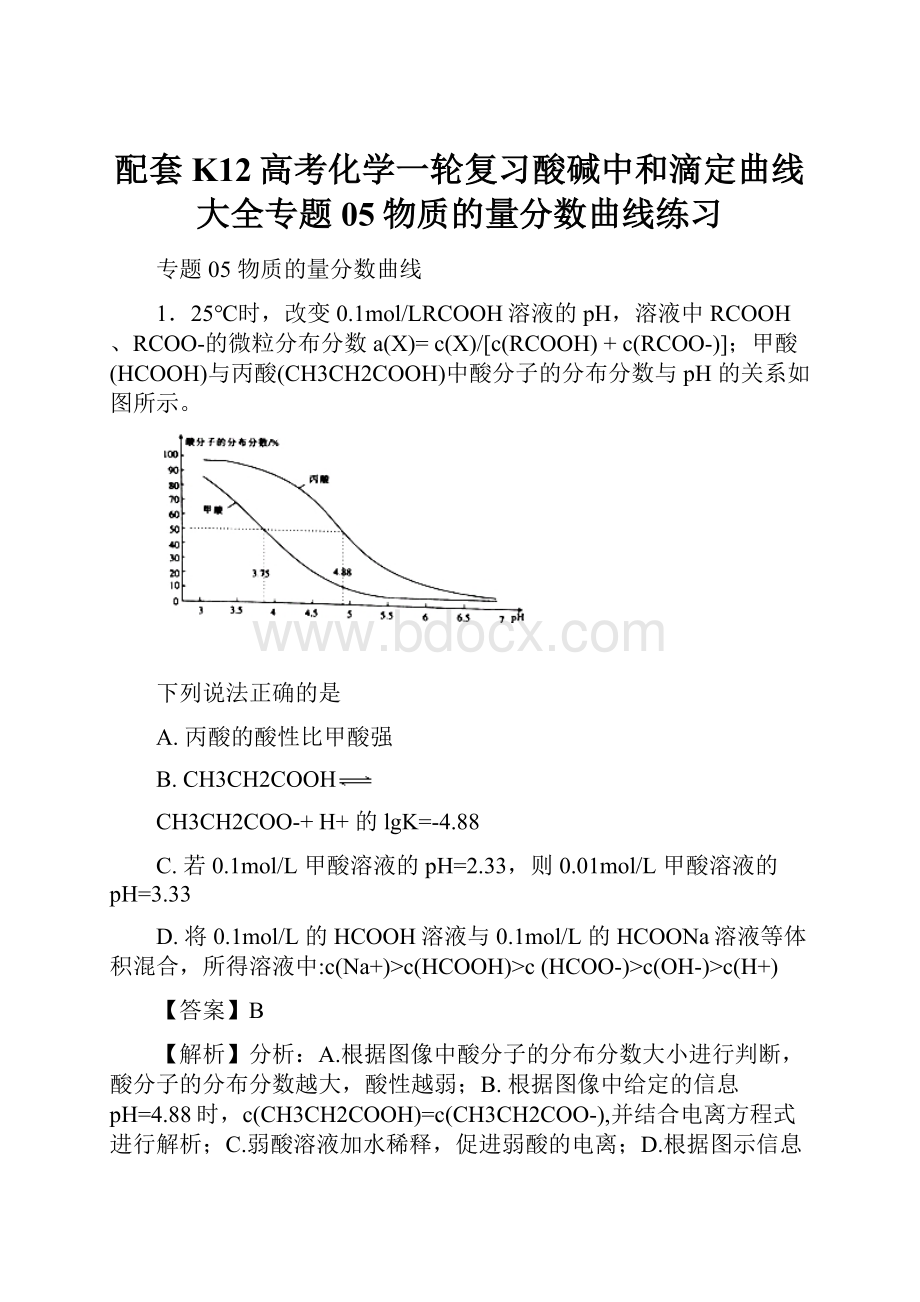
1.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)=c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
下列说法正确的是
A.丙酸的酸性比甲酸强
B.CH3CH2COOH
CH3CH2COO-+H+的lgK=-4.88
C.若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D.将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:
c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
【答案】B
【解析】分析:
A.根据图像中酸分子的分布分数大小进行判断,酸分子的分布分数越大,酸性越弱;B.根据图像中给定的信息pH=4.88时,c(CH3CH2COOH)=c(CH3CH2COO-),并结合电离方程式进行解析;C.弱酸溶液加水稀释,促进弱酸的电离;D.根据图示信息,甲酸的电离平衡常数10-3.75,电离大于水解过程,所以HCOOH与HCOONa(1:
1)的混合液显酸性。
据此解答问题。
2.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显碱性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
【答案】C
【解析】分析:
本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。
详解:
A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以Kb2=
,选项A正确。
B.X(OH)NO3水溶液中X的主要存在形式为X(OH)+,由图示X(OH)+占主导位置时,pH为7到8之间,溶液显碱性,选项B正确。
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)和c[X(OH)+]近似相等,根据图示此时溶液的pH约为6,所以溶液显酸性X2+的水解占主导,所以此时c(X2+)<c[X(OH)+],选项C错误。
D.在X(OH)NO3水溶液中,有电荷守恒:
c(NO3-)+c(OH-)=2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:
c(NO3-)=c(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶液的质子守恒式为:
c[X(OH)2]+c(OH-)=c(X2+)+c(H+)。
3.25℃时,在“H2A―HA-―A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法正确的是
A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大
B.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C.NaHA溶液中,HA-的水解能力小于HA-的电离能力
D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
【答案】C
【解析】A.根据图像,在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,溶液的酸性减弱,α(HA-)可能增大,可能减小,与原溶液的成分有关,故A错误;B.根据图像,将等物质的量的NaHA和Na2A混合物溶于水时,溶液的pH在4~5之间,溶液显酸性,以HA-电离为主,所得的溶液中α(HA-)<α(A2-),故B错误;C.NaHA溶液显酸性,以电离为主,可知其电离程度大于其水解程度,故C正确;D.在含H2A、HA-和A2-的溶液中,根据电荷守恒,有2c(A2-)+c(OH-)+c(HA-)=c(H+)+c(Na+),因为c(H2A)+2c(A2-)+c(OH-)=c(H+),则2c(A2-)+c(OH-)+c(HA-)=c(H+)+c(Na+)=c(H2A)+2c(A2-)+c(OH-)+c(Na+),因此c(HA-)=c(H2A)+c(Na+),故D错误;故选C。
4.常温下,HA为一元弱酸。
已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。
向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液xmL。
下列不正确的是
A.常温下,HA的电离平衡常数Ka=10-9B.x=0时,1 C.x=5时,C(A-)=c(HA)D.x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L 【答案】C 【解析】A.当pH值为9时,溶液中c(H+)=1×10-9mol/L,由c(HA)=c(A-)得,Ka=10-9,A正确;B.HA为弱酸,当不添加NaOH时,溶液呈酸性,且不完全电离,c(H+)<0.1mol/L,B正确;C.当x=5时,不能将电离出的H+完全中和,溶液呈酸性,C(A-)与c(HA)不相等,C错误;D.x=10时,溶液体积为20mL,则此时c(A-)+c(HA)= =0.05mol/L,c(Na+) =0.05mol/L,D正确。 故选择C。 5.已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。 某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是() A.在pH=4.3的溶液中: 3c(R2-)=c(Na+)+c(H+)-c(OH-) B.等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小 C.等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3 D.向Na2CO3溶液中加入少量H2R溶液,发生反应: 2CO32-+H2R=2HCO3-+R2- 【答案】C 6.常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。 已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。 下列说法正确的是 A.当pH=9时,溶液中存在下列关系: c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-) B.NH4HCO3溶液中存在下列关系: <1 C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小 D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7 【答案】B 【解析】分析: A项,由NH3·H2O的分布分数的变化分析NH4+的分布分数的变化,再结合图像判断当pH=9时,溶液中各离子浓度大小;B项,根据碳酸氢铵溶液pH=7.8,判断NH4+与HCO3-的大小关系,结合物料守恒解决该项;C项,结合图像判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;D项,利用图像中的特殊点(如pH=6.5时)对应的离子浓度,计算水解平衡常数Kh(HCO3-)。 7.25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是 A.在c点溶液中: c(Na+)=c(AuCl4-) B.a点对应溶液pH约为5 C.25℃时,HAuCl4的电离常数为1×10-3 D.d点时,溶液中离子浓度大小关系为: c(Na+)>c(AuCl4-)>c(OH-)>c(H+) 【答案】C 【解析】c点溶液中,pH=7,c(OH-)=c(H+),根据电荷守恒可知: c(Na+)=c(AuCl4-),A正确;根据Ka=c(H+)×c(AuCl4-)/c(HAuCl4)=10-3×10-3/(0.1-10-3)≈10-5,由于a点时,c(AuCl4-)=c(HAuCl4),所以c(H+)≈10-5mol/L,pH≈5,B正确;0.1mol/LHAuCl4溶液pH=3,根据HAuCl4=H++AuCl4-可知,该反应的电离常数为Ka=c(H+)×c(AuCl4-)/c(HAuCl4)=10-3×10-3/(0.1-10-3)=10-5,C错误;d点时,溶液溶质为NaAuCl4,溶液显碱性,所以溶液中离子浓度大小关系为: c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确;正确选项C。 8.常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是 A.表示NH3·H2O物质的量分数变化的曲线是B B.pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度 C.常温下,NH3·H2O的电离常数为1.8×10-5mol/L(已知lg1.8=0.26) D.当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L 【答案】C 【解析】NH3·H2O与HCl能够发生反应: NH3·H2O+HCl=NH4Cl+H2O,随着HCl的滴入,NH3·H2O浓度逐渐减小,NH4+的浓度逐渐增大,所以曲线B表示的是NH4+,不是NH3·H2O的物质的量分数,A选项错误;pH=9.26时,溶液呈碱性,说明NH3·H2O的电离程度大于NH4+离子的水解程度,B选项错误;NH3·H2O NH4++OH-,K=[C(NH4+)×C(OH-)]/C(NH3·H2O),根据图示得: 当PH=9.26时,溶液中NH3·H2O和NH4+的物质的量分数相同,即浓度相同,所以K=C(OH-)=Kw/C(H+)=1×10-14/10-9.26=10-4.74=1.8×10-5,C选项正确;当加入盐酸体积为50mL时,C(Cl-)=1/15mol·L-1,C(NH3·H2O)+C(NH4+)=2/15mol•L-1,所以有: 2C(Cl-)=C(NH3·H2O)+C(NH4+),根据电荷守恒: 2C(H+)+2C(NH4+)=2C(Cl-)+2C(OH-),所以c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol/L,D选项错误,正确答案是C。 9.已知草酸为二元弱酸,在25℃时,草酸的两步电离常数为: Ka1=5.0×10-2,Ka2=m。 实验测得在该温度下改变0.1mol·L-1的H2C2O4溶液的pH值时,溶液中主要微粒的物质的量分数δ(X)随pH值的变化如图所示[已知: ①δ(H2C2O4)= ②1g5=0.7;③图中b点对应的pH值为2.7]。 则下列说法不正确的是() A.在a点,溶液对应的pH值为1.3B.pH=2.8时,c(HC2O4-)>c(C2O42-)+c(H2C2O4) C.pH=4.2时,c(HC2O4-)=c(C2O42-)=c(H+)D.lgKa2=-4.2 【答案】C 【解析】A.在a点时,c(HC2O4-)=c(H2C2O4),Ka1=5.0×10-2= =c(H+),溶液对应的pH=-lgc(H+)=-lg5.0×10-2=1.3,故A正确;B.根据图像,pH=2.8时,溶质主要为HC2O4-,c(HC2O4-)>c(C2O42-)+c(H2C2O4),故B正确;C.pH=4.2时,c(HC2O4-)=c(C2O42-)=0.05mol·L-1,此时c(H+)=10-4.2mol·L-1,c(HC2O4-)=c(C2O42-)>c(H+),故C错误;D.pH=4.2时,c(HC2O4-)=c(C2O42-),则lgKa2=lg =lgc(H+)=-4.2,故D正确;故选C。 10.25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= ;甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与PH的关系如图所示。 下列说法正确的是 A.丙酸的酸性比甲酸强 B.若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33 C.CH3CH2COOH CH3CH2COO-+H+的lgK=-4.88 D.将0.1mol/L的HCOOH溶液与0.lmol/L的HCOONa溶液等体积混合,所得溶液中: c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+) 【答案】C 11.20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。 含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。 下列说法正确的是 A.①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线 B.Q点对应的溶液中lgc(H+) C.20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2 D.0.100mol/L的NaHC2O4溶液中: c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4) 【答案】D 【解析】A、随着溶液pH增大,溶液H2C2O4、HC2O4-先后被反应,越来越少,而C2O42-则越来越多,因此曲线①代表的是HC2O4-,②代表的是H2C2O4,③代表C2O42-,故A错误;B、Q点时溶液显酸性,因此c(H+)>c(OH-),即lgc(H+)>lgc(OH-),故B错误;C、电离平衡常数只受温度的影响,根据P点,Ka= 10-4.2,此平衡常数是草酸的二级电离,故C错误;D、根据质子守恒,因此有c(OH-)=c(H+)-c(C2O42-)+c(H2C2O4),故D正确。 12.已知: 常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-12②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH的变化关系如图所示。 下列叙述错误的是 A.在pH=4.3的溶液中: 3c(R2-)=c(Na+)+c(H+)-c(OH-) B.向Na2CO3溶液中加入少量H2R溶液,发生反应: 2CO32-+H2R=2HCO3-+R2- C.在pH=1.3的溶液中存在 =10-3 D.等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大 【答案】D 【解析】A、在pH=4.3的溶液中,c(R2-)=c(HR-),溶液中电荷守恒为: 2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),所以3c(R2-)=3c(HR-)=c(Na+)+c(H+)-c(OH-),故A正确;C、当溶液pH=1.3时,c(H2R)=c(HR-),则Ka1= =10-1.3,溶液的pH=4.3时,c(R2-)=c(HR-),则Ka2= =10-4.3, = =10-3,故C正确;B、H2R的电离常数Ka2大于H2CO3的Ka2,即酸性: HR->HCO3-,所以向Na2CO3溶液中加入少量H2R溶液,发生反应: 2CO32-+H2R=2HCO3-+R2-,故B正确;D、等体积等浓度的NaOH溶液与H2R溶液混合后,生成等浓度的H2R、HR-,溶液的pH=1.3,溶液显酸性,对水的电离起到抑制作用,所以溶液中水的电离程度比纯水小,故D错误;故选D。 13.25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。 下列说法正确的是 A.在pH=5.0的溶液中,c(A-)=c(HA),c(OH-)=c(H+) B.pH=7的溶液中,α(HA)=0,α(A-)=1.0 C.25℃时,Ka(HA)=1×10-5 D.pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1 【答案】C 14.25℃时,有c(HA)+c(A-)=0.1mol/L的一组HA、KA混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。 下列叙述不正确的是 A.pH=5.75的溶液中: c(K+)>c(A-)>c(HA)>q(H+)>c(OH-) B.欲得W点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L且c(KA) C.pH=3.75的溶液中: c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L D.若A-的水解常数为Kb则lgKb=-9.25 【答案】A 【解析】pH=5.75的溶液呈酸性,c(K+)>c(A-)>c(HA)>q(H+)>c(OH-)不符合电荷守恒,故A错误;根据W点,HA的电离平衡常数是 ,A-的水解平衡常数为 ,HA电离大于A-水解,欲得W点所示溶液,c(KA) ,lgKb=-9.25,故D正确。 15.乙二胺(H2NCH2CH2NH2)与NH3相似,水溶液呈碱性,25℃时,向10mL0.1mol·L-1乙二胺溶液中滴加0.1mol·L-1盐酸,各组分的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是 A.混合溶液呈中性时,滴加盐酸的体积小于10mL B.Kb2[H2NCH2CH2NH2]的数量级为10-8 C.a点所处的溶液中: c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-)+(Cl-) D.水的电离程度: a>b 【答案】A 【解析】根据图像可知,乙二胺(H2NCH2CH2NH2)为二元弱碱,当加入10mL盐酸时,生成的(H2NCH2CH2NH3)Cl,溶液呈碱性,A项错误;Kb2[H2NCH2CH2NH2]= ,由图像a可知,c[(H3NCH2CH2NH3)2+]=c[(H2NCH2CH2NH3)+],c(H+)=10-6.85,c(OH—)=10-7.15,即Kb2[H2NCH2CH2NH2]的数量级为10-8,B项正确;a点所处的溶液中的电荷守恒为: c(H+)+2c([H3NCH2CH2NH3]2+)+c[(H2NCH2CH2NH3)+]=c(OH-)+(Cl-),因c[(H3NCH2CH2NH3)2+]=c[(H2NCH2CH2NH3)+],故c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-)+(Cl-),C项正确;a点溶质为乙(H3NCH2CH2NH3)Cl2和(H2NCH2CH2NH3)Cl混合物,两种盐将会促进水的电离,而b点为(H2NCH2CH2NH3)Cl和H2NCH2CH2NH2,(H2NCH2CH2NH3)Cl会促进水的电离,而H2NCH2CH2NH2会抑制水的电离,综上所述,水的电离程度: a>b,D项正确。 16.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-)变化的关系如图所示。 下列叙述错误的是 下列叙述错误的是 A.Kb1(N2H4)=10-6 B.反应N2H62++N2H4=2N2H5+的PK=9.0(已知: pK=-1gK) C.N2H5C1溶液中c(H+)>c(OH-) D.N2H5C1溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+) 【答案】B 17.已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH的关系如图所示。 下列说法不正确的是 A.常温下,亚硒酸的电离平衡常数K2=10-4.2 B.pH=l.2的溶液中: c(Na+)+c(H+)=c(OH-)+c(H2SeO3) C.将相同物质的量NaHSeO3和Na2SeO3固体完全溶于水可配得pH为4.2的混合液 D.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大 【答案】C 【解析】A: 根据电离反应方程式: H2SeO3=H++HSeO3-,HSeO3-=H++SeO32-知K2=c(H+).c(SeO32-)/c(HSeO3-),当PH=4.2时,达到平衡所以。 此时c(HSeO3-)=c(SeO32-) 说以K2=10-4.2故A正确。 B.pH=l.2的溶液中H2SeO3和HSeO3-的浓度相等,根据电荷守恒关系知: c(Na+)+c(H+)=c(OH-)+c(H2SeO3)是正确的;故B对;C.将相同物质的量NaHSeO3和Na2SeO3固体完全溶于水不能配得pH为4.2的混合液,Na2SeO3强碱弱酸盐,水解显碱性,NaHSeO3水解达到平衡时PH=4.2,所以两者混合物的PH一定大于4,2.故C错。 D.向pH=12的溶液中滴加NaOH溶液至pH=4.2的过程中因为中和了溶液中的氢离子,促进了水的电离,故水的电离程度一直增大。 故D正确。 18.弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知δ(X)= ],下列说法不正确的是(图中: a=1.25、b=4.27) A.已知pKa=-lgKa,则pKa1=1.25 B.0.1mol·L-1的NaHA溶液显碱性 C.0.1mol·L-1Na2A溶液中: 2c(H2A)+c(HA-)=c(OH-)-c(H+) D.0.1mol·L-1NaHA溶液中: c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1 【答案】B 19.HA为一元弱酸。 已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。 向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液xmL。 下列说法中,不正确的是 A.pH=9时,c(A-)=c(HA)B.x=0时,1<pH<7 C.x=5时,c(A-)=c(HA)D.x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L 【答案】C 【解析】A、根据图像,当pH=9时,c(HA)=(A-),故A说法正确;B、HA为弱酸,0.1molHA的pH>1,HA为酸,因此HA的pH<7,故B说法正确;C、x=5时,此时溶液中的溶质为NaA和HA,且两者物质的量相等,A-的物质的量分数为0.5,根据图像此时pH=9,溶液显碱性,即c(A-)>c(HA),故C说法错误;D、x=10时,NaOH和HA恰好完全反应,此时的溶液中溶质为NaA,根据物料守恒,因此有c(A
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 配套 K12 高考 化学 一轮 复习 酸碱 中和 滴定 曲线 大全 专题 05 物质 分数 练习
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《爱和自由》读书心得15篇.docx
《爱和自由》读书心得15篇.docx
