 高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修.docx
高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修.docx
- 文档编号:24297995
- 上传时间:2023-05-26
- 格式:DOCX
- 页数:13
- 大小:172.10KB
高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修.docx
《高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修.docx》由会员分享,可在线阅读,更多相关《高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修.docx(13页珍藏版)》请在冰豆网上搜索。
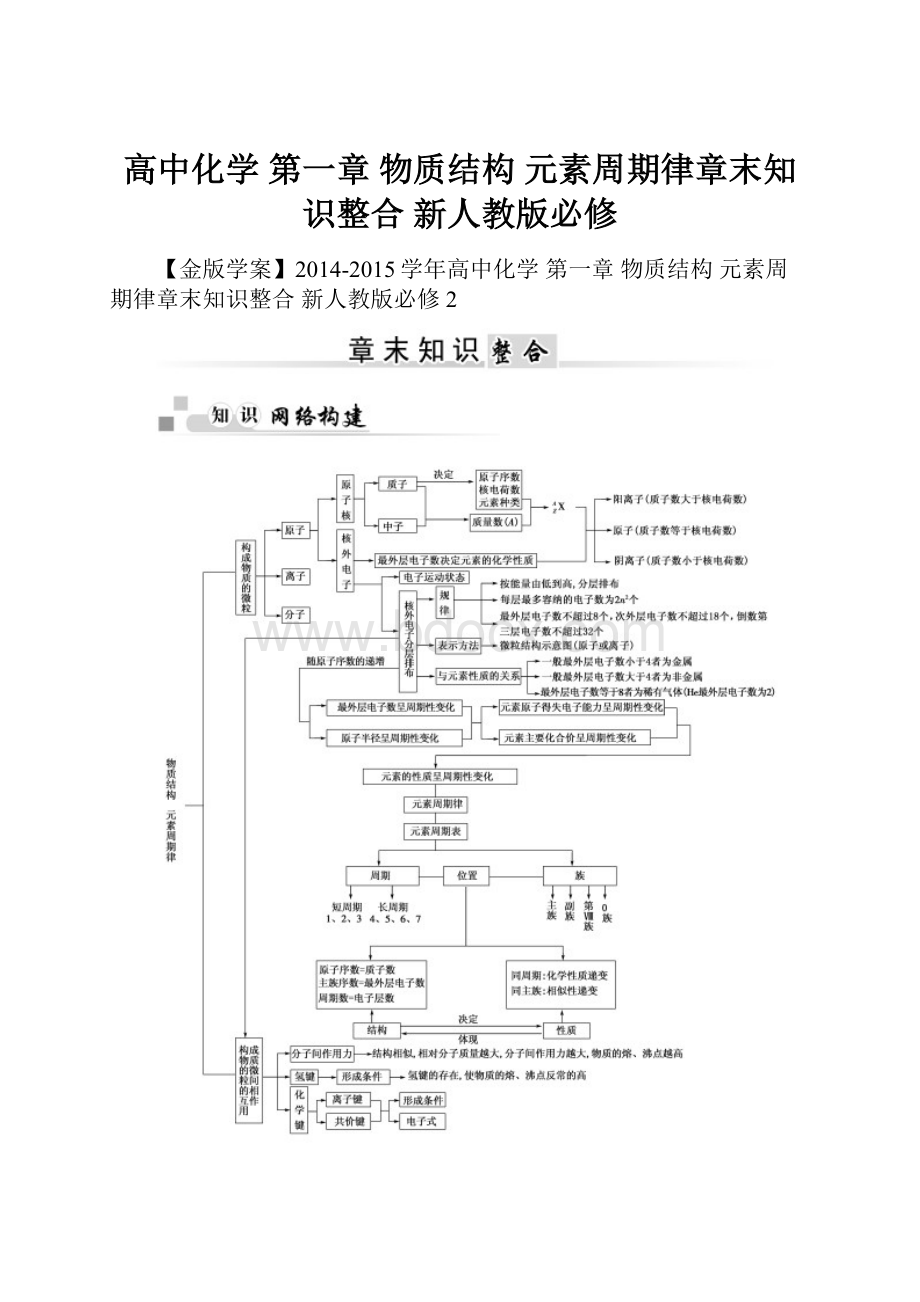
高中化学第一章物质结构元素周期律章末知识整合新人教版必修
【金版学案】2014-2015学年高中化学第一章物质结构元素周期律章末知识整合新人教版必修2
►专题归纳
元素推断题在历年高考中占有一定的比例(主要在选择题体现),主要考查元素周期表中“位、构、性”的关系及学生利用物质结构和性质进行综合推断的能力,要求学生熟练掌握短周期所有元素的结构特点,在周期表中的位置以及它们的重要化合物的性质,在此基础上进行综合分析。
1.一般解题思路。
在以上基础上,针对题目按以下具体方法进行推断:
2.与元素推断相关的几个问题。
(1)原子结构与元素在周期表中位置关系的规律。
①核外电子层数=周期数。
②主族元素的最外层电子数=主族序数。
③质子数=原子序数=原子核外电子数。
④主族元素的最高正化合价=主族序数;最低负化合价的绝对值=8-主族序数。
(2)周期表中特殊位置的短周期元素。
①族序数等于周期数的短周期元素:
H、Be、Al。
②族序数等于周期数2倍的短周期元素:
C、S。
③族序数等于周期数3倍的短周期元素:
O。
④周期数是族序数2倍的短周期元素:
Li。
⑤周期数是族序数3倍的短周期元素:
Na。
⑥最高正化合价与最低负化合价的代数和为零的短周期元素:
C、Si。
⑦最高正化合价是最低负化合价绝对值3倍的短周期元素:
S。
⑧除H外,原子半径最小的元素为F(H是原子半径最小的元素)。
⑨最高正化合价不等于族序数的主族元素有:
O、F。
⑩核内无中子的元素:
H。
(3)元素性质、存在、用途的特殊性。
①形成化合物种类最多的元素:
C。
②气态氢化物中含氢元素质量分数最大的元素:
C(CH4中H的质量分数)。
③空气中含量最多的元素:
N。
④地壳中含量最多的元素:
O;地壳中含量最多的金属元素:
Al。
⑤最活泼的非金属元素或无正价的非金属元素或无含氧酸的非金属元素或气态氢化物最稳定的非金属元素:
F。
⑥自然界中稳定存在的最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素:
Cs。
⑦焰色反应呈黄色的元素:
Na;焰色反应呈紫色(透过蓝色的钴玻璃观察)的元素:
K。
⑧单质最轻的元素:
H;最轻的金属元素:
Li。
⑨常温下单质呈液态的金属元素:
Hg;常温下单质呈液态的非金属元素:
Br。
由短周期元素组成的A、B、C、D、E、F六种粒子,其中只有C、D是分子,其余四种均为离子,且每个粒子中均含有10个电子。
已知A、E是由非金属元素组成的阳离子,六种粒子间存在下列关系:
①A、B两种粒子在加热条件下生成C、D两种分子。
②通常情况下C为气态,且可使湿润的红色石蕊试纸变蓝。
③1molB离子与1molE离子作用可生成2molD分子。
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C的溶液过量时沉淀不消失,若加入含大量B离子或大量E离子的溶液,沉淀W溶解。
(1)粒子B的化学式是________,所含化学键类型是________;粒子E的名称是________;粒子F对应的元素在周期表中的位置是________________。
(2)写出下列反应的离子方程式。
F+过量C的溶液:
_____________________________________________。
W+含大量B离子的溶液:
________________________________________________________________________。
解析:
由②可知C为NH3,根据A、E是非金属元素组成的阳离子,可知A、E分别是NH4+和H3O+中的一种。
由①和③可确定A为NH4+,B为OH-,D为H2O,E为H3O+,白色沉淀不溶于氨水,却既溶于强酸又溶于强碱,F只能是铝离子。
答案:
(1)OH- 极性共价键(或共价键) 水合氢离子 第三周期第ⅢA族
(2)Al3++3NH3·H2O
Al(OH)3↓+3NH4+
Al(OH)3+OH-===AlO2-+2H2O
专题训练
1.X、Y、Z都是短周期元素,X原子的最外层只有1个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有2种正价,两种正价的差值为2。
由X、Y、Z三种元素组成的化合物的化学式可能是()
①X2YZ3②XYZ3③XYZ4④X2YZ4⑤X3YZ3⑥X3YZ4
A.①②③B.④⑤⑥
C.②⑤⑥D.①③⑤
解析:
由Y原子的M层电子数只有K层与L层电子数之和的一半可得Y为P,由Z原子的L层电子数比Y原子的L层电子数少2可得Z为O,X原子的最外层只有1个电子,X可以为H、Li或者Na,化合价均为+1。
答案:
C
2.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。
下列推测不正确的是()
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
解析:
由题干元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构可知X、Y一定在第三周期,则Z在第二周期,由X和Z的化合价可知X为Na,Z为O,则Y为Cl。
答案:
B
3.短周期元素A、B、C、D、E,其原子序数的大小顺序为:
A>C>D>E>B。
A、C、D位于同一周期,E原子最外层电子数是次外层电子数的3倍,B原子比E原子少2个电子。
A元素的单质0.015mol与足量盐酸完全反应时,有2.709×1022个电子发生转移。
(1)A位于元素周期表的第________周期、第________族,E位于第________周期、第________族。
(2)B单质在E单质中完全燃烧生成的化合物的结构式为______,该分子中含________(选填“极性”或“非极性”)键。
(3)写出A、C、D的最高价氧化物对应水化物的化学式,并比较其酸碱性强弱:
________________________________________________________________________。
解析:
由E原子最外层电子数是次外层电子数的3倍可得E为O,由B原子比E原子少2个电子可得B为C,由原子序数大小顺序可知A、C、D位于第三周期。
由0.015molA与盐酸反应时,转移电子的物质的量为0.045mol可知A为Al,则C为Mg,D为Na。
答案:
(1)三 ⅢA 二 ⅥA
(2)O===C===O 极性 (3)碱性:
NaOH>Mg(OH)2>Al(OH)3
►专题归纳
同一元素的“位、构、性”关系可表示如下:
在具体解题过程中,必须具备以下四个方面的基础:
1.结构与位置互推问题是解题的基础。
(1)掌握四个关系式。
①电子层数=周期序数。
②质子数=原子序数。
③最外层电子数=主族序数。
④主族元素的最高正价=主族序数,主族元素的最低负价=主族序数-8。
2.性质与位置互推问题是解题的关键。
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
(1)元素的金属性、非金属性。
(2)气态氢化物的稳定性。
(3)最高价氧化物对应水化物的酸碱性。
(4)单质的氧化性、还原性。
3.结构和性质的互推问题是解题的要素。
(1)最外层电子数决定元素原子的氧化性和还原性。
(2)原子半径决定了元素单质的性质;离子半径决定了元素组成的化合物的性质。
4.元素“位、构、性”规律的应用。
根据原子序数推断元素在元素周期表中的位置规律。
(1)根据每一周期结尾的稀有气体元素的原子序数分别为2、8、18、36、54、86,用给定的原子序数减去比它小且最接近的稀有气体元素的原子序数,即得该元素所在的纵行。
元素周期表共有18个纵行,从左到右依次为:
ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族。
这种元素的周期数比相近的原子序数小的稀有气体元素的周期数大1。
(2)同一主族相邻周期两元素原子序数的差值。
①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一周期元素的原子序数。
②第ⅣA、ⅤA、ⅥA、ⅦA、0族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
特别提示:
各周期元素所包括的元素种数依次为:
2、8、8、18、18、32。
下图是元素周期表的一部分,下列说法中正确的是()
A.原子半径:
④>③
B.气态氢化物的稳定性:
③大于⑥,与氢键无关
C.元素⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的⑤单质与生成氢气的物质的量之比为23
D.元素④、⑦、⑨的单质的氧化性依次增强
解析:
A项,原子半径应该是O大于F,错误;B项,同主族元素所形成的氢化物的稳定性随着元素的非金属性的增大而增强,与分子间存在的氢键无关,正确;C项,Al与HNO3的反应极其复杂,如果是浓HNO3则常温下不会反应产生气体,如果是稀HNO3则反应生成的不是氢气,而是NO,错误;D项,F2、Cl2、Br2的氧化性依次减弱,错误。
答案:
B
专题训练
4.下图为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素。
下列说法正确的是()
X
Y
Z
R
W
A.Y单质一定既能与盐酸又能与氢氧化钠溶液反应
B.五种元素的原子最外层电子数一定都大于2
C.单质X的熔点一定比单质Z的熔点高
D.R的最高价氧化物对应的水化物一定是碱
解析:
由题干可知X在第二周期,可以是C、N或者O。
当X为C是,Y、Z、R、W分别为Al、Si、P和Ga;如果X为N,则Y、Z、R、W分别为Si、P、S和Ge;如果X为O,则Y、Z、R、W分别为P、S、Cl和As。
答案:
B
5.A、B、C、D、E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:
A
B
C
D
E
下列说法正确的是()
①E元素的最高化合价为+7时,D元素的负化合价可为-2
②A(OH)n为强碱时,B(OH)m也一定为强碱
③HnDOm为强酸时,E的非金属性一定很强
④HnCOm为强酸时,E的单质可能有强还原性
A.①③B.②③C.①④D.③④
解析:
E元素的最高化合价为+7时,E为第ⅦA族,则D为第ⅥA族,①正确;A(OH)n为强碱时,可以是NaOH,而B(OH)m为Mg(OH)2,不是强碱,②错;HnDOm为强酸时,可以是HClO4,而E为K,没有非金属性,③错;同理可得④正确。
答案:
C
6.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等。
请回答下列问题:
(1)T的原子结构示意图为________。
(2)元素的非金属性强弱顺序(原子的得电子能力)为Q________(选填“强于”或“弱于”)W。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为________________________________________________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________。
解析:
由几种元素的相对位置,可知T所处的周期序数为三,由T所处的周期序数与主族序数相等可得T为Al,则Q为C,R为N,W为S。
答案:
(1)
(2)弱于
(3)S+2H2SO4(浓)
3SO2↑+2H2O
(4)2H2O2
2H2O+O2↑
第十三章:
干燥
通过本章的学习,应熟练掌握表示湿空气性质的参数,正确应用空气的H–I图确定空气的状态点及其性质参数;熟练应用物料衡算及热量衡算解决干燥过程中的计算问题;了解干燥过程的平衡关系和速率特征及干燥时间的计算;了解干燥器的类型及强化干燥操作的基本方法。
二、本章思考题
1、工业上常用的去湿方法有哪几种?
态参数?
11、当湿空气的总压变化时,湿空气H–I图上的各线将如何变化?
在t、H相同的条件下,提高压力对干燥操作是否有利?
为什么?
12、作为干燥介质的湿空气为什么要先经预热后再送入干燥器?
13、采用一定湿度的热空气干燥湿物料,被除去的水分是结合水还是非结合水?
为什么?
14、干燥过程分哪几种阶段?
它们有什么特征?
15、什么叫临界含水量和平衡含水量?
16、干燥时间包括几个部分?
怎样计算?
17、干燥哪一类物料用部分废气循环?
废气的作用是什么?
18、影响干燥操作的主要因素是什么?
调节、控制时应注意哪些问题?
三、例题
例题13-1:
已知湿空气的总压为101.3kN/m2,相对湿度为50%,干球温度为20oC。
试用I-H图求解:
(a)水蒸汽分压p;
(b)湿度H;
(c)热焓I;
(d)露点td;
(e)湿球温度tw;
(f)如将含500kg/h干空气的湿空气预热至117oC,求所需热量Q。
解:
由已知条件:
P=101.3kN/m2,Ψ0=50%,t0=20oC在I-H图上定出湿空气的状态点A点。
(a)水蒸汽分压p
过预热器气所获得的热量为
每小时含500kg干空气的湿空气通过预热所获得的热量为
例题13-2:
在一连续干燥器中干燥盐类结晶,每小时处理湿物料为1000kg,经干燥后物料的含水量由40%减至5%(均为湿基),以热空气为干燥介质,初始湿度H1为0.009kg水•kg-1绝干气,离开干燥器时湿度H2为0.039kg水•kg-1绝干气,假定干燥过程中无物料损失,试求:
(1)水分蒸发是qm,W(kg水•h-1);
(2)空气消耗qm,L(kg绝干气•h-1);
原湿空气消耗量qm,L’(kg原空气•h-1);
(3)干燥产品量qm,G2(kg•h-1)。
解:
qmG1=1000kg/h,w1=40℃,w2=5%
H1=0.009,H2=0.039
qmGC=qmG1(1-w1)=1000(1-0.4)=600kg/h
x1=0.4/0.6=0.67,x2=5/95=0.053
qmw=qmGC(x1-x2)=600(0.67-0.053)=368.6kg/h
qmL(H2-H1)=qmw
qmL’=qmL(1+H1)=12286.7(1+0.009)=12397.3kg/h
qmGC=qmG2(1-w2)
∴
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 第一章 物质结构 元素周期律章末知识整合 新人教版必修 物质 结构 元素周期律 知识 整合 新人 必修
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《包身工》教案设计精选文档.docx
《包身工》教案设计精选文档.docx
