 高中阶段常见元素的化合价.docx
高中阶段常见元素的化合价.docx
- 文档编号:23969613
- 上传时间:2023-05-23
- 格式:DOCX
- 页数:18
- 大小:24.63KB
高中阶段常见元素的化合价.docx
《高中阶段常见元素的化合价.docx》由会员分享,可在线阅读,更多相关《高中阶段常见元素的化合价.docx(18页珍藏版)》请在冰豆网上搜索。
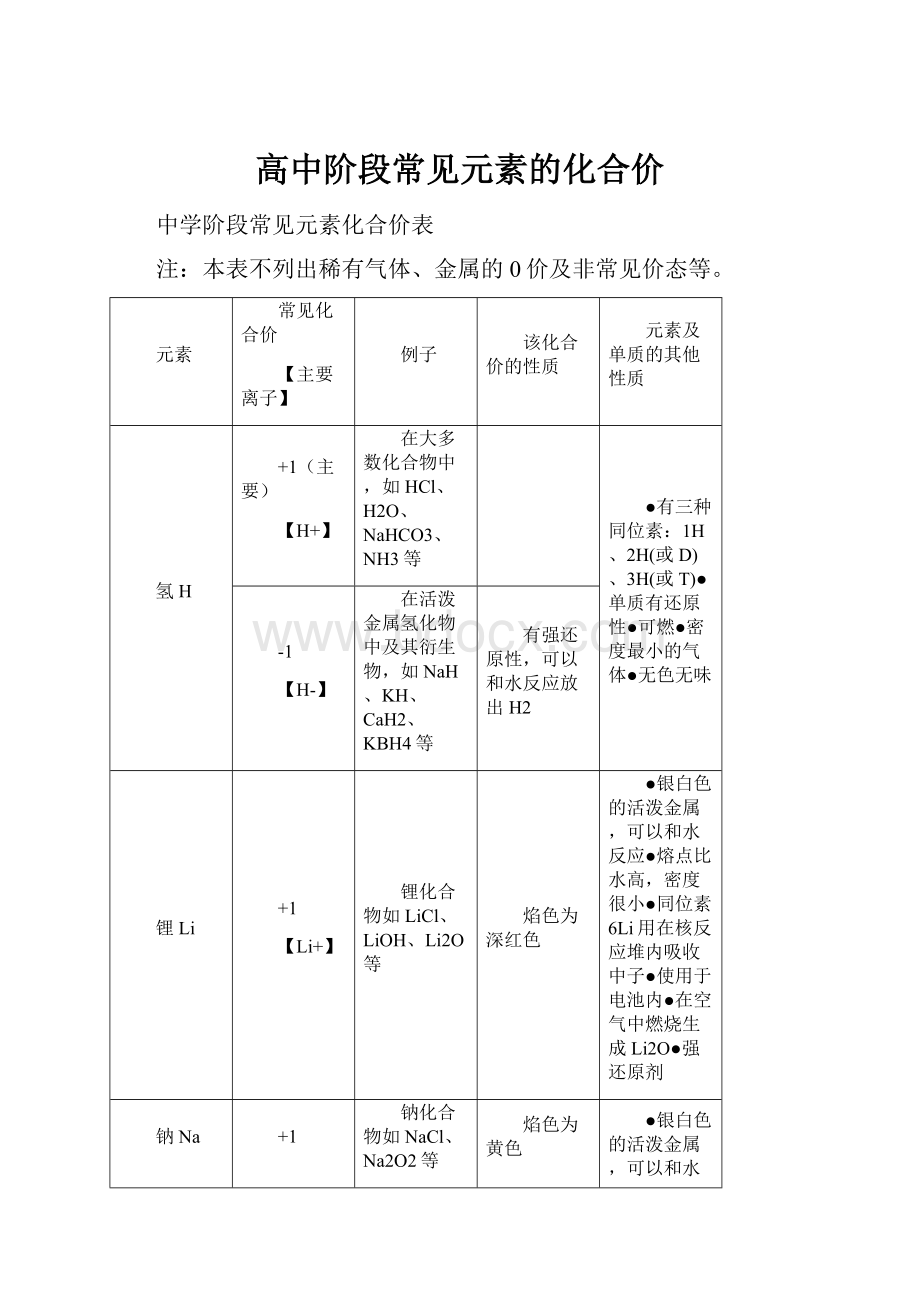
高中阶段常见元素的化合价
中学阶段常见元素化合价表
注:
本表不列出稀有气体、金属的0价及非常见价态等。
元素
常见化合价
【主要离子】
例子
该化合价的性质
元素及单质的其他性质
氢H
+1(主要)
【H+】
在大多数化合物中,如HCl、H2O、NaHCO3、NH3等
●有三种同位素:
1H、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味
-1
【H-】
在活泼金属氢化物中及其衍生物,如NaH、KH、CaH2、KBH4等
有强还原性,可以和水反应放出H2
锂Li
+1
【Li+】
锂化合物如LiCl、LiOH、Li2O等
焰色为深红色
●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素6Li用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li2O●强还原剂
钠Na
+1
【Na+】
钠化合物如NaCl、Na2O2等
焰色为黄色
●银白色的活泼金属,可以和水反应,保存在煤油中●熔点比水低,密度、硬度小●和醇、酸反应放出氢气●在空气中燃烧生成Na2O2●强还原剂
钾K
+1
【K+】
钾化合物如KCl、KNO3等
焰色为紫色(混有Na+时会为黄色,透过蓝色钴玻璃才能看到紫色)
●银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K2O2和KO2●钾钠合金用作核反应堆的冷却剂
铷Rb
铯Cs
+1
【Rb+】
【Cs+】
铷、铯化合物如RbCl、CsCl等
铷的焰色为浅紫色,铯的焰色为天蓝色
●铷是银白色金属,铯是略带金黄色光泽的金属,熔点低,和水极其猛烈地反应●铯可以在空气中自燃●强还原剂
镁Mg
+2
【Mg2+】
镁化合物如MgCl2、MgSO4等
●银白色活泼金属,和沸水略有反应●在空气中燃烧生成MgO,也有Mg3N2生成●能在CO2等大多数气体中燃烧●和酸剧烈反应●强还原剂●军事上用作照明弹
钙Ca
+2
【Ca2+】
钙化合物如CaCl2、CaSO4、CaO等
焰色为砖红色
●银白色活泼金属,和水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂
锶Sr
钡Ba
+2
【Sr2+】
【Ba2+】
锶、钡化合物如SrCl2、BaSO4等
锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒
●银白色活泼金属,可以和水反应●密度比水大●强还原剂●可以在空气中燃烧
硼B
+3
【BO33-】
大多数硼化合物如H3BO3、B2O3等
铝Al
+3
【Al3+】
【AlO2-】(偏铝酸根)
大多数铝化合物如Al2O3、NaAlO2等
●银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化●两性金属,可以和强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料
铊Tl
+1【Tl+】
亚铊化合物如TlCl等
剧毒
●较软的银白色金属,和酸反应生成亚铊化合物●剧毒
+3【Tl3+】
三价铊化合物如Tl2O3等
剧毒;强氧化性
镓Ga
铟In
+3
【Ga3+、In3+】
大多数镓、铟化合物中
●镓的熔点低于体温
碳C
+2
CO等
有还原性
●有多种同素异形体,如金刚石、石墨、C60等●高温下有还原性,可以还原金属氧化物、CO2等●可以在纯氧中燃烧发出耀眼白光●同位素14C用于考古
+4
【CO32-】
【HCO3-】等
CO2、CS2等
其他
金属碳化物中碳显负价(如CaC2等);有机物一般不讨论碳的化合价
负价的碳化合物有还原性
硅Si
+4
【SiO32-】
硅酸盐如Na2SiO3、硅酸、SiF4、氟硅酸盐等
●半导体材料●用作电脑芯片●可以和碱反应放出氢气
+3
SiHCl3
-4
【Si4-】
某些硅化物如Mg2Si、Ca2Si等
和水反应放出自燃性的硅烷
锗Ge
+4
GeO2等
●半导体材料
锡Sn
+4
【Sn4+】
四价锡化合物如SnO2、SnCl4等
可溶于过量强碱
●熔点较低,常用来制备合金,如青铜(传统的青铜是铜锡合金)、焊锡等
+2
【Sn2+】
亚锡化合物如SnCl2、SnSO4等
有还原性;溶于过量强碱
铅Pb
+4
【Pb4+】
四价铅化合物如Pb(CH3COO)4、PbO2等;Pb3O4含有+2和+4价的铅。
有强氧化性
●铅和酸反应生成二价铅化合物,四价铅则难达到●质软的金属●有毒●熔点较低,常用来制合金●可以防护放射线●在空气中生成致密的碱式碳酸铅氧化膜
+2(主要)
【Pb2+】
二价铅化合物如PbO、PbCl2等
氮N
+5
【NO3-】
硝酸及硝酸盐(如KNO3)、N2O5等
硝酸根离子酸化后具有强氧化性
●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2反应产生NO●和H2高温高压在有催化剂的条件下化合成NH3●游离态氮转化为化合态氮的过程叫做固氮●用作冷却、防腐、保护气体
+4
NO2、N2O4等
易歧化
+3
【NO2-】
亚硝酸及亚硝酸盐(如NaNO2)、N2O3等
亚硝酸跟离子有致癌性
+2
NO等
+1
N2O等
-3
【NH4+】
【N3-】
氨气、铵盐(如NH4Cl)、氮化物(如Na3N、Mg3N2等)
NH3溶于酸;铵盐和碱反应生成NH3;活泼金属氮化物和水反应放出NH3,生成碱
其他【N3-】
叠氮化物(如NaN3等)
磷P
+5(主要)
【PO43-】
【HPO42-】
【H2PO4-】等
磷酸及其盐(如H3PO4、HPO3、K3PO4、NaH2PO4等)、P4O10、PCl5、POCl3等
无显著氧化性
●有红磷、白磷(P4)、黑磷等多种同素异形体●易燃,在空气中燃烧生成P4O10●白磷易自燃,剧毒,可溶于CS2●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆
+3【PO33-】等
H3PO3、PCl3等
+1
次磷酸(H3PO2)及其盐
有强还原性
-3
【P3-】
磷化物(如K3P等)
砷As
+5【AsO43-】等
砷酸及其盐、As2O5
●有灰色类金属砷(灰砷)、黄砷、黑砷等多种同素异形体●可燃●大多数含砷化合物有剧毒●用作半导体
+3【AsO33-】等
亚砷酸及其盐、As2O3
-3
砷化物(如AsH3、K3As等)
活泼金属砷化物和水反应产生H3As
其他
As4S4等
锑Sb
+5【SbO3-】
【SbF6-】等
SbF5、HSbF6、SbCl5、锑酸盐等
SbF5或锑和氟构成的阴离子有极强的酸性
●熔点低,有多种同素异形体,但只有灰锑最稳定●用作合金、半导体●有毒
+3【Sb3+】
Sb2O3、SbCl3等
-3【Sb3-】
锑化物等
和水反应
铋Bi
+5【BiO3-】
BiF5、NaBiO3等
强氧化性
●低熔点●常用来制作合金●燃烧有蓝色火焰
+3【Bi3+】
Bi(NO3)3、Bi2O3等
最常见价态
氧O
-2
【O2-】
【OH-】
【……】
氧化物如SO2、CuO、I2O5等;氢氧化物如KOH等;大多数含氧酸及其盐如HClO4、BaSO4等;……
最常见的价态
●无色无味的气体,供给呼吸,助燃●最常见的同素异形体是臭氧(O3),有鱼腥臭味和很强的氧化性(常温下能将银、硫化铅等物质氧化),易被催化分解,受热易分解●在氧气中高压放电能产生臭氧●液氧为淡蓝色液体,固态为淡蓝色雪花状固体●绝大多数元素都存在氧的化合物●接近100%的纯氧能使人的呼吸停止
-1
【O22-】
过氧化物如H2O2、Na2O2等
和水反应放出氧气
+2
OF2等
有极强氧化性;受热分解
+
【O2+】
二氧基盐(如O2F2、O2PtF6、O2AsF6)等
其他
【O2-】
【O3-】等
超氧化物(如KO2)、臭氧化物(如CsO3)、HOF(此处0价)等
强氧化性;超氧化物、臭氧化物和水反应放出氧气
硫S
+6【SO42-】
【S2O82-】
【S2O72-】等
SO3、H2SO4、硫酸盐、过硫酸盐、焦硫酸盐、SF6等
●黄色固体,可燃,在空气中燃烧产生淡蓝色火焰,在纯氧中则为蓝紫色火焰●熔点低●和碱金属反应爆炸,研磨即可反应●能和一些不活泼金属如Cu、Hg反应●溶于二硫化碳或碱金属硫化物溶液中●硫的分子式为S8●硫有多种同分异构体●硫、碳、硝酸钾用一定的工艺混合可以制成黑火药
+4【SO32-】等
SO2、亚硫酸盐等
+2
SCl2等
-2
【S2-】
硫化物(如K2S、H2S、Cu2S、HgS等)、硫取代氧的化合物等
活泼金属硫化物和酸反应产生H2S;某些金属的硫化物则很稳定;还原性
其他
【Sn2-】等
多硫化物(Na2S3、Na2S5等)、S2Cl2等
硒Se
+6【SeO42-】
SeO3、硒酸盐等
强氧化剂;浓、热的硒酸能溶解金
●灰色或红色固体,熔点低,受热易挥发,有多种同素异形体●在空气中燃烧有蓝色火焰
+4【SeO32-】
SeO2、亚硒酸盐等
有毒
-2【Se2-】
硒化物等
和酸反应产生H2Se
碲Te
+6【TeO42-】等
TeO3、碲酸盐等
●熔点低的银灰色或深灰色固体●在空气中燃烧产生蓝色火焰●太阳能薄膜电池的主要原料●有毒●和硒一样,摄入非微量的化合物会让人体散发恶臭
+4【TeO32-】
TeO2、亚碲酸盐等
+2【TeX42-】
二卤化碲、四卤碲酸盐等
-2【Te2-】
碲化物等
和酸反应产生H2Te
其他【Ten2+】【Te64+】等
Te8(WCl6)2、Te6(AsF6)4等
n=4~8,颜色随离子而异
氟F
-1
【F-】
【HF2-】
【SiF62-】等
氟化物(如CaF2、HF、NH4F、NH4HF2、KHF2、UF6、XeF6等)、氟代含氧酸盐、含氟有机物等
可溶性氟化物有毒,直接接触可引起严重灼伤
●极毒的淡黄绿色气体,有芥末气味,化学性质极其活泼●无正价●只有少数元素不能和氟直接化合●用于制造含氟高分子材料、制造农药、制造人造血液、分离铀的同位素
氯Cl
+7【ClO4-】
高氯酸、高氯酸盐、Cl2O7等
强氧化剂
●剧毒的黄绿色气体,有刺激性气味,化学性质十分活泼●化合价多、氧化物不稳定●有漂白性●易液化●可溶于水●用于有机合成,是重要的化工原料
+5【ClO3-】
氯酸、氯酸盐等
强氧化剂
+4
ClO2等
+3【ClO2-】
亚氯酸、亚氯酸盐等
+2
ClO·
+1【ClO-】
次氯酸、次氯酸盐、Cl2O等
强氧化剂
-1【Cl-】等
氯化物等
溴Br
+7、+5、+4、+3、+1、-1
见“氯Cl”(溴、碘+1价有BrX、IX等)
溴酸盐有强氧化性
●有毒的深红棕色重质液体,易挥发,有刺激性气味,化学性质活泼●溶于水、乙醇、四氯化碳、苯等●用于消毒
碘I
+7、+5、+3、+1、-1
见“氯Cl”(次碘酸及其盐常温不存在)
碘化物有较强的还原性
●深紫色固体,有毒,易升华,有刺激性气味●受热升华●用于消毒●溶于水、碘化物溶液、乙醇、四氯化碳、苯等
其他
【I3-】等
碘溶于碘化物溶液中产生:
I2+I-=I3-
使淀粉变蓝;有较强的还原性
钛Ti
+4【Ti4+】
【TiO32-】
钛酸盐、TiO2、四价钛化合物
●银白色金属,有很强的抗腐蚀能力,常温下化学性质稳定●高温下能在氧气、氮气中燃烧,分别生成TiO2和TiN●制作合金、用作添加剂及颜料(TiO2)
+3【Ti3+】
三价钛化合物
+2【Ti2+】
二价钛化合物
和水或酸反应放出氢气
钒V
+5【VO3-】
【VO43-】
钒酸盐、偏钒酸盐、V2O5、VF5、VOCl3等
●银灰色金属,耐腐蚀●用作催化剂●有丰富的价态,各价态有不同的颜色
+4【VO2+】
VCl4、VO2等
+3【V3+】
V2O3、VBr3等
+2【V2+】
VO、VCl2等
铬Cr
+6【CrO42-】
【Cr2O72-】
(此价态常见)
CrO3、CrO5、铬酸盐(BaCrO4、K2CrO4、Na2CrO4等)、
重(chóng)铬酸盐(K2Cr2O7、(NH4)2Cr2O7等)
铬酸跟在酸性条件下转化为重铬酸根,碱性条件下逆转换。
氧化剂。
致癌。
●银白色金属,十分坚硬●有丰富的价态,化合物颜色多样●用于制备强度大的合金,或用于金属防锈●在硝酸中钝化
+5【Cr(O2)43-】
K3Cr(O2)4
红褐色
+4
CrO2、K2CrF6等
+3【Cr3+】【CrO2-】(此价态常见)
铬盐(如CrCl3等)、Cr2O3、NH4Cr(SO4)2、次铬酸盐等
主要为绿色
+2【Cr2+】
亚铬盐(如CrCl2等)、CrO等。
Cr2+和水反应放出H2
钨W
+6(常见)
【WO42-】等
钨酸盐、仲钨酸盐(H2W12O4210-)、磷钨酸盐、WCl6、WO3等
●可以在纯氧中燃烧发出白光●熔点很高的钢灰色至银白色金属●质地坚硬、紧密●用于灯丝、合金等
+4
WO2、WS2等
锰Mn
+7
【MnO4-】
高锰酸及其盐(如KMnO4等)、Mn2O7
有强氧化性,不稳定。
紫色
●活泼金属,活泼性在铝和锌之间●带有红色光泽的银白色金属,潮湿处易被氧化●用于制备合金
+6【MnO42-】
锰酸盐
+5【MnO43-】
锰(V)酸盐
+4
MnO2等
和浓盐酸反应产生Cl2
+3
MnF3、Mn2O3、MnO(OH)
+2
锰盐(如MnSO4、MnCl2等)、Mn(OH)2
铁Fe
+6【FeO42-】
高铁盐(如K2FeO4等)
强氧化性,不稳定,在酸中分解
●银白色具有磁性的金属,熔点很高●常用来制作合金●在纯氧中可燃,发出耀眼白光,产生四氧化三铁●和水蒸汽高温反应产生四氧化三铁和氢气●和非氧化性酸、碘、硫反应生成二价铁●和Cl2、Br2反应生成三价铁●在硝酸、浓硫酸中钝化
+3和+2
Fe3O4、Fe4[Fe(CN)6]3
+3【Fe3+】
铁盐(如FeCl3等)等
有氧化性。
水溶液为黄色
+2【Fe2+】
亚铁盐(如FeCl2等)、FeO、FeS等
有还原性,易被氧化。
水溶液为浅绿色
+1
Fe(NO)SO4
钴Co
+5
高钴酸盐(如K3CoO4)
●有磁性的高熔点银白色金属●钴和酸、氯气反应只生成二价钴●常用来制作合金●60Co用于放射医学
+4
CoO2(水合)
+3
三价钴化合物(如Co2O3、亚硝酸钴钠等),Co3O4中含+2和+3价的钴
有强氧化性,能氧化盐酸、水等,在溶液中不稳定
+2(常见)
【Co2+】
二价钴化合物
水溶液为红色
镍Ni
+4
K2NiF6
不稳定
●有磁性的高熔点的银色金属●常用作催化剂(如250℃催化苯和氢气加成为环己烷)●常用作合金●63Ni用作金属探伤●*Fe、Co、Ni的二价离子还原性依次减弱、稳定性依次增强,三价离子稳定性依次减弱,氧化性依次增强
+3
三价镍化合物(如Ni2O3等)
氧化性强于三价钴
+2(常见)
【Ni2+】
二价镍化合物
水溶液为碧绿色
钯Pd
+2(常见)
【Pd2+】
PdCl2、Pd(CH3COO)2、PdO等
在水溶液中就可被H2、CO还原
●银白色金属,室温时1大气压下能吸收800倍本身体积的氢●溶于硝酸,高温下和氟、氯反应●常用作催化剂
锇Os
+8
OsO4等
强氧化剂。
OsO4可溶于CCl4,微溶于水,有臭味
●常温常压下密度最大的元素●银白色金属●粉末状锇在室温易被氧化成OsO4,块状锇在670K才能被氧化
+4
OsO2、OsCl4等
铱Ir
+6
IrF6
强氧化剂
●银白色金属,化学性质稳定●有不同颜色的盐类●放射性的铱可用于金属探伤
+5
IrF5、KIrO3
强氧化剂
+4
IrO2、K2IrO3
铂Pt
+6
PtF6(极强的氧化剂,能氧化O2)
●银白色金属,化学性质很稳定●用于制造催化剂和高级化学器皿
+4【PtCl62-】
PbO2、H2PtCl6
+2
PbO
铜Cu
+2(主要)
【Cu2+】
铜盐(CuSO4等)、CuO、Cu(OH)2等
蓝色
●质地软、熔点高的紫红色金属●化学性质较稳定,但能被氯气、氧气、硝酸氧化
+1【Cu+】
亚铜化合物(CuCl、Cu2O等)
在酸中歧化
银Ag
+1(主要)
【Ag+】
大多数银化合物(Ag2O、AgNO3等)
沉淀Cl-、Br-、I-、S2-等
●银白色金属,化学性质稳定●易被硫、硫化氢腐蚀●熔点高
金Au
+3【Au3+】等
多数金化合物如Au2O3、HAuCl4等
●金黄色、化学性质稳定的贵金属,熔点1000多摄氏度,比铜、铁软●金的纳米粉末为紫色●不溶于硝酸,但溶于王水、汞,易被氟气、氯气和氰化物侵蚀
+1【Au+】
【Au(CN)2-】等
亚金化合物,如AuCl等
锌Zn
+2【Zn2+】
【Zn(OH)42-】
锌化合物(ZnCl2等)
溶于过量的强碱溶液
●银青色的活泼金属,熔点低●在空气中可以燃烧●常用作合金
镉Cd
+2(常见)
【Cd2+】
镉化合物(CdCl2等)
●银灰色金属,熔点低,有毒且可致癌●用于电池及电子原件,用在塑料制造、油漆方面,也用来制作合金
汞Hg
+2(常见)
【Hg2+】
大多数汞化合物(如Hg(NO3)2、HgO等)
加入Hg可转化为Hg22+,加入碱沉淀出HgO
●银白色液态的剧毒金属,会挥发●可以溶解大多数金属,溶解碱金属时放出大量热●汞合金叫做汞齐●补牙时,牙齿填充物的合金中的重要元素●和稀有气体产生包合物(相互作用而非化学反应)●绝大多数有机汞极毒,无机汞大多数也有剧毒●汞和硫、卤素常温下可以反应,汞溶于硝酸●用于医药、电子,用作催化剂、汞齐作为还原剂
+1(常见)
【Hg22+】
亚汞化合物(如Hg2Cl2等)
易歧化成Hg2+和Hg
镧La
+3(常见)
【La3+】
绝大多数镧化合物,如La2O3(可参入玻璃)、La(NO3)3、LaCl3等
加碱沉淀出La(OH)3
●银白色的活泼金属,是镧系金属中最活泼的●常温下被氧气氧化,在150℃自燃●常用来制作合金或用作还原剂
铈Ce
+4【Ce4+】
四价铈化合物,如CeO2、Ce(SO4)2等
强氧化性,能氧化盐酸产生氯气,可以被H2O2还原
●银白色的活泼的镧系金属,在150℃自燃,产生CeO2●常用作合金(尤其是制造打火石)或用作还原剂
+3【Ce3+】
三价铈化合物,如CeCl3、Ce2O3等
钍Th
+4【Th4+】
大多数钍化合物,如ThO2、Th(NO3)4等
水溶液中仅存在四价钍
●银白色锕系金属,有放射性●用作核燃料●二氧化钍灼烧发出白光
铀U
+6【UO22+】
【UO42-】
【U2O72-】
六价铀化合物,如硝酸铀酰(UO2(NO3)2)、UF6(常用来通过离心分离铀的同位素)等
最稳定的价态
●银白色锕系金属,有比钍强的放射性,十分活泼,在空气中生成氧化膜而变暗;粉末状的可以在空气和水中自燃●剧毒●用作核燃料
+4【U4+】
四价铀化合物,如UO2、UCl4等
+3【U3+】
三价铀化合物,如UCl3等
强还原剂,缓慢和水反应放出H2
镅Am
+3(水溶液中最稳定)、+4、+5、+6【Am3+,AmF62-,AmO2+,AmO22+】
(不作要求)
+3、+4价态粉红色至红色;+5、+6黄棕色
●银白色锕系金属,有比铀强的放射性●极毒●用于烟雾报警器中
说明:
1.在表示化合物的价态时,除了用“高”、“亚”、“次”等字来表示,还可以用带有括号的罗马数字表示,如“氯化亚铁”可以表示为“氯化铁(II)”,读作“氯化铁二”或“氯化二价铁”,但因为二价铁有专用的“亚铁”来表示,因此通常读作并写作“氯化亚铁”。
2.本表仅适用于准备竞赛和基础好并且感兴趣的同学,有少量内容会和教科书上所示的不同,考试时以教科书和考纲为准
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中 阶段 常见 元素 化合价
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《酒店人力资源管理》教案.docx
《酒店人力资源管理》教案.docx
