 药品研制情况申报表详解.docx
药品研制情况申报表详解.docx
- 文档编号:22793246
- 上传时间:2023-04-28
- 格式:DOCX
- 页数:12
- 大小:18.86KB
药品研制情况申报表详解.docx
《药品研制情况申报表详解.docx》由会员分享,可在线阅读,更多相关《药品研制情况申报表详解.docx(12页珍藏版)》请在冰豆网上搜索。
药品研制情况申报表详解
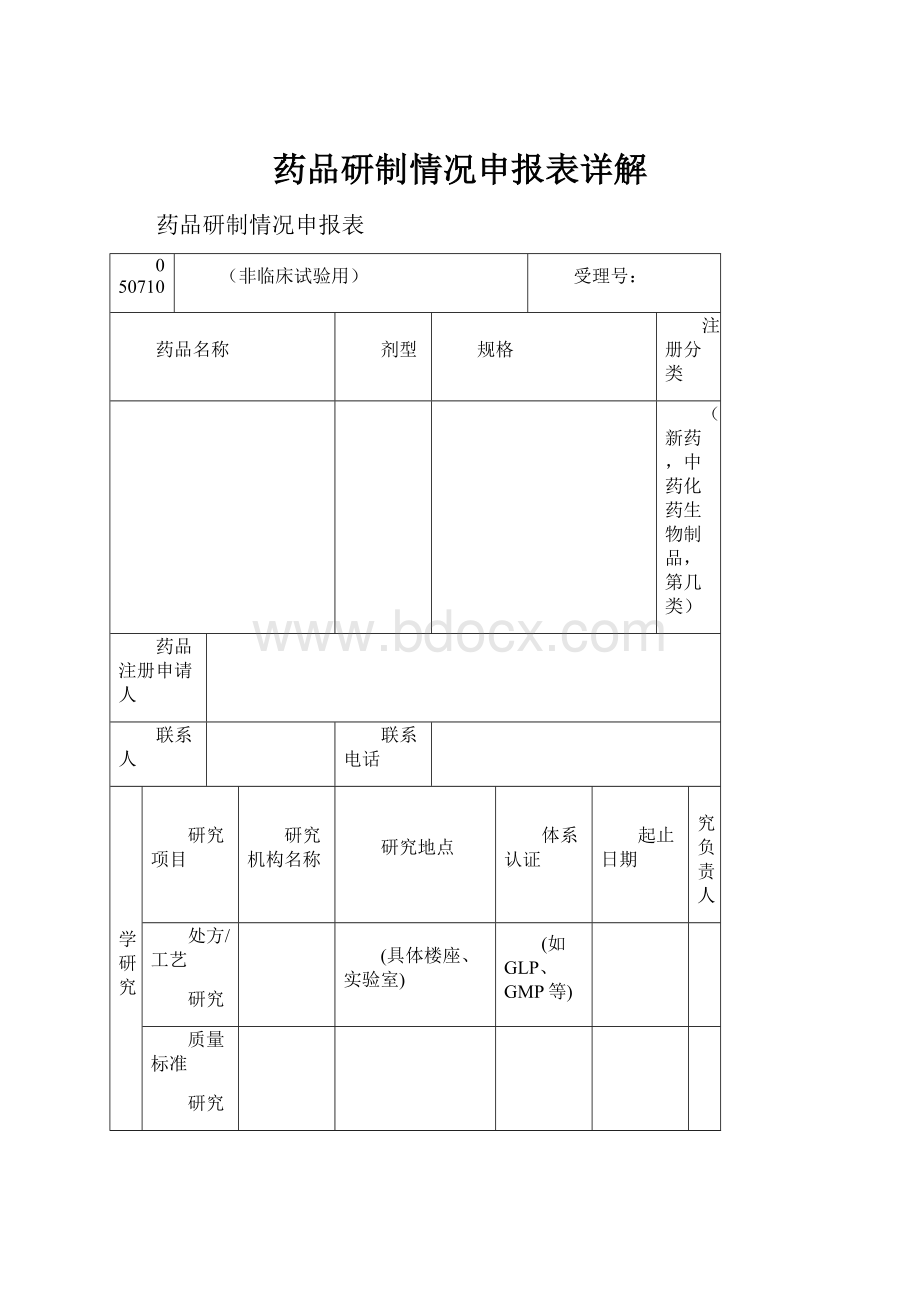
药品研制情况申报表
050710
(非临床试验用)
受理号:
药品名称
剂型
规格
注册分类
(新药,中药化药生物制品,第几类)
药品注册申请人
联系人
联系电话
药学研究
研究项目
研究机构名称
研究地点
体系认证
起止日期
研究负责人
处方/工艺
研究
(具体楼座、实验室)
(如GLP、GMP等)
质量标准
研究
结构确证
研究
样品试制
稳定性
研究
研究主要仪器设备
型号
研究主要仪器设备
型号
(样品试制设备填下页)
对照品/标准品
来源
批号
数量
剩余量
药学研究
原料药/药材
来源
批号
数量
注册情况
样品试制
批号
试制日期
用途
主药投量
试制量
使用量
剩余量
主要设备
试制地点
主要设备
试制地点
(具体楼座、实验室)
试制原始记录共页
负责人(签名)
主要检验仪器
检验地点
主要检验仪器
检验地点
(具体楼座、实验室)
检验原始记录共页
负责人(签名)
药理毒理研究
研究项目
研究机构名称
研究地点
体系认证
起止日期
样品量
研究负责人
药效
一般药理
急性毒性
长期毒性
过敏性
溶血性
局部刺激性
致突变
生殖毒性
致癌性
依赖性
药代动力学
实验动物
来源
清洁级别
数量
合格证号
声明
本报告表中填写内容和所附资料均属实。
如查有不实之处,本机构负法律责任,并承担由此造成一切后果。
机构负责人姓名及签名:
药品注册申请人加盖公章
年月日
注:
其他需要说明情况可另附页。
本表一式四份,其中三份原件,受理省局存一份原件。
药品研制情况核查报告表
050710
(非临床试验用)
受理号:
药品名称
注册分类
药品注册
申请人
(公章)
规格
核查地址
申请机构
负责人
(签名)
核查情况
试制原始记录:
符合要求□基本符合要求□不符合要求□
试制设施:
适应□基本适应□不适应□
样品试制数量:
满足研究需要□基本满足需要□不能满足需要□
检验原始记录:
符合要求□基本符合要求□不符合要求□
检验仪器:
适应□基本适应□不适应□
研制项目以下项目是否和申报资料及《药品研制情况申报表》一致
处方/工艺研究:
一致□基本一致□不一致□
质量标准研究:
一致□基本一致□不一致□
结构确证:
一致□基本一致□不一致□
稳定性研究:
一致□基本一致□不一致□
原料药/药材来源:
一致□基本一致□不一致□
对照品/标准品:
一致□基本一致□不一致□
药效研究:
一致□基本一致□不一致□
药理研究:
一致□基本一致□不一致□
急性毒性研究:
一致□基本一致□不一致□
长期毒性研究:
一致□基本一致□不一致□
过敏性研究:
一致□基本一致□不一致□
溶血性研究:
一致□基本一致□不一致□
局部刺激性研究:
一致□基本一致□不一致□
致突变研究:
一致□基本一致□不一致□
生殖毒性研究:
一致□基本一致□不一致□
致癌性研究:
一致□基本一致□不一致□
依赖性研究:
一致□基本一致□不一致□
药代动力学研究:
一致□基本一致□不一致□
研制工作存在问题:
核查中发现问题:
综合评价:
各核查人
(签名)
(省局公章)
核查部门负责人
(签名)
省局负责人
(签名)
年月日
药品研制情况申报表
050710
(临床试验后用)
受理号:
药品名称
剂型
规格
注册分类
(新药,中药化药生物制品,第几类)
药品注册申请人
联系人
联系电话
药学研究
研究项目
研究机构名称
研究地点
体系认证
起止日期
研究负责人
处方/工艺
补充研究
(具体楼座、实验室)
(如GLP、GMP等)
质量标准
补充研究
药学研究用样品试制
临床试验用
样品试制
稳定性
补充研究
研究主要仪器设备
型号
研究主要仪器设备
型号
(样品试制设备填下页)
样品试制
批号
试制日期
用途
主药投量
试制量
使用量
剩余量
样品试制
主要设备
试制地点
主要设备
试制地点
(具体楼座、实验室)
试制原始记录共页
负责人(签名)
主要检验仪器
检验地点
主要检验仪器
检验地点
(具体楼座、实验室)
检验原始记录共页
负责人(签名)
临床试验
项目
试验机构名称
地址
体系认证
起止日期
样品量
主要研究者
(如生物利用度测试、II期临床等)
声明
本报告表中填写内容和所附资料均属实。
如查有不实之处,本机构负法律责任,并承担由此造成一切后果。
机构负责人姓名及签名:
药品注册申请人加盖公章
年月日
注:
其他需要说明情况可另附页。
本表一式四份,其中三份原件,受理省局存一份原件。
药品研制情况核查报告表
050710
(临床试验后用)
受理号:
药品名称
注册分类
药品注册
申请人
(公章)
规格
核查地址
申请机构
负责人
(签名)
核查情况
试制原始记录:
符合要求□基本符合要求□不符合要求□
试制设施:
适应□基本适应□不适应□
药学研究样品试制量:
符合申报要求□基本满足要求□不能满足要求□
临床试验样品试制量:
满足研究需要□基本满足需要□不能满足需要□
检验原始记录:
符合要求□基本符合要求□不符合要求□
检验仪器:
适应□基本适应□不适应□
研制项目以下项目是否和申报资料及《药品研制情况申报表》一致
处方/工艺补充研究:
一致□基本一致□不一致□
质量标准补充研究:
一致□基本一致□不一致□
稳定性补充研究:
一致□基本一致□不一致□
临床试验:
一致□基本一致□不一致□
研制工作存在问题:
核查中发现问题:
综合评价:
各核查人
(签名)
(省局公章)
核查部门负责人
(签名)
省局负责人
(签名)
年月日
附件五:
药品注册检验样品封签(样式)
样品封签
药品注册检验
品名:
批号:
试制机构:
抽样人员:
被抽样机构经手人:
抽样签封日期:
注:
签封时应加盖加盖食品药品监督管理部门受理审查专用章和被抽样机构公章
封签规格:
大封签:
长30cm,宽10cm。
小封签:
长20cm,宽6cm。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 药品 研制 情况 申报 详解
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 #全自动电容电感测试仪.docx
#全自动电容电感测试仪.docx
![机动车检测人员试题库[含答案].doc](/Images/s.gif)