 高一化学必修一非金属及其化合物资料及习题Word文件下载.docx
高一化学必修一非金属及其化合物资料及习题Word文件下载.docx
- 文档编号:22245997
- 上传时间:2023-02-03
- 格式:DOCX
- 页数:24
- 大小:131.29KB
高一化学必修一非金属及其化合物资料及习题Word文件下载.docx
《高一化学必修一非金属及其化合物资料及习题Word文件下载.docx》由会员分享,可在线阅读,更多相关《高一化学必修一非金属及其化合物资料及习题Word文件下载.docx(24页珍藏版)》请在冰豆网上搜索。
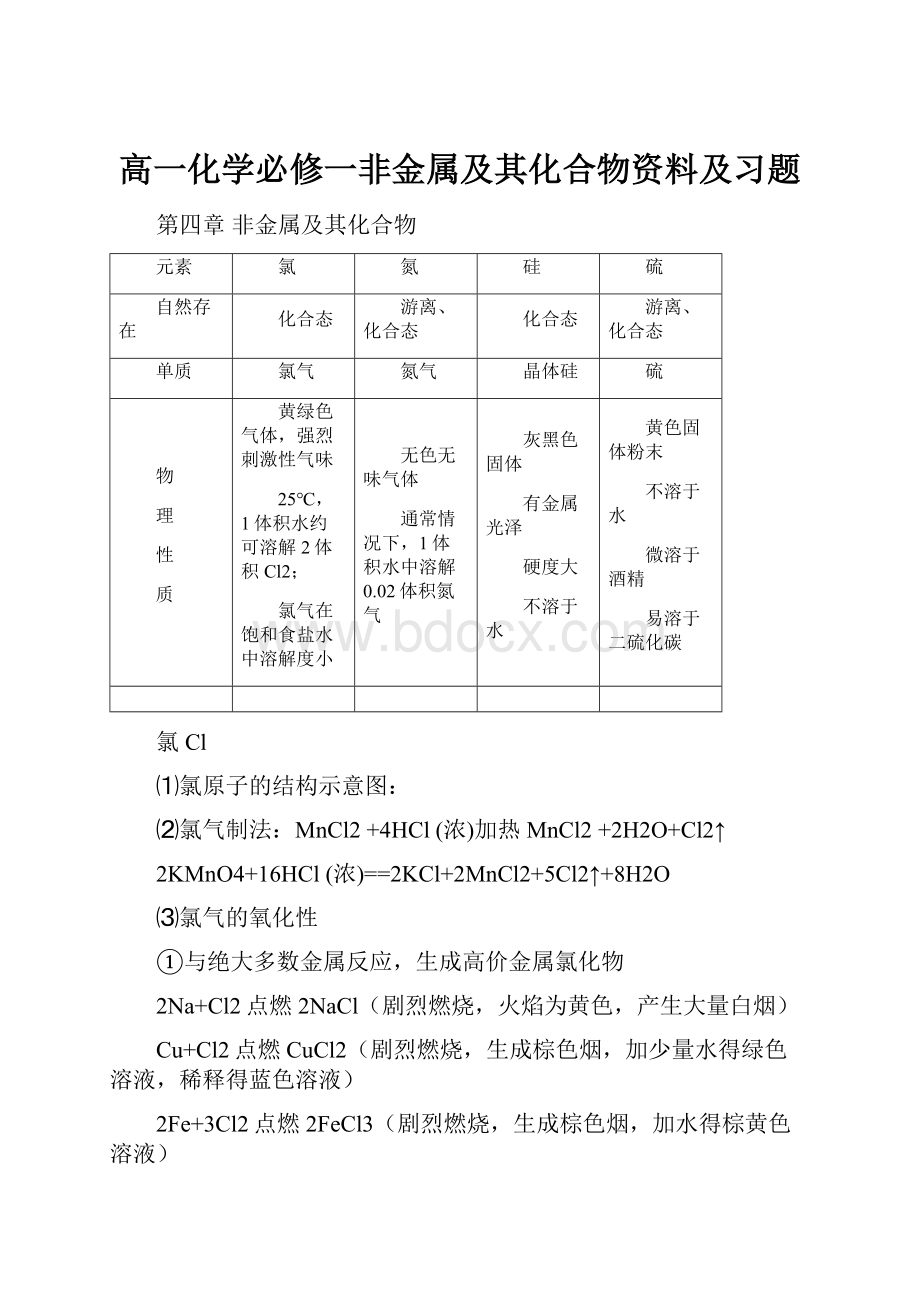
Cl2+H2OHCl+HClO
I氯水的形成:
Cl2通入水中,得到氯水。
一部分Cl2溶于水,一部分Cl2与水反应。
II氯水的成分:
H2O、Cl2、HClO、H+、Cl—、ClO—、OH—。
III新制氯水、久置氯水和液氯的比较
新制氯水
久置氯水
液氯
物质类别
混合物
纯净物
粒子种类
H2O、Cl2、HClO、H+、Cl—、ClO—、OH-
H2O、H+、Cl—、OH—
Cl2
保存方法
棕色瓶、阴凉处
—
低温密闭
⑸与碱反应,生成氯化物、次氯酸盐和水。
Cl2+2NaOH=NaCl+NaClO+H2O(漂白液的有效成分是NaClO)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)
【延伸】漂白液、漂白粉的制备、使用和保存:
1制备原理:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸盐比次氯酸稳定
主要成分:
CaCl2、Ca(ClO)2;
有效成分:
Ca(ClO)2。
若Cl2和Ca(OH)2反应充分,并使Ca(ClO)2成为主要成分,则得到漂粉精。
②使用原理:
漂白粉、漂粉精本身并无漂白性,使用时要将比较稳定的Ca(ClO)2转化为不稳定但具有强氧化性、漂白性的HClO,因此使用漂粉精必须提供酸性环境。
如:
NaClO+HCl=HClO+NaCl或2NaClO+CO2+H2O=Na2CO3+2HClO
Ca(ClO)2+2HCl=CaCl2+2HClO或Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
③保存方法:
密封存放于避光干燥处。
⑹次氯酸(HClO)
①HClO是一元弱酸,酸性比H2CO3还弱,弱电解质。
②HClO不稳定:
2HClO光照2HCl+O2↑。
③HClO有强氧化性。
因而有杀菌、漂白性:
能使染料和有机色质等褪色,Cl2能用作自来水的消毒剂
④HClO与碱发生中和反应(因为:
HClO有强氧化性):
HClO+NaOH=NaClO+H2O
【比较】过氧化钠、次氯酸、二氧化硫和活性炭的漂白作用
过氧化钠
次氯酸
二氧化硫
活性炭
漂白原理
Na2O2将有色物质氧化成无色物质
HClO将有色物质氧化成无色物质
SO2与某些有色物质化合生成不稳定的无色物质
活性炭吸附有色物质
变化类型
化学变化
物理变化
可逆性
不可逆
可逆
硫S
⑴二氧化硫(SO2)
①物理性质:
无色气体,有刺激性气味,密度比空气大,易液化(沸点为:
-10℃),易溶于水(常温常压下,1体积水约能溶解40体积的二氧化硫),有毒。
②化学性质
I具有酸性氧化物的通性
SO2+H2O
H2SO3(可逆反应,H2SO3为中强酸,可使石蕊试液变红)
SO2+CaO=CaSO3
SO2+2NaOH=Na2SO3+H2O(SO2+NaOH=NaHSO3)Na2SO3+H2O+SO2=2NaHSO3
SO2+Ca(OH)2=CaSO3↓+H2OCaSO3+H2O+SO2=Ca(HSO3)2
II既具有氧化性又具有还原性,以还原性为主
a.显示还原性
2SO2+O2
2SO3(可逆反应,用于工业制H2SO4)
SO2+X2+2H2O=2HX+H2SO4(X=Cl、Br、I)(使碘水、溴水褪色)
SO2+NO2=SO3+NOSO2+H2O2=H2SO4
3SO2+2HNO3+2H2O=3H2SO4+2NO
SO2+2Fe3++2H2O=SO42—+2Fe2++4H+
5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+(使高锰酸钾溶液褪色)
b.显示氧化性SO2+2H2S=3S+2H2O
III漂白性:
使品红溶液褪色,加热又恢复原来颜色(可逆性);
SO2不能使紫色石蕊试液褪色;
SO2、Cl2以1:
1混合无漂白性(SO2+Cl2+H2O=H2SO4+2HCl)
⑵三氧化硫(SO3)
①溶于水生成硫酸:
SO2+O22SO3SO3+H2O=H2SO4(工业制硫酸)
②与碱性氧化物或碱反应生成硫酸盐:
SO3+CaO=CaSO4SO3+Ca(OH)2=CaSO4+H2O
⑶硫酸(H2SO4)
现象或反应
体现性质
实际应用
NaCl+H2SO4(浓)=NaHSO4+HCl↑
NaNO3+H2SO4(浓)=NaHSO4+HNO3↑
高沸点物质制低沸点物质
高沸点
酸性
实验室制备HCl、HNO3等
使石蕊试液变红
酸的通性
检验H2SO4的酸性
Zn+H2SO4=ZnSO4+H2↑
实验室制H2
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
金属除锈、生产硫酸盐等
2NaOH+H2SO4=Na2SO4+2H2O
中和碱、生产硫酸盐等
BaCl2+H2SO4=BaSO4↓+2HCl
Ca3(PO4)2+3H2SO4=2H3PO4+3CaSO4
Ca3(PO4)2+2H2SO4=2CaSO4+Ca(H2PO4)2
SO42-的检验,生产磷酸、磷肥
敞口放置的浓硫酸一段时间后质量增加
吸水性
干燥剂,但不能干燥NH3、H2S、HI、HBr
C12H22O11
12C+11H2O
脱水性
使有机物炭化或作脱水剂
C+2H2SO4(浓)△CO2↑+SO2↑+2H2O
S+2H2SO4(浓)△CO2↑+SO2↑+2H2O
2P+5H2SO4(浓)△2H3PO4+5SO2↑+2H2O
Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
铁、铝在冷浓硫酸中“钝化”
强氧化性
铁、铝制容器可以贮运浓硫酸
5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
酸化剂
配制酸性KMnO4溶液
【延伸】①浓硫酸易溶于水并放出大量的热,故稀释浓硫酸时“酸入水且搅拌”。
②常见干燥剂:
五氧化二磷、无水氯化钙、硅胶、碱石灰。
氮N
⑴氮气的稳定性
由于分子结构很稳定,导致通常情况下,氮气的化学性质不活泼,很难与其它物质发生化学反应。
但在一定条件下可以发生如下反应:
N2+3H2
2NH3(工业合成氨)N2+O2
2NO
⑵二氧化氮(NO2)
NO在空气中易与氧气化合生成NO2:
NO+O2=2HNO3+NO
红棕色有刺激性气味的有毒气体,比空气重。
②二氧化氮与水的反应(工业制HNO3):
3NO2+H2O=2HNO3+NO
4NO2+2H2O+O2=4HNO34NO+2H2O+3O2=4HNO3
⑶氨(NH3)
氨气是无色有刺激性气味的气体,密度比空气小,易液化(沸点较高),极易溶于水(常温常压下,1体积水约能溶解700体积的氨气),氨水浓度越大,密度越小。
②实验室制法:
NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑,固热装置,Ca(OH)2,不用NaOH、KOH(易潮解,腐蚀玻璃)
③化学性质:
a)NH3+H2ONH3·
H2O
NH3+H+=NH4+
注意:
I氨水的成分:
H2O、NH3、NH3·
H2O、NH4+、OH-、H+(极少量)。
II氨水的不稳定性:
受热容易逸出NH3。
可以用于实验室制备少量氨气。
NH3·
H2O(浓)
NH3↑+H2O或NH3·
H2O(浓)+CaO=Ca(OH)2+NH3↑
b)NH3·
H2O与AgOH、Cu(OH)2生成可溶的络合物氢氧化二氨和银Ag(NH4)2OH、氢氧化四氨合铜Cu(NH4)4(OH)2
Ag++NH3·
H2O=AgOH↓+NH4+AgOH+2NH3·
H2O=[Ag(NH3)2]++OH-+2H2O
c)NH3具有还原性:
2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl
6NOx+4xNH3=(3+2x)N2+6xH2O4NH3+5O2=4NO+6H2O
⑷铵盐
物理性质
都是晶体,都易溶于水
化学性质
①受热易分解
a)非氧化性酸根铵盐受热分解生成氨气和对应的酸
NH4Cl△NH3↑+HCl↑,NH4HCO3△NH3↑+H2O↑+CO2↑
b)氧化性酸根铵盐受热发生氧化还原反应,不产生氨气
5NH4NO3△4N2+2HNO3+9H2O
②与碱反应生成氨
NH4++OH—=NH3↑+H2O(浓溶液中),
NH4++OH—=NH3·
H2O(稀溶液中)(检验NH4+)
⑸硝酸HNO3
无色、易挥发(沸点83℃)→刺激性气味;
密度大于水,能与水以任意比互溶(不会出现分层现象)。
①稀硝酸使石蕊试液变红,浓硝酸最终使石蕊试液褪色;
②能与金属反应,但无氢气放出;
③能与金属氧化物反应,生成盐和水,但FeO等例外;
④能与金属氢氧化物反应,生成盐和水,但Fe(OH)2等例外;
⑤能与某些盐反应,生成新酸和新盐,但FeCO3、Na2SO3等例外。
①氧化几乎所有金属(除Ag、Pt外):
a)与活动性顺序表中排在H前的金属反应生成对应的盐、NO2和水
Fe+4HNO3=Fe(NO3)3+2NO2↑+2H2O(浓稀HNO3都将Fe氧化到三价)
b)与活动性顺序表中排在H后的金属反应,浓硝酸生成对应的盐、NO2和水,稀硝酸生成对应的盐、NO和水
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(冷浓硝酸使铁、铝“钝化”)
②浓硝酸氧化部分非金属,生成对应的最高价含氧酸、NO2和水:
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
S+6HNO3(浓)加热H2SO4+6NO2↑+2H2O
P+5HNO3(浓)加热H3PO4+5NO2↑+H2O
③氧化一些具有较强还原性的化合物:
H2S→S,HI→I2,HBr→Br2;
SO2→H2SO4,FeO→Fe3+;
Fe(OH)2→Fe3+;
S2—→S,I—→I2,Br—→Br2,SO32—→SO42—,Fe2+→Fe3+。
不稳定性
4HNO3
4NO2↑+O2↑+2H2O(硝酸越浓,越容易分解)
硅Si
⑴硅(Si)
晶体硅单质为灰黑色固体,有金属光泽,硬度大,不溶于水
Si+2F2=SiF4↑Si+4HF=SiF4↑+H2↑
Si+2KOH+H2=K2SiO3+2H2↑
Si+O2加热SiO2Si+2H2高温SiH4Si+C高温SiC3Si+2N2高温Si3N4
③制取
粗硅的制取:
SiO2+2C高温Si+2CO↑(石英砂与焦炭混合)
由粗硅制高纯硅:
Si(粗)+Cl2加热SiCl4SiCl4+2H2高温Si+4HCl
⑵二氧化硅(SiO2)
由原子构成,每个硅原子周围连接4个氧原子
熔、沸点高,硬度大,水晶为无色透明晶体,不溶于水
酸性氧化物的通性:
①SiO2+CaO高温CaSiO3
②SiO2+2NaOH=Na2SiO3+H2O
③SiO2+CaCO3高温CaSiO3+CO2↑
弱氧化性:
SiO2+2C高温Si+2CO↑
特性:
SiO2+4HF=SiF4↑+2H2O
⑶硅酸(H2SiO3)
硅酸是比碳酸更弱的酸,在水中的溶解度很小
H2SiO3+2NaOH=Na2SiO3+2H2O
Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓Na2SiO3+2HCl=2NaCl+H2SiO3↓
⑷硅酸盐
硅酸盐是由硅、氧和金属元素等组成的化合物的总称,在自然界中分布很广。
硅酸盐是一大类结构复杂的固态物质,大多不溶于水,化学性质很稳定。
通常用SiO2和金属氧化物的组合形式表示其组成,如:
硅酸钠(Na2O·
SiO2)、石棉(CaO·
3MgO·
SiO2)、蛇纹石(3MgO·
2SiO2·
2H2O)
最简单的硅酸盐是Na2SiO3,可溶于水,其水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料。
非金属元素及其化合物之间的转换关系
⑴氯及其化合物之间转化关系
⑵氮及其化合物之间转化关系
⑶硫及其化合物之间转化关系
⑷硅及其化合物之间转化关系
可能用到的相对原子质量(原子量):
H1C12O16S32Cl37.5
第I卷
一、选择题(本题共25小题。
每小题2分,共50分,只有一个选项符合题目要求。
)
1.下列物质中,不含有硅酸盐的是()
A.水玻璃B.硅芯片C.黏土D.普通水泥
2.一元硬币的外观有银白色的金属光泽,一些同学认为它可能是铁制成的,为证明其想法,有同学拿磁铁来吸引一下。
就这一过程而言,属于科学探究中的()
A.实验B.假设C.观察D.做结论
3.下列有关环境问题的说法正确的是()
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6—7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
4.由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;
②加熟石灰;
③加盐酸;
④过滤;
⑤浓缩结晶。
其先后顺序正确的是()
A.②④⑤③①B.③②④①⑤C.③④②⑤①D.②④③⑤①
5.食盐、食醋、纯碱均为家庭厨房中常用的物质。
利用这些物质不能完成的实验是()
A.鉴别食盐和纯碱B.验证蛋壳的主要成分为CaCO3
C.除去热水瓶内壁上的水垢D.检验自来水中是否含有Cl—
6.下列氧化还原反应中,水作为氧化剂的是()
A.CO+H2O
CO2+H2B.3NO2+H2O=2HNO3+NO
C.2Na2O2+2H2O=4NaOH+O2↑D.2F2+2H2O=4HF+O2
7.在体积为VL的密闭容器中,通入amolNO和bmolO2,反应后容器内氮原子数和氧原子数之比为()
A.
B.
C.
D.无法确定
8.下列反应中,调节反应物的用量和浓度,可以改变反应产物的是()
A.硅与氢氟酸反应B.铁粉与硫粉混合加热
C.Al2O3与强碱反应D.二氧化碳与氢氧化钠溶液反应
9.在下列反应中,硫酸只表现氧化性的是()
A.Cu+H2SO4(浓)B.C+H2SO4(浓)
C.Ba(OH)2+H2SO4D.FeO+H2SO4(浓)
2,4,6
10.若NA表示阿佛加德罗常数,下列说法正确的是()
A.1molCl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
11.下列实验操作或对实验事实的叙述,正确的是()
A.用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
B.常温下,浓H2SO4可贮存于铁制或铝制容器中
C.用瓷坩锅高温熔融NaOH
D.向溶液中加入盐酸酸化的BaCl2溶液,以确定其中是否含有SO42-
12.质量相等的两份铝粉,分别与足量的氢氧化钠溶液和稀盐酸反应,在同温同压下产生氢气的体积比为()
A.1:
1B.1:
2C.3:
2D.1:
3
13.下列反应的离子方程式正确的是()
A.向Ba(OH)2溶液中滴加稀盐酸:
2H++2Cl-+Ba2++2OH-=2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:
2Fe3++Fe=3Fe2+
C.往澄清石灰水中通入过量二氧化碳:
Ca2++2OH―+CO2=CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:
Fe3++Cu=Fe2++Cu2+
14.下列说法正确的是()
A.镁在空气中和纯净氧气中的燃烧产物只有MgO
B.硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3
C.钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2
D.浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小
15.溴的氧化性介于氯和碘之间。
利用这一性质判断,下列说法正确的是()
A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2
B.将Cl2缓慢通入含有相同物质的量浓度的Br—、I—的混合溶液中,Br—先被氧化
C.湿润的淀粉碘化钾试纸遇到氯气会变蓝色
D.在KBr溶液中加入碘水,发生如下反应:
2Br—+I2=2I—+Br2
16.硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。
现有三种制取硝酸铜的实验方案可供选用
①铜与稀硝酸反应制取:
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2
2CuO,CuO+2HNO3=Cu(NO3)2+H2O
下列说法正确的是()
A.制取等量的硝酸铜,需硝酸的量②最少
B.制取等量的硝酸铜,②产生的有毒气体比①少
C.三种方案中,硝酸的利用率为③>
①>
②
D.三种方案的反应都可以在铁质容器中进行
17.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是()
A.Na+、Mg2+、S2—、ClO—B.H+、Na+、SO42-、NO3—
C.K+、Ca2+、OH—、SO32—D.Na+、K+、Cl-、OH-
18.下列关于硫及含硫化合物的叙述正确的是()
A.SO2的漂白原理与次氯酸相同
B.硫在空气中燃烧生成大量SO3
C.浓硫酸可以干燥H2、NH3、CO2等气体
D.常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸
19.在粗碘中含有IBr和ICl,受热时,I2、ICl、IBr均可升华。
在粗碘中加入一种物质后,再进行升华,可制得精碘,应加入的物质是()
A.KIB.ZnC.KClD.H2O
20.为检验Na2SO3溶液中是否含有Na2SO4应选用的试剂是()
A.BaCl2溶液B.BaCl2溶液、稀盐酸
C.BaCl2溶液、稀硝酸D.BaCl2溶液、稀硫酸
21.某混合气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混合气体依次通过:
(1)澄清石灰水(无浑浊现象),
(2)Ba(OH)2溶液(出现白色沉淀),(3)浓硫酸(无明显变化),(5)灼热的氧化铜(变红),(6)无水硫酸铜(变蓝)。
则可以判断混合气体中()
A.一定没有CO2,肯定有H2B.一定有H2、CO2,和HCl
C.一定有CO、CO2和水蒸气D.可能有CO2、NH3和水蒸气
22.变压器的硅钢片含硅40%,其余为铁,则此硅钢片中硅和铁的原子个数比为4:
3。
向0.7g硅钢片中先加入20g5.0%的烧碱溶液,充分反应后,再向其中加入25mL,10mol/L的浓盐酸,充分搅拌至反应结束,反应中共放出氢气多少克?
( )
A.0.0l B.0.055C.0.02 D.0.045
23.如右图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;
开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
a中溶液
b中溶液
气体X
A
饱和食盐水
KI-淀粉溶液
B
酸性KMnO4溶液
稀品红溶液
SO2
C
饱和NaHS溶液
CuCl2溶液
HCl
D
饱和NaHCO3溶液
石灰水
CO2
24、将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的
浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同):
A、一样多 B、后者较前者多
C、前者较后者多 D、无法比较
25、根据反应式:
(1)2Fe3++2I—===2Fe2++I2
(2)Br2+2Fe2+===2Br—+2Fe3+判断离子的还原性由强到弱的顺序:
A、Br—、Fe2+、I— B、I—、Fe2+、Br—
C、Br—、I—、Fe2+ D、Fe2+、I—、Br—
第Ⅱ卷(非选择题共50分)
二、填空题(本题两小题,共20分)
26.(8分)X、Y、Z、W是中学化学中常见的四种气体。
已知:
X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;
X是化石燃料燃烧的产物之一,是形成酸雨的物质;
Y是一种单质,它的水溶液具有漂白作用;
Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;
W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:
1在水溶液中能发生反应,化学方程式为
;
(2)科学家发现,Z在催化剂条件下能与W反应,反应产物中的单质应是(填化学式)
该反应是氧化还原反应,则其中的氧化剂是(填化学式)。
(3)在Z与水的反应中,氧
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高一化学 必修 非金属 及其 化合 物资 料及 习题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《城市规划基本知识》深刻复习要点.docx
《城市规划基本知识》深刻复习要点.docx
