 11化学用语常用量和化学定律05c测试练习题库考试文档格式.docx
11化学用语常用量和化学定律05c测试练习题库考试文档格式.docx
- 文档编号:21872999
- 上传时间:2023-02-01
- 格式:DOCX
- 页数:62
- 大小:383.90KB
11化学用语常用量和化学定律05c测试练习题库考试文档格式.docx
《11化学用语常用量和化学定律05c测试练习题库考试文档格式.docx》由会员分享,可在线阅读,更多相关《11化学用语常用量和化学定律05c测试练习题库考试文档格式.docx(62页珍藏版)》请在冰豆网上搜索。
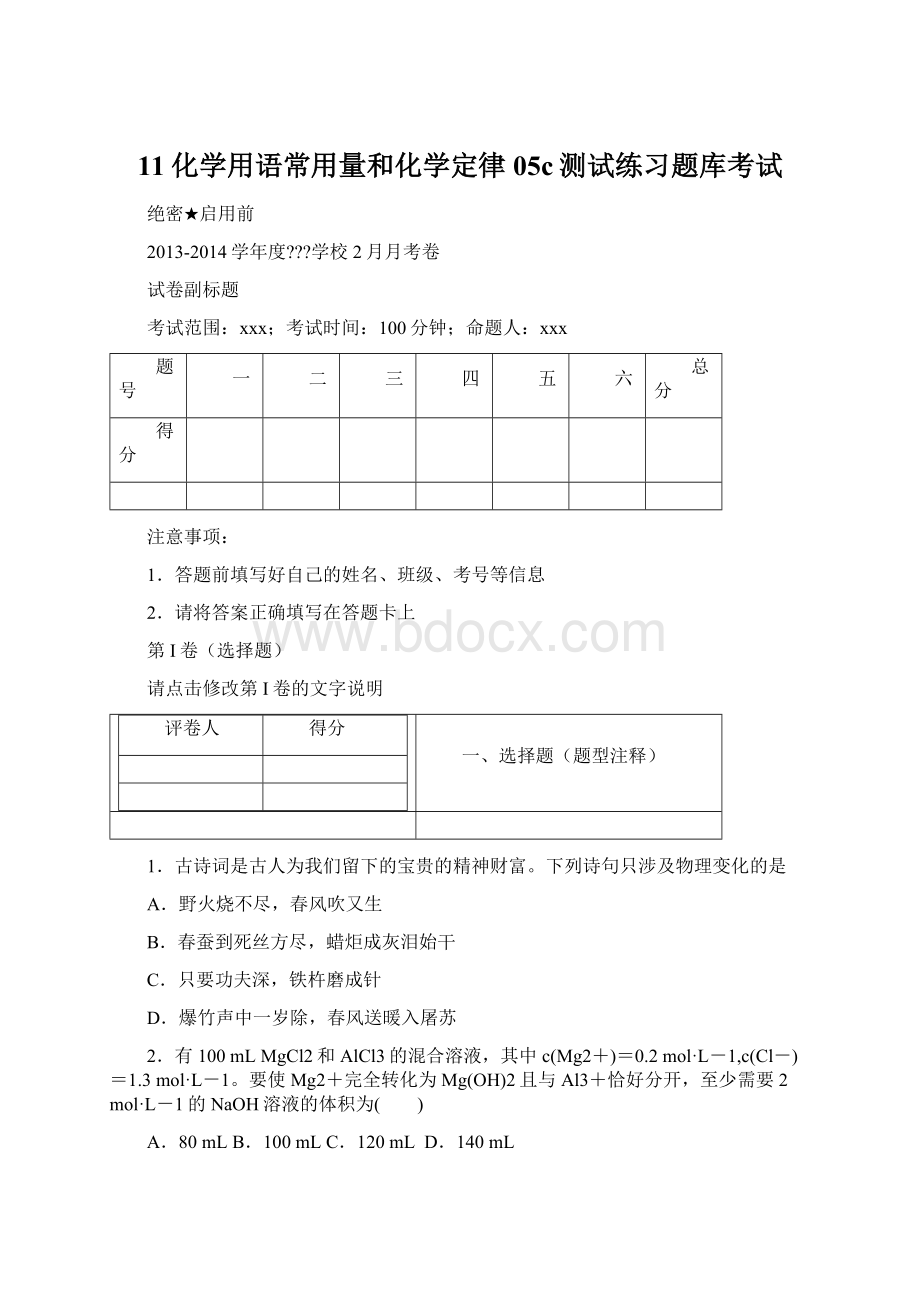
3.用
表示阿伏加德罗常数的值。
下列叙述正确的是()
A.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
B.常温常压下,每生成
时转移的电子数为
C.常温常压下,46g二氧化氮和四氧化二氮混合物中含
个原子
D.1mol含5个碳原子的有机物,最多形成碳碳单键数为
4.设NA为阿伏加德罗常数的值,下列说法正确的是
A.lmol氧气与金属钠反应,氧气得到的电子数一定是4NA
B.常温下,92gNO2和N2O4混合气体中含有氧原子数为2NA
C.在H2O2+Cl2==2HCl+O2反应中,每生成16g氧气,则转移电子数为2NA
D.100mL18.4mol·
L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92NA
5.在标准状况下,若
L甲烷中含有的氢原子个数为
,则阿伏加德罗常数可表示为( )
A.
B.
C.
D.
6.(10分)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。
它们之间的反应关系如下图:
(1)5种化合物分别是V 、W 、X 、Y 、Z :
(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 :
(3)V的电子式是 。
7.下列有关化学用语和表述正确的是:
A.元素铯的两种核素137Cs比133Cs多4个质子
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
13153I
D.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×
75.77%+36.966×
24.23%
=35.453中,75.77%表示35Cl的质量分数,35.453表示氯元素的相对原子质量
8.下列化学用语书写正确的是
A.氯原子的结构示意图:
B.作为相对原子质量测定标准的碳核素:
614C
C.氯化镁的电子式:
D.甲烷的结构式:
CH4
9.下列溶液中有关物质的量浓度关系和计算不正确的是()
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<
c(NaHCO3)
<
c(CH3COONa)
B.已知25°
C时
,则在0.1mol·
L-1AlCl3溶液中,Ag+的物质
的量浓度最大可达到
mol·
L-1
C.25°
时,0.1mol·
L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·
L-1NaOH溶
液中水电离出来的OH-浓度
D.室温下,0.1mol·
L-1NaHA溶液的pH=4,则有
10.下列各组物质中,所含分子数一定相同的是
A.2g
H2和16
g
O2
B.0.1molHCl和2.24LAr
C.150℃、1.01×
105
Pa时,1L
CO2和1LH2O
D.28g
CO和6.02×
1022个O3
11.下列描述中,符合化学科学的是
A.“曾青得铁则化为铜”中的“曾青”是指硝酸铜
B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C.“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D.“春蚕到死丝方尽。
蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
12.由CO2、H2S、CO组成的混合气体的密度在同温、同压下是氢气密度的17倍,则该混合气体中二氧化碳、硫化氢、一氧化碳的体积比为
A.3∶7∶8B.5∶11∶3C.3∶11∶5D.7∶2∶13
13.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是()
1molNH3所含有的原子数为NA
B、常温常压下,22.4L氧气所含的原子数为2NA
C、常温常压下,48gO3所含的氧原子数为3NA
D、1L0.1mol/LNaCL溶液中所含的Na+为NA
14.下列有关物质的量浓度的相关说法中错误的是()
A.将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L
B.将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L
C.将10mL0.1mol/LNaCl溶液和90mL水混合,所得溶液物质的量浓度约为0.01mol/L
D.实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g
15.下列有关气体的体积叙述正确的是
A.1mol任何气体的体积都约为22.4L
B.非标准状况下,1mol任何气体的体积都不可能为22.4L
C.标准状况下,1molSO3所占的体积约为22.4L
D.在温度和压强相同的状况下,相同质量的一氧化碳和氮气体积相同
16.印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3
作为“腐蚀液”,生成CuCl2和FeCl2。
若完全反应后,所得溶液中Cu2+和Fe3+的浓度恰好相等。
则已反应的Fe3+和未反应的Fe3+的物质的量之比为()
A.1:
1B.1:
2C.3:
2D.2:
1
17.下列叙述正确的是
A.O2和O3互为同位素,性质相似
B.等质量的碳酸钠和碳酸氢钠粉末分别与足量同浓度的稀盐酸反应,前者产生的二氧化碳多,后者产生二氧化碳的速率慢
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.石墨(s)=金刚石(s)△H>0,所以石墨比金刚石稳定
18.下列化学用语正确的是( )
A、硝基苯的结构简式是
B、乙烯的球棍模型
C、全氟丙烷的电子式F:
C:
FD、CH3-CH=CH2最简式为CH2
19.阿伏加德罗常数约为6.02×
1023mol-1,下列说法正确的是( )
A.2.3g钠与足量丙三醇反应,转移电子数为0.3×
6.02×
1023
B.标准状况下,22.4L乙醇的共价键数为8×
C.标准状况下,5.6L甲醛所含的电子数为4×
D.100mL1mol·
L-1醋酸溶液中,H+的个数为0.1×
20.下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池的负极反应式:
O2+2H2O+4e-=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:
2Cl--2e-=Cl2↑
C.表示乙炔“燃烧热”对应的热化学方程式:
C2H2(g)+
O2(g)=2CO2(g)+H2O(g)△H=-1256kJ/mol
D.M与N是同素异形体,由M=N△H=+119kJ/mol可知,N比M稳定
21.下列各组物质中,所含分子数相同的是()
A、10gH2和10gO2B、5.6LN2和11gCO2
C、9gH2O和0.5molH2D、224mlH2(标况)和0.1molN2
22.NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,等体积的水和CO2,含有的氧原子数目为1∶2
B.含有NA个阴离子的Na2O2与足量水反应,转移电子数为2NA
C.向FeI2溶液中通入适量氯气,当有NA个Fe2+被氧化时,共转移电子数为3NA
D.一个NO分子质量为ag,一个NO2分子质量是bg,则NA个O2的质量为(b—a)NAg
23.现有两份体积相同的混合溶液,其组成如下:
KCl
K2SO4
ZnSO4
ZnCl2
(1)
0.4mol
0.1mol
0.3mol
(2)
0.2mol
则两份溶液中各离子浓度()
A.仅c(K+)相同B.仅c(Cl-)相同C.完全相同D.完全不同
24.将镁、铝、锌、铁四种金属分别与足量的稀盐酸反应,图中各曲线表示的是消耗金属的质量
与产生氢气的质量
之间的关系,其中能代表
质量关系的是
25.相同质量的下列气体中,所含原子数最多的是()
A、CH4B、N2C、COD、O2
26.下列化学用语正确的是()
A.HCl的电子式:
B.氧化铁溶于氢碘酸的离子方程式为:
Fe2O2+6H+=2Fe3++3H2O
C.在电解液为氢氧化钾溶液的甲醇燃料电池内电路中,阳极的电极反应式为:
CH3OH-6e-+8OH-=CO2-3+6H2O
D.表示中和热的热化学方程式:
NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)
△H=-57.3kJ/mol
27.NA代表阿伏加德罗常数,下列说法正确的是()
A、9g重水所含有的电子数为5NA
B、00C、1.01×
105Pa下11.2L已烷完全燃烧所得CO2分子数为3NA
C、7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D、1molC10H22分子中共价键总数为31NA
28.古诗词是古人为我们留下的宝贵精神财富。
下列诗句中只涉及物理变化的是
A.野火烧不尽,春风吹又生
B.千锤万出凿深山,烈火焚烧若等闲
C.只要工夫深,铁杵磨成针
D.春蚕到死丝方尽,蜡炬成灰泪始干
29.下列判断中一定正确的是()
A.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2
B.等质量的O2与O3中,氧原子的个数比为3∶2
C.CaCl2及CaO2固体中阴、阳离子数之比均为2∶1
D.10mL0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1∶3
30.将40ml1mol/L的NaCl与80ml0.5mol/L的NaCl溶液混合后,溶液中Cl-浓度
接近
A.1.5mol/LB.1mol/LC.0.67mol/LD.0.5mol/L
31.在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为
A.
B.
C.8nD.4n
32.某Li+原子核中含有4个中子。
含6.02×
1023个电子的该离子质量是()
A.4/7gB.4.7gC.3.5gD.7/4g
33.设N
A表示阿伏加得德罗常数的数值,下列叙述中正确的是
A.1molNH3所含有的原子数为NA
B.常温常压下,22.4L氧气所含的原子数为2NA
C.常温常压下,48gO3所含的氧原子数为3NA
D.1L0.1mol/LNaCl溶液中所含的Na+为NA
34.下列关于物质的量的说法,错误的是
A.物质的量表示含有一定数目粒子的集体,它的单位是“摩尔”
B.1molH2O约含有6.02×
1023个水分子
C.1molH2O的质量是18g
D.1molH2O蒸汽的体积是22.4L
35.室温下,将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是
A.该溶液的物质的量浓度:
B.所得气体体积为44.8aL
C.该溶液的质量分数:
D.向溶液中通入过量CO2,未见白色沉淀
36.设NA表示阿伏加德罗常数的值,下列说法正确的是()
A.常温常压下,100g98%磷酸溶液中含有的氧原子数为4NA
B.标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH2
C.15gCH3+中含有的电子数为0.8NA
D.1molH2O2分子中非极性共价键数为NA
37.下列说法中正确的是(NA为阿伏加德罗常数)()
A.78gNa2O2晶体中所含阴阳离子个数均为2NA
B.1.5gCH3+中含有的电子数为NA
C.3.4g氨气分子中含有0.6NA个N—H键
D.常温下,100mL1mol·
L-1AlCl3溶液中Al3+离子总数等于0.1NA
38.下列关于阿伏加德罗常数的说法中正确的是
A.阿伏加德罗常数是12g碳中所含的碳原子数
B.阿伏加德罗常数是0.012kg12C中所含的原子数
C.阿伏加德罗常数是6.02×
D.阿伏加德罗常数的符号为NA,近似为6.02×
39.物质是由元素组成的,下列关于元素的说法不正确的是
A.构成地壳基本骨架的非金属元素是O、Si
B.蛋白质中均含C、H、O、N四种元素
C.水晶、陶瓷、玻璃的主要成分都是硅酸盐
D.元素的性质与原子核外电子数和原子核都有关系
40.设NA为阿伏加德罗常数的值。
下列说法正确的是
A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA
B.常温常压下,44g由N2O与CO2组成的混合气体含有的氧原子数目为NA
C.反应NH4N3
2N2↑+2H2↑,常温常压下每生成22.4LN2,转移电子的数目为2NA
D.1L1mol·
L-1的AlCl3溶液中含有Cl-的数目为3NA
41.有一定体积CH4、C2H6、C3H8组成的混合气体,是同温同压下H2密度的15倍。
则混合气体中CH4、C2H6、C3H8的体积比不可能是:
A.2∶1∶2B.2∶3∶1C.1∶4∶1D.5∶3∶5
42.用NA表示阿佛加德罗常数的值,下列叙述中正确的是( )
A.在标准状况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA
B.常温常压下,30g乙酸与30g葡萄糖含有的氧原子数都是NA
C.1mol-OH所含的电子数为17NA
D.1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA
43.下列各溶液中NO3-物质的量浓度最大的是
A、20mL2moL/LMg(NO3)2
B、100mL2.5mot/LNaNO3
C、25mL1.0mol/LAl(NO3)3
D、30mL2.5mol/LNH4NO3
44.用NA表示阿伏加德罗常数的值,下列说法正确的是
A、标准状况下,11.2L的水中含有0.5个NA水分子
B、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA
C、1molH2和O2的混合气体中含NA个分子
D、11.2LNH3中所含的原子数目为2NA
45.下图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A和B的混合气体,则C中n(A)∶n(B)为
A.2∶1B.1∶2C.1∶1D.任意比
46.将9.58gNa2CO3·
10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L。
再取同质量的混合物,充分加热至质量不变时,所得固体的质量为:
()
A.5.30gB.7.78gC.6.72gD.6g
47.用NA代表阿伏加德罗常数,下列说法正确的是()
A.12g金刚石中所含的共价键数为4NA
B.标准状况下,11.2LH2O所含的分子数为0.5NA
C.46gNO2和N2O4的混合物含有的氮原子数为2NA
D.0.1molO22-所含的电子数为1.8NA
48.用NA表示阿伏加德罗常数的值。
A.标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B.3.6g重水中含有的中子数为2NA
C.一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2NA
D.常温下,1L1mol·
L-1的CH3COOH溶液中,所含溶质分子数小于NA
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题(题型注释)
49.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。
漂白粉是常用的消毒剂。
1、工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
2、漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为。
3、以上涉及的物质中,属于共价化合物的有(填两种)
属于离子化合物的有(填两种),既有离子键又有共价键的物质有((填一种))
4、写出:
CaCl2的电子式H2O的结构式
50.(5分)在分组实验中,某同学配制了两瓶物质的量浓度相等的HCl溶液和CH3COOH溶液,装瓶后忘记了贴标签。
为了区分这两瓶试剂,他利用所学知识设计了三种方法检验。
(1)方法一:
导电性检测法(通过两种溶液的导电性不同导致小灯泡亮度不相同判断),实验中小灯泡较亮的导电溶液是。
(2)方法二:
pH检测法(通过比较相同体积的两种溶液的pH大小判断,该方法的具体操作步骤是
,pH大的是。
(3)通过化学反应观察法(通过比较两种溶液与Zn粒反应产生H2的速率判断),投入相同纯度和形状的Zn粒,开始时产生H2的速率:
HCl溶液 CH3COOH溶液(填“>”、“<”、“=”)。
51.往AgNO3溶液中加入某浓度的盐酸(密度为1.12g/ml),至恰好沉淀完全,此时溶液的质量与原AgNO3溶液的质量相同,则此盐酸溶液的质量分数为_______,物质的量浓度为_______________。
52.27.0g水中含有的水分子数为_______________。
若1.0gH2O中含有n个水分子,则阿伏加德罗常数(NA)可表示为____________________。
53.
(1)完成下列基本计算:
①3.6gH2O的物质的量为 mol;
②分子数为3.01×
1023的H2的物质的量为 mol;
③标准状况下,8.96LN2的物质的量为 mol;
④75mL2.0mol·
L-1CaCl2溶液中含CaCl2 mol。
(2)选出下列各小题物质分离或提纯所依据的物理性质和分离方法。
性质差异
分离方法
①除去氯化钠溶液中的泥沙
②用四氯化碳提取溴水中的溴单质
③分离乙酸(沸点1180C)与乙酸乙酯(沸点77.10C)
④分离汽油和水
⑤从含有少量NaCl的KNO3溶液中提取KNO3
性质差异:
A、溶解度随温度变化差异 B、在不同溶剂中的溶解度差异
C、沸点差异 D、互不相溶E、在水中的溶解度差异
分离方法:
a、蒸馏b、过滤c、分液d、萃取e、结晶
(3)工业电解食盐水制取氯气的化学方程式:
。
54.人造空气(氧气和氦气的混合气体)可用于减轻某些疾病或供深水潜水员使用。
在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气和体积比是______,氧气的质量是______。
55.将100mL0.2mol/L的盐酸与100mL0.3mol/L的盐酸混合(假设混合时体积变化忽略不计),求
(1)混合后盐酸溶液的物质的量浓度为
(2)若欲将该200mL盐酸溶液浓度重新恢复为0.3mol/L,则需要向其中通入标况下的HCl气体L(体积变化忽略不计)
56.
(1)37Cl—离子结构示意图,质量相等的两种物质SO2和SO3,所含氧原子个数之
为;
(2)20.6gNaR含有Na+0.2mol,则NaR的摩尔质量为,则含R8.0g的NaR的物质的量为;
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为_________L,它与标准状况下________L硫化氢(H2S)含有相同数目的氢原子;
(4)在100g浓度为18mol·
L-1、密度为ρ(g·
cm–3)的浓硫酸中加入一定量的水稀释成9mol·
L-1的硫酸,则加入水的体积100mL(填“>”、“<”、“=”)
1.12g
58.相对分子质量为M的某物质在室温下的溶解度为Sg,此时测得饱和溶液的密度为
g/cm3,则该饱和溶液的物质的量浓度为
59.(5分)0.5molH2SO4的质量是________g,含______________个分子,含________mol氧原子,能和________molNaOH完全反应,该硫酸所含氢元素的质量与________gHCl中所含氢元素的质量相同。
60.请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1时,原子总数之比为,质量之比为。
(2)中和含0.2molHCl的稀盐酸,需NaOH的质量为g。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·
mol—1,则:
①该气体的物质的量为mol。
②该气体在标准状况下的体积为L。
③该气体溶于水后形成VL溶液(不考虑反应),其溶液的物质的量浓度为mol·
L—1。
(4)将5mol/L的Mg(NO3)2溶液amL稀释至bmL,稀释后溶液中NO3-的物质的量浓度是mol·
(5)用等体积的0.1mol·
L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为。
61.(6分)已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:
XY、X2Y、X3Y。
为确定C的化
学,某同学分别取同温同压下,体积都为V1的X2和Y2两种气体充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温后,再测出容器的容积(V2)。
请填写下列结论与分析
(1)若实验结果(用V1、V2间关系来表示)是___________,则生成物C的化学式为XY,判断的依据是_____________________________________________________
(2)当生成物C的化学式为X2Y时,则实验结果是_____________,生成C的化学方程式为____________
62.(8分)在标
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 11 化学 用语 常用 定律 05 测试 练习 题库 考试
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
 标杆地产公司薪酬体系以龙湖、万科、华夏幸福为典范PPT资料.ppt
标杆地产公司薪酬体系以龙湖、万科、华夏幸福为典范PPT资料.ppt
