 强烈推荐培南原料药生产GMP认证可研报告Word格式.docx
强烈推荐培南原料药生产GMP认证可研报告Word格式.docx
- 文档编号:21582574
- 上传时间:2023-01-31
- 格式:DOCX
- 页数:21
- 大小:40.75KB
强烈推荐培南原料药生产GMP认证可研报告Word格式.docx
《强烈推荐培南原料药生产GMP认证可研报告Word格式.docx》由会员分享,可在线阅读,更多相关《强烈推荐培南原料药生产GMP认证可研报告Word格式.docx(21页珍藏版)》请在冰豆网上搜索。
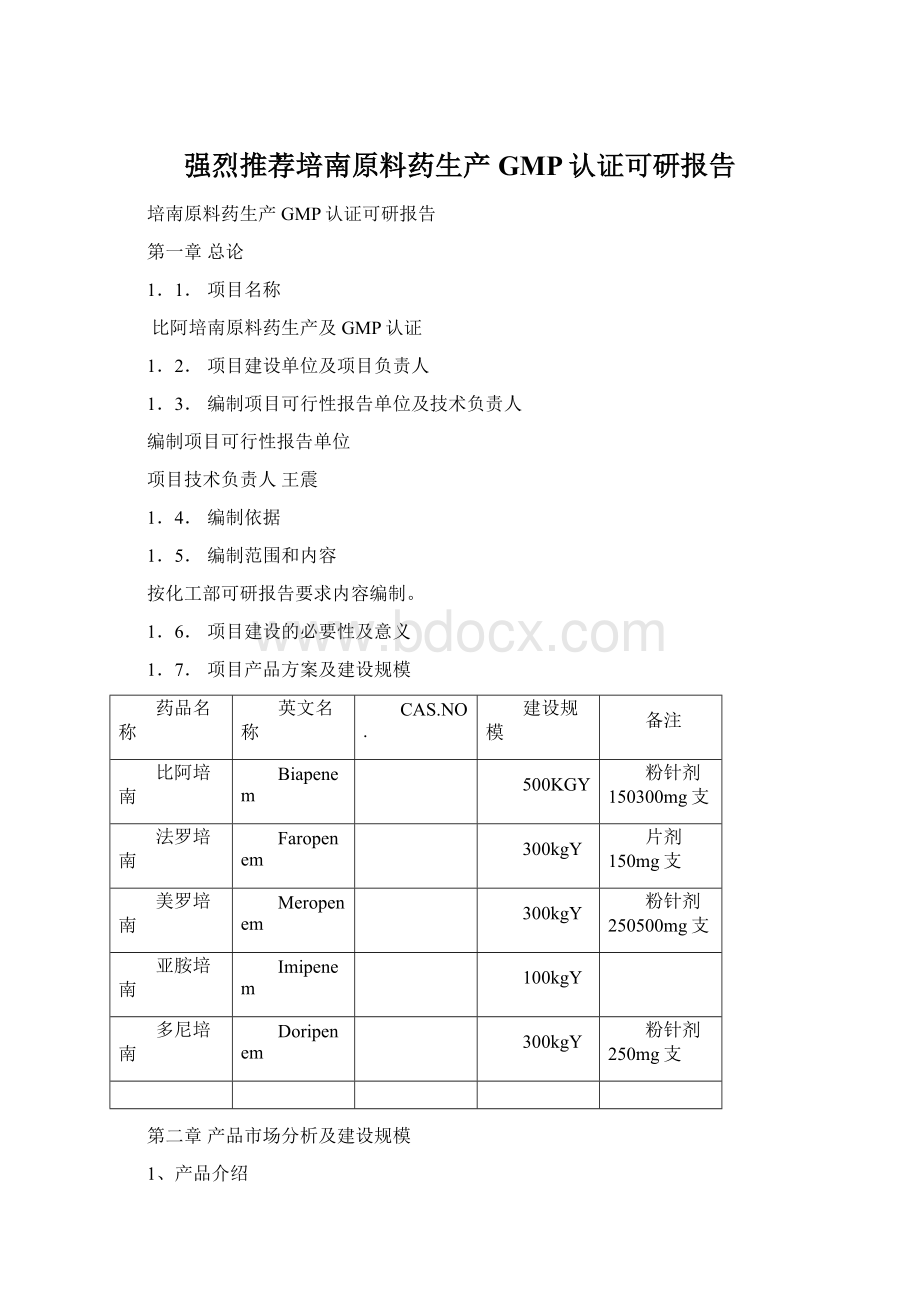
粉针剂250500mg支
亚胺培南
Imipenem
100kgY
多尼培南
Doripenem
粉针剂250mg支
第二章产品市场分析及建设规模
1、产品介绍
中文名称
英文名称Biapenem
化学名(-)-6-[(4R,5S,6S)-2-羧基-6-[(R)-1-羟基乙基]-4-甲基-7-氧代-1-氮杂二环[3.2.0]庚-2-烯-3-基]硫基-6,7-二氢-5H-吡唑[1,2-a][1,2,4]三唑-4-鎓内盐(-)-6-[(4R,5S,6S)-2-carboxy-6-[(R)-1-®
,规格0.3g支,目前正在美国、欧州等多国进行III
期临床试验。
研究结果表明,本品对G-和G+菌、厌氧菌等均具有广谱和强效抗菌活性,临床分离1145株,其MIC90范围为0.1~3.13ugml,其抗菌活性比同系物亚胺培南强2倍;
临床分离G+菌456株,其MIC90为0.006~
3.13μgml,其中金葡菌、表葡菌、化脓性链球菌和肺炎球菌对本品高度敏感。
本品对脆弱拟杆菌也有良好抗菌活性,其MIC90为1.56μgml。
对肠道杆菌科,本品抗菌活性强于亚胺培南,对非发酵G-杆菌的抗菌活性,尤其对绿脓杆菌和耐GM的绿脓杆菌的抗菌活性比亚胺培南强2倍。
比阿培南的急性毒性低,小鼠和大鼠iv的LD50>
2000mgkg,狗静脉LD50>1000
mgkg。
大鼠iv
300
或600mg(kg*d),为期1月或3月,未见动物死亡,其毒性反应为腹泻,后期体重下降,停药时病理组织检查肾皮质近曲小管上皮细胞浊肿,脾和盲肠的重量增加,但停药后均能恢复正常。
狗iv
30mg
(kg*d)为期1月和20
mg(kg*d)为期3月属于无毒性反应剂量。
剂量为100~300
mgkg为期1月或60~
200
mgkg为期3月,则有体重减轻和稀便,停药后则恢复正常。
急性肾毒性试验表明,兔iv大剂量头孢噻啶则引起肾毒性,而本品和亚胺培南在等剂量条件下则未见肾损害。
经生殖毒性3个阶段试验,本品对胚胎和幼鼠F1
或F2代的发育和活动均未见异常。
比阿培南经一般药理试验未见明显不良反应。
本品对自主活动、药物诱导催眠或电休克等均未见明显影响,对大鼠体温和炎症痛觉无明显影响。
Hikida等测定比阿培南对多种DHP-1(肾脱氢肽酶)的稳定性,结果表明,本品稳定性良好。
临床应用比阿培南治疗270例对症病人的临床试验的结果如下表:
表
比阿培南对不同适应症的临床效果适
应
症
有
效
率
例数
%呼吸系统感染
慢性呼吸系统病的二次感染肺炎、肺化脓症
51555863
92.792.1
尿路感染
肾盂肾炎复杂性膀胱炎
38447581
86.492.6
腹腔内感染腹膜炎
1517
88.2
妇科感染
子宫附件炎
1010
100
合
计
247270
91.5
而在安全性评价中,2323
例进行了评价,其中57
例(2.5%)具有副作用,症状主要是:
出疹(1.0%)、下痢(含软便)(0.6%)等。
2,262例中出现296例(13.1%,498件)临床检査值的异常变动,主要是:
ALT(GPT)上升138
例(6.2%),AST
(GOT)上升88
例(4.0%),嗜酸性细胞增多75
例(3.7%)等。
4、国内有关该产品研究或生产使用情况据调研
国内尚无厂家生产上市,也未见有进口品用于临床,国外日本于2002年3月首次批准上市,按《药品注册管理办法》规定,应为新药即注册分类3
(1)项。
受理号
厂家
注射用比阿培南
天津市炜杰科技有限公司
石药集团中奇制药技术(石家庄)有限公司
赤峰利诚科技有限责任公司
海口龙南医药科技开发有限公司
贵州海泰药业技术有限公司
山东齐都药业有限公司
海口康力元制药有限公司
长沙市华美医药研究所
山东鲁抗辰欣药业有限公司
深圳市海滨制药有限公司
南京海光应用化学研究所
浙江永宁制药厂
天津市金士力药物研究开发有限公司
沈阳赛捷医药咨询科技开发有限公司
上海医药科技发展有限公司
长沙京天生物医药科技有限公司
山东爱特药物研究有限公司
北京上地新世纪生物医药研究所有限公司
海南友邦福康药物研究所有限公司
北京福瑞康正医药技术研究所
山东诚创医药技术开发有限公司
江苏正大天晴药业股份有限公司
海南先声药业有限公司
其它培南产品国内受理情况
分类
注射用亚胺培南西司他丁钠
中外制药株式会社
3.2
国药集团国瑞药业有限公司
6
法罗培南钠
山东新时代药业有限公司
3.1
法罗培南钠片
注射用美罗培南
石药集团中诺药业(石家庄)有限公司
注射用帕尼培南倍他米隆
三共株式会社
亚胺培南一水合物
浙江金华康恩贝生物制药有限公司
浙江海正药业股份有限公司
住友制药株式会社
法罗培南钠胶囊
北京博尔达生物技术开发有限公司
法罗培南钠颗粒
注射用厄他培南
MerckSharp&
amp;
Dohme(Australia)PtyLtd
注射用法罗培南钠
沈阳药科大学
2
浙江京新药业股份有限公司
海南海灵制药厂有限公司
扬子江药业集团有限公司
法罗培南钠颗粒剂
常州市亚邦医药研究所有限公司
北京上地新世纪生物医药研究所
西安东盛医药研究所
哈尔滨星火药物研究院
海南国栋药物研究所有限公司
法罗培南钠分散片
重庆市莱美药物技术有限公司
法罗培南钠肠溶片
南京振华医药科技开发有限责任公司
中国人民解放军第二炮兵总医院
四川宝光药业股份有限公司
上海衡山药业有限公司
Dohme(Australia)Pty.,Ltd.
沈阳中海生物技术开发有限公司
杭州默沙东制药有限公司
住友制药株式会社北京办事处
CXZ00018
四
CXZ00020
CXZ00019
三共株式会社北京事务所
默沙东(中国)有限公司
成都英创科技发展有限责任公司
5、市场分析
近年来国外从典型的β-内酰胺抗生素研究领域正向非典型的β-内酰胺抗生素研究领域转化。
在对诸如青霉烯、碳青霉烯、氧头孢烯、碳头孢烯的研究中,涌现出了一些很好的品种,从而更增添了广大研究者对该领域的兴趣,上市品种以及处于临床或前期临床研究的品种就多达十几个。
尤其是碳青霉烯类抗生素,已应用于临床的有亚胺培南(imipenem,IPM)、美罗培南(meropenem)、帕尼培南(panipenem)以及拜埃培南等,经临床应用证明对各种细菌感染疗效优异,毒副反应少。
在我国该领域的研究还处在萌芽之中,仅有美罗培南一个品种开发上市。
现选择开发比阿培南意义重大:
A.青霉烯类品种均具有相同的母体—手性的1β-甲基碳青霉烯双环体系,对这一关键中间体的技术突破,将大大促进我们在这一研究领域从仿制药物向创新药物的转变,也为我国β-内酰胺抗生素研究由传统的半合成向全合成研究打下基础,克服我国半合成品种受基本原料制约、成本高、在国际市场上无竞争力的缺陷。
B.过去10年中,细菌对抗生素的耐药性发展很快,病原菌在他求生存的战斗中具有惊人的适应性,一次有一次的造成了临床a几乎无法解决的严重问题。
临床迫切需要抗生素的更新。
比阿培南的问世能为临床提供一个好品种,在一定程度上解决耐药菌问题。
6.建设规模500公斤年
第三章建设条件与厂址选择
1、建设条件
1.1、原料供应所有中间间体化工原料国内均能供应。
1.2、动力供应目前公司内部均可供应。
2、建设厂址
第四章工艺技术条件
一、比阿培南
1、工艺流程
2、细操作步骤
2.1.中间体(B)的制备
将MAP(5.94g,10mmol)和中间体A(2.3g,13mmol)溶于乙腈(18ml),丙酮(18ml)和DMF(1.8ml)的混合液中,降温至0℃滴加N,N-二异丙基乙胺(2.1g,16.3mmol),在0℃下继续搅拌2小时,反应液中析出大量浅黄色的固体,过滤,滤饼用少量二氯甲烷淋洗,真空干燥(<50℃)得浅黄色固体4.6g,收率88.2%.
中间体检测:
TLC:
乙酸乙酯:
石油醚=1:
1原料Rf=0.5产物原点
[α]25D=+54°
文献[α]25D=+55.4°
熔点162~166℃文献163~168℃
2.2.比阿培南的合成
将中间体A(4.2g,8mmol)溶于0.35M磷酸缓冲液(140ml)中,加入锌粉(16.6g,0.254mol),在室温下搅拌1小时后,反应液用硅藻土过滤,滤液用0.1N盐酸调PH5.5后,滤液低温浓缩得油状物,油状物上SP207大孔树脂柱分离,用异丙醇:
水=5:
95洗脱,收集目标产物洗脱液,冷冻(-10℃)干燥得白色固体2.13g,收率76%。
检测:
熔点210~219℃文献210~218℃
HPLC条件:
含量〉99%。
2.3.详细精制方法
比阿无菌工艺过程均在无菌操作间进行
取比阿培南50g,溶于2500ml注射用水中,搅拌使溶解,加入2.5g针用活性炭,搅拌均匀,静置15分钟。
0.22μ滤膜过滤除菌,在滤液中慢加入7500ml无水乙醇(无水乙醇需经过过滤除菌和热源处理),搅拌10分钟,静置2小时析出结晶(保持温度10~30℃),1.2μ有机系滤膜过滤,滤饼在40℃真空干燥,12小时后取样测定,检测合格即得无菌粉末40g,收率80%。
3、产品质量标准(注册标准)
性状本品为白色、类白色或淡黄色粉末或结晶性粉末。
本品在甲酸中易溶;
在水中略溶;
在甲醇、无水乙醇、乙腈中几乎不溶。
比旋度取本品,精密称定,加水溶解并制成每1ml中含比阿培南(C12H14NNaO5S)5mg的溶液,依法测定(中国药典2000年版二部附录VIE),比旋度为-30。
至-36。
。
【鉴别】
(1)取本品10mg,置试管中,加1ml盐酸羟胺试液使溶解,静置3分钟,加1ml酸性硫酸铁铵试液,振摇,溶液应显红棕色或棕色。
(2)取本品适量,用水制成每1ml含20μg的溶液,照分光光度法(附录IVA)测定,在293nm波长处有最大吸收。
(3)本品红外光吸收图谱应与对照品图谱一致(中国药典2000年版二部附录IVC)
【检查】
酸度取本品0.15g,加水10ml溶解,依法测定(中国药典2000年版二部附录VIH),pH值应为4.5~5.8。
溶液的澄清度与颜色取本品0.1g,加水10ml使溶解,溶液应澄清无色;
如显浑浊,与1号浊度标准液(中国药典2000年版二部附录IXB)比较,不得更浓;
如显色,与黄色3号标准比色液(中国药典2000年版二部附录IXA第一法)比较,均不得更深。
有关物质照高效液相色谱法(中国药典2000年版二部附录VD)测定。
(注:
因本品在溶液中不稳定,测定时应随时配制随时测定,并且测定时应先测定供试品溶液,再测定对照品溶液)
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂(4.6mm×
150mm5μ);
以0.02molL磷酸二氢钾溶液(用1molL氢氧化钾溶液调pH5.0):
乙腈=100:
1.5为流动相,检测波长:
216nm;
柱温25℃,流速:
1mlmin,取比阿培南样品适量用水制成约含比阿培南0.5mgml的溶液,进样10μl,理论板数按比阿培南峰计算应不低于2000。
测定法:
取本品约50mg,精密称定,置10ml量瓶中,加流动相溶解并稀释至刻度,做为供试品溶液;
精密量取供试品溶液1ml,置100ml量瓶中,加水至刻度,摇匀,做为对照溶液。
取供试品溶液与对照品溶液各5μl,分别注入液相色谱仪,调节机器灵敏度,使对照溶液主成分的峰高为色谱图满量程的20%~25%,记录供试品溶液色谱图至主成分保留时间的5倍。
供试品溶液如显杂质峰,量取总杂质峰面积(除去空白溶剂产生的杂质峰)与对照溶液主成分峰面积比较,总杂质峰面积不得大于对照溶液主成分峰面积的1.5倍(1.5%)。
干燥失重取本品,在60℃下用五氧化二磷减压干燥至恒重,减失重量不得过0.5%(中国药典2000版二部附录ⅧL)。
炽灼残渣取本品1g,依法检查(中国药典2000版附录ⅧN),遗留残渣不得过0.1%。
重金属取炽灼残渣项下遗留残渣,依法检查(中国药典2000年版二部附录ⅧH第二法),与1.0ml标准铅溶液比较,不得更深。
(百万分之十)
游离磷酸盐的检查取本品约50mg,加水15ml使溶解,加钼酸铵硫酸试液2.5ml与1-氨基-2-萘酚-4-磺酸试液1.0ml,用水稀释成25ml,摇匀。
如显色,与标准磷酸盐溶液(精密称取经105℃干燥至恒重的磷酸二氢钾143.3mg,置1000ml量瓶中,加水使溶解并稀释至刻度,摇匀。
精密量取10ml,置100ml量瓶中,加水稀释至刻度,摇匀,每1ml相当于10ug的PO43-)1.0ml,加水15ml,再加钼酸铵硫酸试液2.5ml与1-氨基-2-萘酚-4-磺酸试液1.0ml,用水稀释成25ml,摇匀制成的对照液比较,不得更深。
(0.02%)
细菌内毒素:
取本品,依法检查(中国药典2000年版附录XIE),每1mg比阿培南中含内毒素的量应小于0.5EU。
无菌:
取本品,分别加入100ml0.9%无菌氯化钠溶液中使溶解,用薄膜过滤法处理后,依法检查(附录XIH),应符合规定。
甲醇、乙醇、异丙醇、乙腈、二氯甲烷、四氢呋喃:
精密称取甲醇、乙醇、丙酮、乙腈、二氯甲烷和四氢呋喃各适量,加水稀释制成每1ml中分别约含甲醇40μg、乙醇200μg、异丙醇40μg、乙腈16.4μg、二氯甲烷24μg和四氢呋喃28.8μg的溶液,作为对照品贮备液。
精密量取对照品贮备液5.0ml置10ml量瓶中,用水稀释至刻度,摇匀,作为对照品溶液;
另取本品约0.2g,精密称定,置10ml量瓶中,加水稀释至刻度,摇匀,作为供试品溶液;
照有机溶剂残留量测定法(中国药典2000版二部附录ⅧP)测定,色谱柱为HP-624(6%氰丙基苯—94%二甲基硅氧烷,30m×
0.53mm×
3µ
m)色谱柱;
柱温40℃;
进样口温度:
180℃;
检测器为氢离子火焰检测器(FID),检测器温度300℃,氢气45mlmin,空气350mlmin,尾吹气为氮气12mlmin;
载气为氮气,流速5mlmin。
照上述色谱条件,取对照品及
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 强烈推荐 原料药 生产 GMP 认证 报告
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 对中国城市家庭的教育投资行为的理论和实证研究.docx
对中国城市家庭的教育投资行为的理论和实证研究.docx
