 陕西省西安市碑林区西安建筑科技大学附属中学学年高一下学期期末考试化学试题Word格式文档下载.docx
陕西省西安市碑林区西安建筑科技大学附属中学学年高一下学期期末考试化学试题Word格式文档下载.docx
- 文档编号:21526560
- 上传时间:2023-01-31
- 格式:DOCX
- 页数:14
- 大小:142.02KB
陕西省西安市碑林区西安建筑科技大学附属中学学年高一下学期期末考试化学试题Word格式文档下载.docx
《陕西省西安市碑林区西安建筑科技大学附属中学学年高一下学期期末考试化学试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《陕西省西安市碑林区西安建筑科技大学附属中学学年高一下学期期末考试化学试题Word格式文档下载.docx(14页珍藏版)》请在冰豆网上搜索。
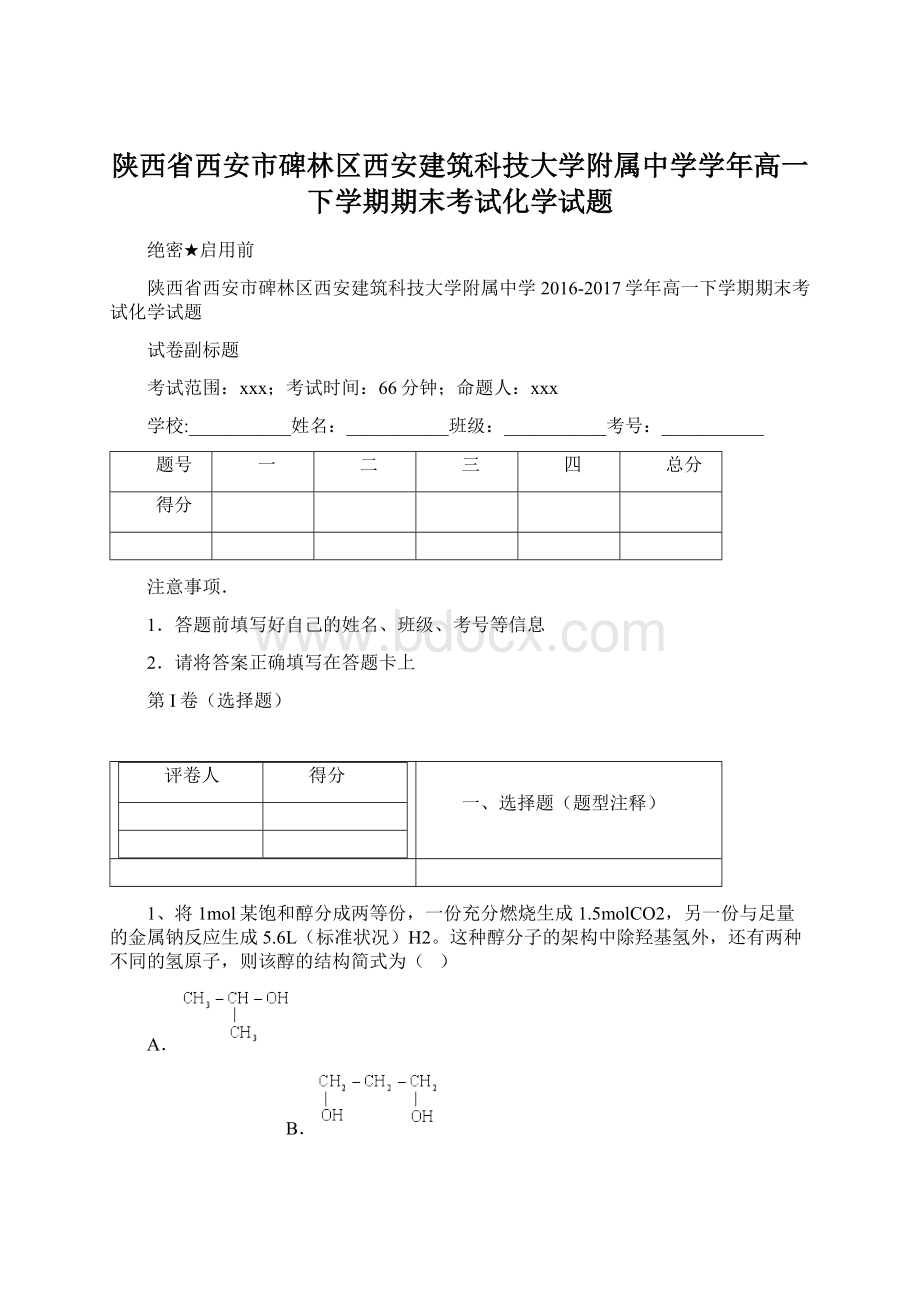
B.2mol
C.2.5mol
D.4mol
3、如图是2004年批量产生的笔记本电脑所用甲醇燃料电池的结构示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2═2CO2+4H2O2。
下列说法正确的是(
A.左电极为电池的正极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质的空气
C.负极反应式为:
CH3OH+H2O-6e-═CO2↑+6H+
D.正极反应式为:
O2+2H2O+4e-═4OH-
4、一定量的锌粉和6mol、L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是(
①石墨
②CuO
③铜粉
④铁粉
⑤浓盐酸
A.①②④
B.①③⑤
C.③④⑤
D.①③④
5、将W1g光亮铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,洗涤、干燥后称其质量为W2g。
下列所插入的物质与铜丝质量关系不正确的是(
A.石灰水Wl<
W2
B.COW1=W2
C.稀H2SO4溶液W1>
D.乙醇W1<
6、如图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子该物能跟下列那些物质反应(
①石蕊
②乙醇
③苯
④金属钠
⑤氧化铜
⑥碳酸钙
⑦氢氧化镁
⑧乙酸
A.①②④⑤⑥⑦
B.②③④⑤
C.①③④⑤⑥⑦
D.全部
7、X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是(
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:
1
D.X2Y可能是离子化合物,也可能是共价化合物
8、同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:
H3ZO4<H2YO4<HXO4,则下列判断正确的是(
A.原子半径X>
Y>
Z
B.非金属性X>
C.阴离子的还原性按X、Y、Z的顺序由强到弱
D.气态氢化物的稳定性按X、Y、Z的顺序由弱到强
9、在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的。
在有关上述工艺流程的以下化学用语中,错误的是(
A.用电子式表示氢溴酸的形成过程为
B.海水中Br的电子式为:
C.海水中通入氯气时反应的离子方程式:
2Br-+Cl2==Br2+2Cl-
D.Cl-的结构示意图为:
10、已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如右图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为(
A.3
B.4
C.5
D.6
11、已知反应A+B=C+D的能量变化如图所示,下列说法正确的是(
)。
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
12、下列物质中,属于天然有机高分子化合物的是(
A.葡萄糖
B.蔗糖
C.淀粉
D.塑料
13、萜品醇可作为消毒剂、抗氧化剂和溶剂,已知α-萜品醇的结构简式如下式,则下列说法错误的是(
A.1mol该物质最多能和1mol氢气发生加成反应
B.该物质不属于烃
C.该物质能使溴水褪色
D.分子式为C9H16O
14、鉴别某种白色织物是否是蚕丝制品,可选用的适宜方法是(
A.滴加盐酸
B.滴加浓硫酸
C.滴加氢氧化钠溶液
D.滴加浓硝酸
15、海水是巨大的化学资源库,下列有关海水综合利用说法正确的是(
A.海水的淡化,只需要经过化学变化就可以得到
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可配备金属Na
D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能
16、某有机物在氧气里充分燃烧,生成CO2和H2O的物质的量之比为1:
1,由此可以得出该有机物(
A.分子中C、H、O的个数之比为1:
2:
3
B.分子中C和H的个数之比为1:
2
C.分子中肯定不含氧原子
D.分子中肯定含有氧原子
17、下列叙述正确的是(
A.40K和40Ca原子中的质子数和中子数都相等
B.某元素原子最外层只有两个电子,它一定是金属元素
C.任何原子或离子的组成中都含有质子
D.同位素的不同核元素物理、化学性质完全相同
18、据科学家预测,月球的土壤中吸附着数百万顿的23He,每百吨23He核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,氦元素主要以24He的形式存在。
A.24He原子核内含有4个质子
B.23He和24He互为同位素
C.23He原子核内含有3个中子
D.24He的最外层电子数为2,所以24He具有较强的金属性
第II卷(非选择题)
二、填空题(题型注释)
19、下列物质的转化或分离是用哪种方法实现的?
A.溶解
B.裂解
C.分馏
D.裂化
E.干馏
F.蒸馏G.电解
H.过滤
I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等__________
(2)从原油中分离处汽油、煤油、柴油等__________
(3)将海水淡化__________
(4)除去粗盐溶液中的泥沙__________
(5)从海水得到的无水MgCl2中提取金属镁__________
(6)海水提溴获得的溴水中,提取溴单质__________
三、简答题(题型注释)
20、氮是地球上富含丰富的一种元素,氮及其化合物的工农业生成、生活中有着重要作用。
请回答下列问题:
(1)如图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(图中涉及物质为气态),请写出NO2和CO反应的热化学方程式____________________。
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示。
则Y是__________,2min内N2的反应速率v(N2)=__________。
(3)已知:
一定量的N2(g)与H2(g)反应,生成2molNH3(g),放出92.2kJ热量。
与依据事实,写出该反应的热化方程式__________。
一定条件下,在密闭容器中充入0.5molN2(g)与1.5molH2(g),二者充分反应后放出热量__________46.1kJ。
(填“>
”、“<
”或“=”)
四、推断题(题型注释)
21、有A、B、C、D四种短周期元素,其原子序数依次增大。
A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。
回答下列问题。
(1)A2B的电子式__________;
A2B2的电子式__________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如右图所示)。
在b电极上发生的反应可表示为:
PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为__________。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。
该元素可与D形成ED2和ED3两种化合物。
将E的单质浸入ED3溶液中,溶液由黄色逐渐变为浅绿色,该反应的离子方程式为________________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池(右图),则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。
石墨除形成原电池的闭合回路外,所起的作用还有:
________________________________________。
22、A是一种气态烃。
B和D是生活中两种常见的有机物。
以A为主要原料合成乙酸乙酯,其中成路线如下图所示:
(1)A制备B的方程式为:
______________________________
(2)B与钠反应的化学放出式为:
______________________________,利用B与钠反应制备氢气,若制得1molH2需要B__________mol。
(3)物质B在空气中可以被氧气为C,此过程的方程式为____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图,图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
①写出加入的试剂(a)是__________,(b)是__________。
②写出有关的操作分离方法:
①是__________,②是__________。
参考答案
1、A
2、C
3、C
4、B
5、D
6、A
7、D
8、B
9、AB
10、B
11、B
12、C
13、D
14、D
15、C
16、C
17、C
18、B
19、
E
C
F
H
G
I
20、
NO2(g)+CO(g)=NO(g)+CO2(g)
ΔH=-234kJ/mol
氢气
0.1mol/(L·
min)
N2(g)+3H2(g)
2NH3(g)
ΔH=-92.2kJ/1mol
<
21、
Pb-2e-+SO42-=PbSO4
Fe+2Fe3+=3Fe2+
2Fe3++2e-=2Fe2+
充当正极材料,形成原电池,氧还分开进行
22、
CH2=CH2+H2O
CH3CH2OH
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
2
2CH3CH2OH+O2
2CH3CHO+2H2O
饱和碳酸钠溶液
H2SO4
分液
蒸馏
【解析】
1、1mol某饱和醇分成两等份,每份为0.5mol,一份充分燃烧生成1.5mol
CO2,根据C原子守恒可知,该醇中C原子数目为
=3,另一份与足量的金属钠反应生成5.6L(标准状况)H2,生成氢气的物质的量为
=0.25mol,故该醇中-OH数目为
=1,故该醇为丙醇,结合该醇分子的结构中除羟基氢外,还有两种不同的氢原子,则该醇为2-丙醇,结构简式为
,故选A。
2、1mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.25mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,所以生成0.25mol一氯甲烷需要氯气0.25mol氯气,生成0.25mol二氯甲烷需要氯气0.5mol,生成0.25mol三氯甲烷需要氯气0.75mol氯气,生成0.25mol四氯化碳需要氯气1mol,所以总共消耗氯气的物质的量=0.25mol+0.5mol+0.75mol+1mol=2.5mol,故选C。
3、A、通过电子的移动方向知,左电极为负极,右点极为正极,燃料电池中,负极上投放燃料,所以a处通入的物质是甲醇,故A错误;
B、右电极是电池的正极,故B错误;
C、负极上投放的燃料,燃料甲醇失电子和水发生氧化反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-═CO2↑+6H+,故C正确;
D、正极上投放的氧化剂,氧化剂得电子和氢离子反应生成水,故D错误;
故选C。
点睛:
本题以甲醇为燃料考查了燃料电池。
注意正负极上电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,如果电解质溶液不同,电极反应式也不同。
4、①加入石墨粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
综上所述,只有B正确,故选B。
本题考查化学反应速率的影响元素,为高频考点,侧重于学生的分析能力的考查。
注意加入氧化铜、Fe粉对氢气总量的影响,是本题的易错点。
5、A.氧化铜和石灰水不反应,所以W2g为氧化铜的质量,W1g为铜丝的质量,所以W1<W2,故A正确;
B.氧化铜和CO反应生成固体铜,所以W2g为铜的质量,W1g为铜的质量,所以W1=W2,故B正确;
C.稀H2SO4和氧化铜反应生成硫酸铜,所以有部分铜元素以离子方式进入溶液,W2g为未参加反应的铜质量,所以W1>W2,故C正确;
D.CH3CH2OH+CuO
CH3CHO+Cu+H2O,固体氧化铜又生成铜,所以W2g为铜的质量,W1g为铜的质量,所以W1=W2,故D错误;
故选D。
本题考查了铜和乙醇的化学性质,明确铜在乙醇催化氧化过程中的作用是解题关键。
解答本题,铜丝在空气中加热反应生成黑色的氧化铜,再根据氧化铜与所给物质是否反应判断W2g为哪种物质的质量即可判断。
6、根据图示,该分子为乙酸,乙酸具有酸性,能够与石蕊指示剂反应,能够与乙醇发生酯化反应,与钠反应放出氢气,将氧化铜溶解,与碳酸钙反应放出二氧化碳,与氢氧化镁发生中和反应,故选A。
本题考查学生利用比例模型来分析CH3COOH分子的性质,明确模型中碳、氢、氧原子的大小及个数是解答本题的关键,解答本题需要熟练掌握乙酸的性质。
7、X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,则X可能为H、Li、Na等元素,Y可能为O、S等元素。
A、当X为H、Li等元素,Y为S元素时,X的原子半径小于Y的原子半径,故A错误;
B、X为Na时,其对应离子为Na+,离子有10个电子,Y为O元素时,其对应的离子为O2-,离子有10个电子,二者具有相同的电子层结构,故B错误;
C、两元素形成的化合物中,原子个数为1:
1的有H2O2或Na2O2,故C错误;
D、化学式为X2Y的有H2O或Na2O或Li2O,可能是离子化合物,也可能是共价化合物,故D正确;
8、同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:
H3ZO4<H2YO4<HXO4,所以非金属性是X>Y>Z。
A.同周期自左向右原子半径逐渐减小,非金属性逐渐增强,故原子半径:
X<Y<Z,故A错误;
B.由上述分析可知,非金属性是X>Y>Z,故B正确;
C.非金属性越强,相应阴离子的还原性越弱,故阴离子的还原性按X、Y、Z的顺序由弱到强,故C错误;
D.非金属性越强,氢化物越稳定,故相应氢化物的稳定性:
X>Y>Z,故D错误;
故选B。
本题考查元素周期律,注意理解同周期元素性质递变规律,知道非金属性强弱判断方法。
由最高价氧化物水化物的酸性顺序有非金属性X>Y>Z,非金属性越强,相应阴离子的还原性越弱。
9、A.溴化氢属于共价化合物。
分子中不存在阴阳离子,用电子式表示氢溴酸的形成过程为
,故A错误;
B.海水中的溴为溴离子,溴离子最外层达到8个电子稳定结构,电子式需要标出阴离子所带电荷及最外层电子,溴离子的电子式为
,故B错误;
C.海水中通入氯气时,氯气将溴离子氧化成溴单质,反应的离子方程式为:
2Br-+Cl2=Br2+2Cl-,故C正确;
D.氯离子最外层达到8电子稳定结构,氯离子的结构示意图为:
,故D正确;
故选AB。
本题考查了电子式、离子方程式、离子结构示意图等化学用语的判断,注意掌握常见化学用语的概念及正确表示方法。
本题的易错点为A,溴化氢为共价化合物。
10、苯的二氯取代物有邻、间、对三种同分异构体,硼氮苯也应该有这三种同分异构体,但考虑苯环上的六个碳原子是完全相同的,而硼氮苯中,B、N是两种不同的原子,所以间位上应有两种不同的排列,所以一共有四种同分异构体,故选B。
11、试题分析:
A、根据图像可知反应物总能量低于生成物总能量,反应是吸热反应,A错误;
B、根据图像可知反应物总能量低于生成物总能量,反应是吸热反应,B正确;
C、根据图像可知反应物总能量低于生成物总能量,C错误;
D、反应条件与反应是放热还是吸热没有关系,D错误,答案选B。
考点:
考查反应热的有关判断
12、A.葡萄糖为单糖,分子式为C6H12O6,相对分子质量较小,不属于高分子化合物,故A不选;
B.蔗糖为二糖,分子式为C12H22O11,相对分子质量较小,不属于天然高分子化合物,故B不选;
C.淀粉为多糖,相对分子质量在10000以上,属于天然高分子化合物,故C选;
D.塑料为高分子合成材料,不属于天然高分子化合物,故D不选;
13、A.含有一个碳碳双键,所以1mol该物质最多能和lmol氢气发生加成反应,故A正确;
B.该分子中除了含有C、H元素外还含有O元素,所以不是烃,属于烃的含氧衍生物,故B正确;
C.含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故C正确;
D.根据结构简式知,其分子式为C10H18O,故D错误;
本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键。
该分子中含有醇羟基、碳碳双键,具有醇和烯烃性质,能发生取代反应、氧化反应、加成反应、还原反应、加聚反应、酯化反应等。
14、蚕丝主要成分是蛋白质,遇浓硝酸可发生颜色反应变黄色,人造纤维中不含蛋白质,无此现象。
15、A、海水淡化主要是通过物理方法分离得到,故A错误;
B、海水晒盐是利用氯化钠溶解度随温度变化不大,溶蒸发溶质析出,过程中无化学变化,故B错误;
C、从海水中可以得到NaCl晶体,电解熔融氯化钠得到金属钠,是工业制备钠的方法,故C正确;
D、海水、铝、空气可以形成原电池反应提供电能,航标灯的原理是将化学能转化为电能,故D错误;
16、A、有机物的质量未给出,无法判断有机物中是否含有氧元素,水蒸气和CO2的物质的量比为1:
1,根据原子守恒可知,有机物中分子中碳、氢原子个数比为1:
2,故A错误;
B、水蒸气和CO2的物质的量比为1:
2,故B正确;
C、有机物的质量未给出,无法判断有机物中是否含有氧元素,故C错误;
D、有机物的质量未给出,无法判断有机物中是否含有氧元素,故D错误;
本题考查利用质量守恒判断有机物元素组成,根据碳元素、氢元素的质量之和与有机物的质量的关系,判断有机物中是否含有氧元素是解答的关键。
17、A.40K中质子数是19,中子数是21;
40Ca中质子数是20,中子数是20,故A错误;
B.最外层有2个电子的元素不一定是金属元素,如:
He原子的最外层有2个电子,但氦是稀有气体元素,故B错误;
C.原子是由原子核和核外电子构成的,原子核由质子和中子构成,原子变成离子,变化的是核外电子,但核内质子不变,所以任何原子或离子的组成中都含有质子,故C正确;
D.同位素的不同核素其核外电子数相同,电子层排布相同,最外层电子决定其化学性质,所以同位素的不同核素的化学性质相同,但物理性质不同,故D错误;
本题考查了原子的构成、同位素的性质等知识点,易错选项是B,明确最外层有2个电子的元素不一定是金属元素。
解答此类试题最好的方法是例举法。
18、A、42He原子核内含有2个质子,故A错误;
B、32He和42He质子数相同中子数不同互为同位素,故B正确;
C、32He原子核内含有1个中子,故C错误;
D、42He的最外层电子数为2,是一种2电子稳定结构,所以42He化学性质不活泼,故D错误;
19、
(1)煤经干馏可得焦炉气、煤焦油和焦炭等,故答案为:
E;
(2)原油经分馏可得汽油、煤油、柴油,故答案为:
C;
(3)从海水中获取淡水,可用蒸馏的方法分离,加热时水蒸发,冷却后可得到纯净水,故答案为:
F;
(4)除去粗盐溶液中的泥沙,可用过滤的方法,故答案为:
H;
(5)Mg为活泼金属,工业用电解MgC12的方法制得单质Mg,故答案为:
G;
(6)海水提溴获得的溴水中,提取溴单质,可用萃取的方法,故答案为:
I。
20、
(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,故答案为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
(2)根据氮气和氢气的反应之比,可知Y为氢气;
2min内N2的反应速率υ(N2)=
=
=0.1mol•L-1•min-1;
故答案为:
H2、0.1mol•L-1•min-1;
(3)根据同一生成2molNH3(g),放出92.2kJ热量,该反应的热化方程式为N2(g)+3H2(g)
ΔH=-92.2kJ/1mol,由于该反应为可逆反应,不能完全进行,0.5molN2(g)与1.5molH2(g),充分反应后放出热量少于46.1kJ,故答案为:
ΔH="
-92.2kJ/1mol"
;
。
A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 陕西省 西安市 碑林 西安 建筑 科技大学 附属中学 学年 一下 学期 期末考试 化学试题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
链接地址:https://www.bdocx.com/doc/21526560.html


 对中国城市家庭的教育投资行为的理论和实证研究.docx
对中国城市家庭的教育投资行为的理论和实证研究.docx
