 中考化学计算题专题训练1Word文档格式.docx
中考化学计算题专题训练1Word文档格式.docx
- 文档编号:21056633
- 上传时间:2023-01-27
- 格式:DOCX
- 页数:15
- 大小:113.87KB
中考化学计算题专题训练1Word文档格式.docx
《中考化学计算题专题训练1Word文档格式.docx》由会员分享,可在线阅读,更多相关《中考化学计算题专题训练1Word文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
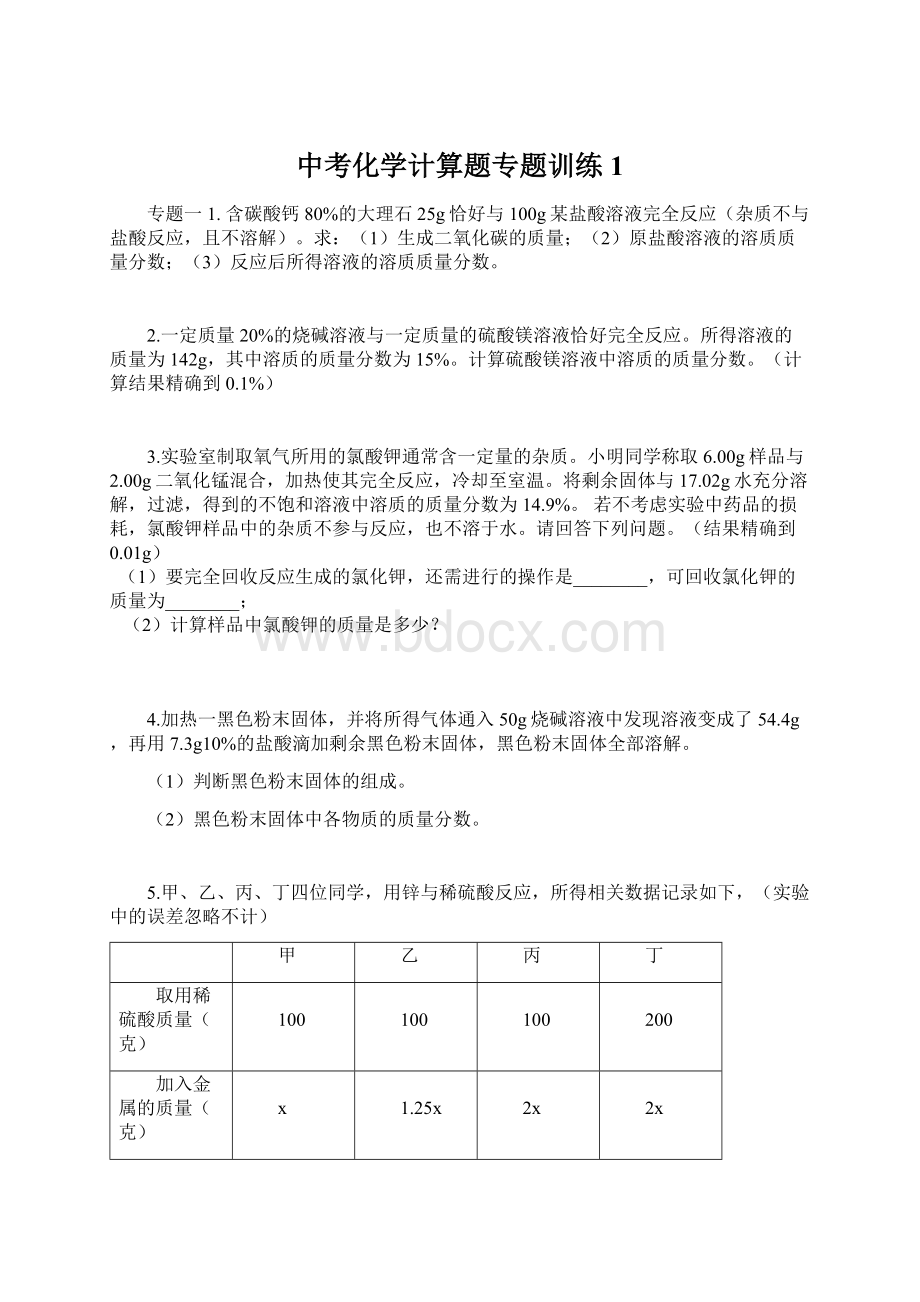
0.6
0.8
⑴甲同学加入金属锌的质量x。
⑵稀硫酸中溶质的质量分数。
6.某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验室中称取生铁屑样品10.0g,放入烧杯中,加入一定质量的稀硫酸,加热,使之充分反应(杂质不参加反应)。
然后冷却、称量。
反应后烧杯中物质的质量比反应前减少了0.34g。
计算:
(1)生铁样品中杂质的含量;
(2)生产100t这种生铁,至少需要含氧化铁80%的赤铁矿多少克?
7.某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取用20g此样品,分四次向其中加入稀盐酸与之充分反应。
每次所用盐酸的体积与反应后剩余固体的质量见下表:
加入稀盐酸的体积/mL
剩余固体的质量/g
1
40
16
2
12
3
8
4
(1)20g此样品中铜的质量;
(2)样品中氧化铜的质量分数;
(3)用氢气充分还原5g此样品可得到固体多少克?
8.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸的反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
第一次
第二次
第三次
所取合金的质量/g
25
50
所用稀硫酸的质量/g
120
160
生成氢气的质量/g
(1)试计算该铜锌合金中锌的质量分数。
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应。
(写出计算过程)
9.将锌粉和铜粉的混合物32.5g加入到93.7g稀硫酸中恰好完全反应,滤出不溶物,将其洗净、干燥,在空气中充分灼烧后,所得固体质量也为32.5g。
(1)原混合物中铜的质量分数;
(2)反应后溶液中溶质的质量分数(滤液损失不计)。
专题二
1.实验室有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成了碳酸钠。
现要用该药品配制10%的氢氧化钠溶液。
取50.6g该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100g氢氧化钡溶液时,碳酸钠恰好反应完全〔Na2CO3+Ba(OH)2=BaCO3↓+2NaOH〕。
(1)50.6g该药品中碳酸钠的质量;
(10.6g)
(2)滤出沉淀后所得溶液中溶质的质量和溶液的质量;
(48g,330.9g)
(3)向所得溶液中再加入多少毫升水才能配制成10%的氢氧化钠溶液?
(149.1mL)
2.某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:
碳酸钠≥96%。
为测定该产品中含碳酸钠的质量分数,进行了以下实验:
取12.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应。
实验数据记录如下:
所加盐酸的次数
第1次
第2次
第3次
第4次
盐酸的质量/g
烧杯及所盛物质总质量/g
181.2
204.4
228.6
253.6
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是g。
(2)该产品中碳酸钠的质量分数是否合格?
(要求写出计算过程,结果精确到0.1%)
3.小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。
现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。
技术员提示小明:
氯化钙与碳酸钠反应的化学方程式:
CaCl2+Na2CO3=CaCO3↓+2NaCl。
(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
4.为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉未于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如右图。
试通过计算完成下列填空:
(不能整除时,结果保留一位小数)(写出解题过程)
(1)该实验取用的样品质量为:
;
(2)样品中铁的质量分数为:
(3)小王不慎在反应结束后,向烧杯中多加了20g稀硫酸,此时,溶液中亚铁离子在溶液总质量中的质量分数为:
,若在上图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的__(填:
上方、下方或线上)。
5.某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量
剩余固体质量
第一次加入10g
mg
第二次加入10g
2.0g
第三次加入10g
1.5g
第四次加入10g
1.0g
第五次加入10g
0.6g
第六次加入10g
(1)测定过程中发生反应的化学方程式为 ;
(2)从以上数据可知,最后剩余的0.6g固体的成分是;
这六次实验中,第次加入稀硫酸时样品中的镁已经完全反应;
表格中,m=。
(3)计算合金样品中镁的质量分数。
(4)计算所用稀硫酸中H2SO4的质量分数。
6.向盛有12.60g碳酸氢钠固体的烧杯中,加入100.5g硫酸溶液恰好反应。
反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示。
烧杯连同药品的起始质量为200.0g。
反应的化学方程式为:
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
回答下列问题:
(1)当碳酸氢钠与硫酸溶液恰好完全反应时,所需的时间约为。
(2)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为。
(3)反应后,所得硫酸钠溶液的溶质质量分数
为多少?
7.在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入Na2CO3溶液的质量关系曲线如图所示:
请根据题意回答问题:
(1)在实验过程中,有气体放出,还可以看到的明显实验现象是
。
(2)在实验过程中放出气体的总质量为
g。
(3)当滴入Na2CO3溶液至图中B点时,通过计算求此所得不饱和溶液中溶质质量分数是多少?
7.已知金属钠和水能发生下列反应:
,现取金属钠4.6g投入到100g水中,充分反应后,冷却到室温(20℃),得到一种不饱和溶液,向所得溶液中逐滴滴滴入MgSO4溶液,实验测得溶液的总质量与滴入MgSO4溶液的质量关系曲线如图所示。
根据题意回答下列问题:
(1)金属钠和水充分反应后,生成氢气的质量为_____g。
(2)图中A点的纵坐标表示的溶液的质量是__________g。
(3)通过计算求出当滴入120gMgSO4溶液时,所得溶液中溶质的质量分数是多少?
(计算结果精确至0.1%)
专题三
1.研究性学习课题:
探究实验室中久置NaOH的变质程度。
研究方案:
先称取13.3gNaOH样品(杂质为Na2CO3),配制成溶液,然后向溶液中逐滴加入溶质质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度。
解决问题:
实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示:
填写下表:
(计算结果保留一位小数)
继续探究:
计算实验过程中与NaOH反应消耗盐酸的质量。
发现问题:
根据求得的与NaOH反应消耗盐酸的质量,对照图像,你发现了什么问题?
2.小意和小思同学对化学计算很有心得。
以下是他们解答一道计算题的实录。
请你一起参与研究并完成相关问题。
(计算结果精确到0.01)
[题目]已知:
,将10g氯酸钾和2g二氧化锰混合后放入试管中加热,收集所需量的氧气后,停止加热让试管冷却,称得试管内剩余固体的质量为7.2g。
求生成氯化钾的质量。
(1)
小意很快得到是的质量(填化学式),进而求出KCl的质量是_____g。
(2)小思依据上述计算的结果发现题目数据有问题。
请你通过简单的计算,论证他的发现。
(3)如何才能更正该题呢?
小意和小思认为有许多方法,例如将题目中“10g氯酸钾”改为“ag氯酸钾”,其他物质的质量不变,则a的取值范围是___________。
3.为测定某地石灰石中碳酸钙的质量分数(假设杂质不参加反应,且不溶于水),某兴趣小组设计了以下三个实验方案:
方案I:
①称取10g石灰石样品;
②先将其高温煅烧至质量不再改变,然后把剩余的固体放在密闭干燥容器中,并冷却至室温,称知制余固体的质量为6.04g。
方案II:
②将其加入100g(足量)质量分数为10%的稀盐酸中,使碳酸钙完全溶解;
③过滤后向滤液中加入150g(过量)质量分数为15%的碳酸钠溶液中;
④将步骤③中的沉淀过滤、洗涤、干燥,称知沉淀的质量9g。
方案III:
②将其加入足量的稀盐酸中,使碳酸钙全部溶解;
③用导气管将生成的气体通入过量的澄清石灰水中;
④将步骤③中生成的沉淀过滤、洗涤、干燥,称知沉淀的质量8.8g。
(1)在方案I中冷却剩余的固体为什么要在密闭、干燥的容器中进行?
(2)某同学根据方案I计算碳酸钙质量分数的过程如下:
设石灰石中碳酸钙的质量为x,则依
解得
进而知,以上解法得出碳酸钙的质量分数已超过了100%,造成计算结果错误的原因是_________,正确的计算结果是___________。
(3)根据方案II求碳酸钙的质量分数时,下列数据中不需要的是___________(填序号)
A.10%100gB.10gC.15%150gD.9g
(4)通过对三个方案中碳酸钙质量分数的计算可知,由方案III算出的碳酸钙的质量分数要比方案I和方案II都低,你认为其中可能的原因是___________(填序号)
A.生成的二氧化碳有一部分溶于水
B.导管中仍有一部分二氧化碳未排出
C.生成的沉淀不应该洗涤和干燥
D.加入的稀盐酸不应足量
(5)请你另外设计一个实验方案来测定石灰石中碳酸钙的质量分数。
(提示:
可从求杂质的角度来分析)
4.我省各地都有丰富的石灰石矿产资源。
有一矿山上的石灰石样品,其中只含杂质二氧化硅(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。
小琳和他的同学想测定该样品中碳酸钙的质量分数,他们取一块石灰石样品,将其粉碎后,称出6g放入烧杯内(烧杯的质量为20g),然后加入50g足量稀盐酸,用玻璃棒搅拌至不再产生气泡为止。
反应所需时间(t)和烧杯及其所盛物质的总质量(m)的关系如图所示。
试回答:
(1)将石灰石样品粉碎的主要目的是
(2)实验结束后,共放出多少二氧化碳?
(3)该石灰石样品中碳酸钙的质量分数是多少?
(计算结果保留1位小数)
5.甲、乙、丙三位同学用下列试剂分别进行实验,均恰好反应完全。
所用试剂及质量见下表。
试剂质量
反应后所
得溶液质量
CaO(固)a1g
10%盐酸b1g
C1
Ca(OH)2(固)a2g
10%盐酸b2g
C2
CaCO3(固)a3g
10%盐酸b3g
C3
已知:
a1+a2+a3=23.04g,b1+b2+b3=189.8g,现将甲、乙、丙三同学所得溶液全部倒入一个容器内,称得此溶液为206.16g,试求:
(1)反应后所得溶液中溶质的质量分数是多少?
(2)参加反应的碳酸钙固体的质量是多少?
(3)反应过程中共生成水的质量是多少?
6.食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠。
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的同学进行了如下实验:
(反应过程中不考虑水和氯化氢的挥发。
)
甲组同学:
称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。
过滤、洗涤、干燥,共得到白色沉淀10.00g。
乙组同学:
取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
加入稀盐酸次数
烧杯及所称物质总质量/g
78.9
97.8
116.7
135.6
5
6
7
155.05
175.05
195.05
(1)请你分别用甲组和乙组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。
(2)计算乙组实验时所用稀盐酸中溶质的质量分数。
7.将3.6g碳酸钙高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,则固体剩余物中氧化钙的质量为多少g。
8.某碳酸钠固体样品中含有少量氯化钠。
某研究性学习小组的同学在探究该固体混合物中碳酸钠的质量分数时,设计并完成以下实验。
①取质量为ag的三个烧杯,各盛放质量分数相同的稀盐酸25g;
②向三个烧杯中分别放入质量不同的固体样品;
③充分反应后,称量烧杯和剩余物的质量。
实验数据如下表。
所称量的物质
实验1
实验2
实验3
烧杯+稀盐酸/g
a+25
加入的固体样品/g
3.2
6.6
7.6
充分反应后,烧杯+剩余物/g
a+27.1
a+29.4
a+30.4
问:
三次实验中,稀盐酸完全反应的是(填实验序号)______。
(1)该固体样品中含碳酸钠的质量分数;
(2)所用盐酸的质量分数。
专题四
1.在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。
请回答下列问题:
(1)产生氢气g,刚开始滴加稀硫酸没有氢气放出的原因是。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。
2.在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入Na2CO3溶液的质量关系曲线如图所示:
(1)在实验过程中,有气体放出,还可以看到的明显实验现象是。
(2)在实验过程中放出气体的总质量为g。
3.某实验小组同学完成制取二氧化碳的实验后,对回收的100g盐酸和氯化钙混合溶液(不含其他杂质)进行如下实验:
取一定量该混合溶液放入烧杯中,再滴入200g溶质质量分数为10.6%的碳酸
钠溶液。
滴入碳酸钠溶液的质量与生成沉淀的质量的关系如右图所示。
⑴滴入碳酸钠溶液时观察到的实验现象:
开始有生成,后来生成。
⑵当滴加碳酸钠溶液到B点时溶液的溶质是:
⑶反应到达A点时溶液中溶质的质量是多少?
4.氯化钙钾石的化学式为KCl·
xCaC12(x是CaCl2的系数)。
它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。
某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加
入Na2CO3溶液的质量关系如下图所示。
(1)写出Na2CO3与CaCl2反应的化学方程式 。
(2)图中AB段表示的意义是 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 g;
②KCl的质量是 g;
③钾元素的质量分数是 。
(4)所用Na2CO3溶液中溶质的质量分数是多少?
(最后一问要求写出计算过程)
5.为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20g,逐滴加入氢氧化钡溶液30g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。
过滤后得滤液47.67g。
请你通过计算
,求出氢氧化钡溶液的溶质质量分数。
可能用到的相对原子质量:
H—1O—16S—32Ba—137
专题四参考答案
1题
(1)0.2盐酸与氧化铝反应
(2)10%
(3)92.52%
4题
(1)Na2CO3+CaCl2=CaCO3↓+2NaCl
(2)CaCl2已完全反应,且Na2CO3溶液过量
(3)11.1 7.45 21.0%
(4)解:
设106gNa2CO3溶液中Na2CO3的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106100
x10g
106:
100=x:
10g
x=10.6g
该所用Na2CO3溶液中Na2CO3的质量分数=10.6g/106g×
100%=10%
答:
所用Na2CO3溶液中Na2CO3的质量分数为10%
5题
解:
设参加反应的Ba(OH)2的质量为x
生成的BaSO4质量为:
20g+30g-47.67g=2.33g
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171233
x2.33g
=
x=1.71g
Ba(OH)2的溶质质量分数=1.71g÷
25g×
100%=6.84%
该溶液中Ba(OH)2的溶质质量分数为6.84%。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 中考 化学 算题 专题 训练
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
 喀什地图高清全图矢量可编辑全市各县区行政区划地图.pptx
喀什地图高清全图矢量可编辑全市各县区行政区划地图.pptx
