 浙教版科学九上专题复习导学案一除杂共存鉴别Word格式.docx
浙教版科学九上专题复习导学案一除杂共存鉴别Word格式.docx
- 文档编号:20511810
- 上传时间:2023-01-23
- 格式:DOCX
- 页数:15
- 大小:123.36KB
浙教版科学九上专题复习导学案一除杂共存鉴别Word格式.docx
《浙教版科学九上专题复习导学案一除杂共存鉴别Word格式.docx》由会员分享,可在线阅读,更多相关《浙教版科学九上专题复习导学案一除杂共存鉴别Word格式.docx(15页珍藏版)》请在冰豆网上搜索。
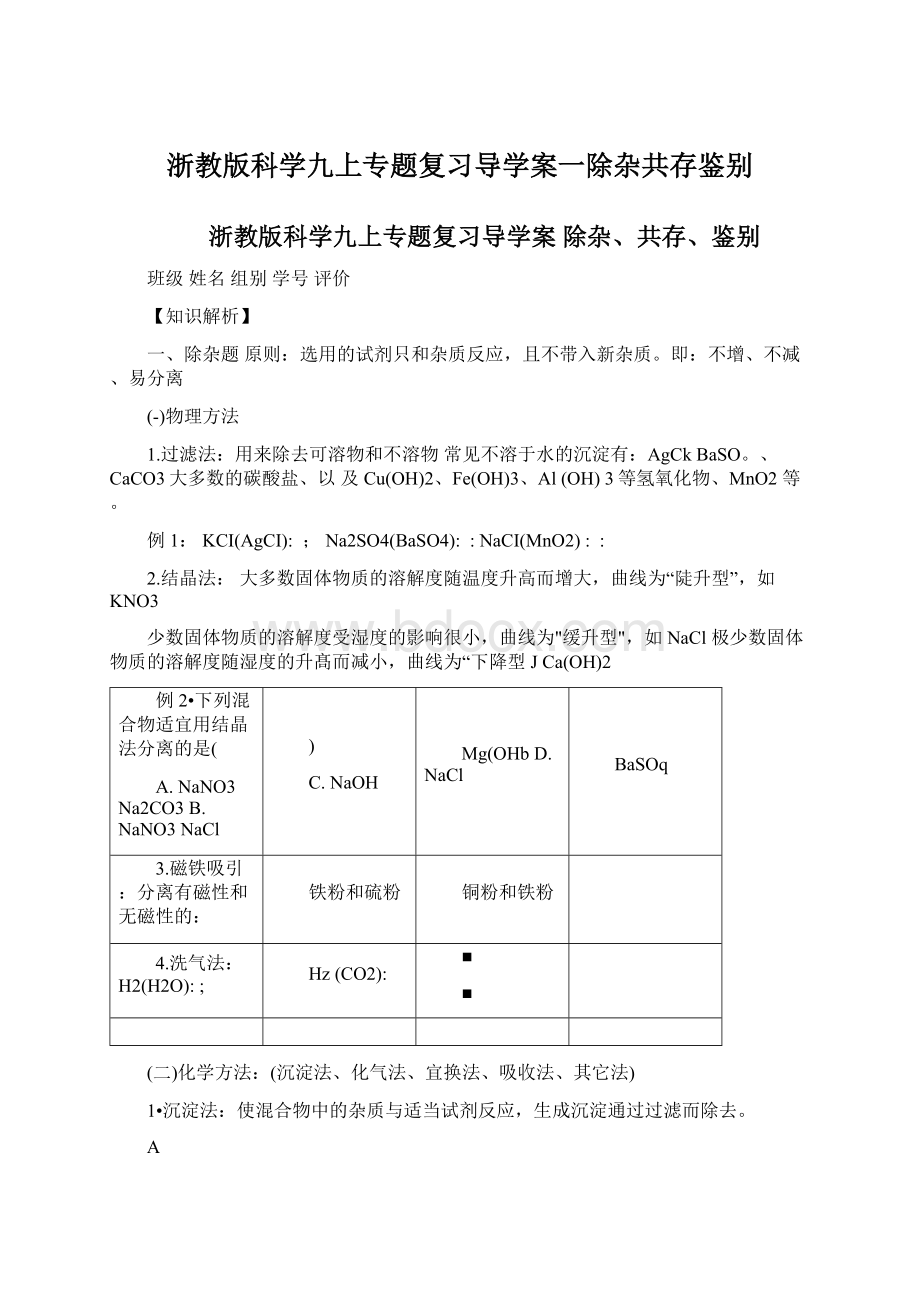
NaCl(Na2SO4)HCI(H2SO4)
HNO3(HCI)NaCl(MgCl2)
2.化气法:
将混合物中的杂质与适当试剂反应变成气体而除去。
一般规律为:
CO32+强酸=C02:
NH?
+OH-=NH3
例4.如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示:
NaCl(Na2CO3)Na2SO4(Na2CO3)
CaCk溶液(盐酸)KNO3(KOH)
Na2SO4(NaOH)
3.置换法:
将混合物中的杂质与适量试剂通过发生置换反应而除去。
FeSO4(CuSO4)
4.吸收法:
若气体混介物中气体杂质在某溶液中能发生化学反应而主成分不反应,可让混合物通入该溶液。
CO(COz)H2(HCI)
H2(co2)n2(02)
5•加热法:
CaO(CaCOs).
二、共存题
(
【基本知识】
常见不共存离子及产物特征
H+(酸)+0H-*H20
屮(酸)+CO3—CO2f(能使澄淸石灰水变浑浊);
NHf+OH(碱)-*NH3f(能使湿润的红色石茫试纸变蓝):
Ba2++SO42一BaS04I(白色,不溶于稀硝酸):
AgOCI—AgClI
Ca2++CO32-CaCO3I】
(白色,能溶于稀硝酸,放出CO:
气体)
Ba2++CO32—BaCOsI
Mg2++OH-*Mg(OH)2I
C0+OH-*Cu(OH)2I.(能溶于稀硝酸)
Fe^+OH-*Fe(OH)3I.
分析上述十组离子不难得出,如果两种离子相互作用生成了水或气体或沉淀等物质,则这两种离子不能在溶液中共存。
【常见题型】
1•“无条件”共存题
例5.下列各组物质不能在溶液中共存的有()多选
/
ABa(OH)2和KCIBFeCb和NaOHCNaCI和KNO3DNazCCh和HCl
2.“无色透明”条件型
若题目限泄溶液"
无色”,则不含有色离子,即Fe2*(注绿色)、Fe3+(黄色)、Cu2+(蓝色)、等离子。
若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。
如Ag+与CI-;
Ca2♦与CO厂一:
Ba?
*与CO32+等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。
例6.某无色透明的溶液中,下列各组离子能大量共存的是()
AH\Cl:
、Ba2\CO32-BAg+、Cl「、K\NO厂
CK+、0H\C厂、Na+DFe3+.Cl\N03\Na+
三、鉴别题
【基础知识】
(-)物质的鉴别物质鉴别方法:
物质离子
实验步骤
现象
化学方程式
酸溶液
(屮)
取少量待测液滴入
1
试液
变
碱溶液
(0H)
变_
盐酸及可溶性氯化物(CI-)
生成
硫酸及可溶性硫酸盐(SO?
-)
碳酸盐
(C0/・)
取少量待测液滴入试液
并将产生的气体通入
放出
【基本类型】
1.物理方法鉴别:
物理方法主要包括观察状态、颜色,闻气味、溶于水等情况。
例7.选择方法区分下列各组物质。
(1)白醋和白酒:
:
(2)絢i•和铜片:
(3)镁条和水银:
(4)CuSCU溶液和FeSOq溶液:
2.化学方法鉴别
题型一:
鉴别某一具体物质——如鉴别该物质是否是盐酸。
选择踰。
过程:
。
例8.硫酸是化学工业的重要产品和原料,也是我们实验室常用常备的化学试剂.某同学为鉴立某一无色溶液是否为稀硫酸,进行了以下实验:
1取少呈:
溶液于试管中,滴加石蕊试液,溶液变红色,表明溶液中一泄有氢离子:
2用玻璃棒蘸取少量溶液,滴到pH试纸上,测得pH=O,表明溶液呈酸性;
3取少量溶液于试管中,滴加氯化领溶液,振荡,有白色沉淀生成,证明溶液中一左有硫酸根离子:
4取少量溶液于试管中,滴加硝酸顿溶液,振荡,有白色沉淀生成,滴加稀硝酸,沉淀不溶解.证明溶液中一定有硫酸根离子
若确定该溶液为硫酸,能达到目的实验组合是()
A.®
@B.②③C.①④D.®
@
例9.如何鉴别食盐和碳酸钙粉末:
鉴别稀盐酸和稀硫酸:
题型二:
只用一种试剂鉴别物质
(1)指示剂法:
常用的指示剂主要为石蕊试剂和酚瞰,而使用范羽比较广的则为石澆试剂。
例10.鉴别盐酸、蒸馅水和石灰水,可用()
A、酚酥B、石蕊C、FeCI3D、CuSOd
(2)酸液法:
H2SO4、HCL
例.只用一种试剂鉴别Na2CO3.BaCLKNO3三种溶液,可选用
(3)盐液法:
Na2CO3.CUSO4、BaCJ、Ba(OH)2加入这些试剂,使物质呈现不同现象如生成气体、生成不同颜色的沉淀等来鉴别。
例12.只用一种试剂鉴别NaOH、BaCH、Na2SO4溶液,可选用()
A、BaCH溶液B、CuSCU溶液C、酚酥D、稀H2SO4
例13.下列各组溶液,只要一种试剂就能鉴别的是()
A、Na2CO3>
Na2SO4.BaClzB、KNO3、NaNOs、NaCI
C、KC1、NaCkNaOHD、Ca(OH)2.NaOH、NaCI
题型三:
不加试剂相互反应进行鉴别
例14.不用苴它试剂,用最简捷的方法鉴别①NaOH②MgSCU③Ba(NOs)2④FeCb⑤KCI五种溶液,则被鉴别出来的物质的正确顺序是
例15.下列各组溶液,不用其他试剂,就能将组内物质鉴别出来的是()
\
ANaCIHCIH2SO4AgNO3BCuSO4NaOHBaCl2HCI
CK2CO3HCINaOHBaClzDNaOHKOHMg(OH)2H2SO4
【巩固练习】
1.下列各组物质在溶液中能大量共存且形成无色溶液的是()
••••••••
A・NaCIBaCl2Na2CO3B・KNO3HCICaCI2
C・H2SO4FeClsNaNO3D・NaOHHNO3NH4NO3
2.下列离子能在pH=ll的溶液中大量共存的是(r)
\N03\Na\OH-B.CO32\K\Cl\Ca2*
>
C.HJBa2+.Cl\S0/・\0H\SO/、Cu2+
3.下列各组离子能在指定溶液中大量共存的一组是()
A.在稀盐酸中:
Ba2\CO32、Zn2*B・在氢氟化钠溶液中•:
H\Mg2\Cl
C.在氯化钠溶液中:
K\Ca2\N03D・在硫酸鞍溶液中:
Na\Cu2\OH
4.小红对某无色溶液所含溶质的记录,合理的是()
A・HCI.NaOH、NaClB・KNO3、NaCkFeCls.
C・NaOH、Na2CO3^NaClD・CuSCU、H2SO4xNaCl
5.只用一种试剂就可一次性鉴别稀硫酸、KOH溶液、CaCb溶液的是()
A、KCI溶液B、©
COj溶液C、稀盐酸D.NaNOs溶液
6.现有稀盐酸、澄清石灰水、氯化钠溶液三种无色溶液,小丽认为可用下列四种试剂进行一次性鉴别,你
觉得不可行的是()
•••
A.无色酚耿溶液试纸溶液D.紫色石蕊溶液
7.鉴别下列物质所使用的方法或试剂,错误的是()
A.氧气与氮气一闻气味B.氯化钠与碳酸钠一用稀盐酸
C.铝与铝合金一比较硬度D.氯化钾与氯化彼一用熟石灰
8.下列实验方案或措施不合理的是()
A.用稀盐酸淸除铁制品表面的铁锈B.用氯化顿溶液鉴别稀盐酸和稀硫酸
所用试剂或方法
通入氧气、点燃
溶于水、过滤
加盐酸
加水或盐酸
选项实验目的
A除去二氧化碳中少量的一氧化碳
除去氯化钠中少量的氯化银
B
C验证锌、铜、金的金属活动性
D除去生石灰中少量的碳酸钙
20•下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是()
••
A.C02气体(H20)-生石灰B.C粉(CuO)f稀盐酸
C.CaCl2溶液(HC1)f碳酸钙粉末D.CO气体(CO?
)—氢氧化钠溶液□•下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是()
(C02)——通过足量的灼热氧化铜粉末(KCI)——溶解、过滤、洗涤、干燥
溶液(CuSO4)一一加入足量锌粉、过滤溶液(NaCl)—加入适量硝酸银溶液、过滤
12•对知识的归纳和总结是学好科学的重要方法。
在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
(1)为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚駄试液滴入氢氧化钙溶液中,溶液由无色变成色。
(2)利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液
中少量的氢氧化钙杂质,请写岀该化学反应的方程式
13.有一包白色粉末,可能含有Ba(OH)2、KNO3、FeCb、Na2CO3>
Na2SO4中的一种或几种。
为了确定其成分,进行如下实验:
1取一左量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层淸液为无色。
2过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
⑴据此推断,该白色粉末中一立含有;
可能含有:
一定不含有°
⑵写岀步骤②中发生反应的的化学方程式:
14.乙块(CzH2)气体和氧气反应能产生高温火焰,工人师傅常用氧块焰切割或焊接金属。
乙烘由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提岀问题】白色固体是什么物质
【做岀猜想】小明经过思考认为有以下几种可能:
.
猜想一:
CaO;
猜想二:
猜想三:
Ca(OH)2。
他的依据是,
【交流反思】经过同学.们交流讨论,认为猜想一不成立。
否立猜想一的理由是:
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到•证明猜想二不成立。
(-)取少量白色固体加入到水中,取上层淸液,,有白色沉淀出现,
证明猜想三成立。
该反应的化学方程式为:
>
结论:
白色固体是Ca(OH)2。
15.
已知NaOH容易与空气中的CO2作用而变质。
小军同学在实验室发现一瓶敞口放置的NaOH固体后,设计方案,对这瓶NaOH固体变质情况进行了如下实验探究:
回答下列问题:
⑴上述实验操作的名称分别是:
操作①,操作④」
⑵根据上述实验,可以确立该固体变质(选填“已”或“未”)
⑶步骤③中加过量氯化钙溶液的目的是
⑷若测得E的PH=7,则A的成分.若测得E的PH>
7,则A的成分
16.课本中有一问:
为什么汗水有咸味学习小组同学为此开展探究。
【提出问题】汗水中产生咸味的物质是什么
【假设与猜想】根据生活经验推测,汗水中产生咸味的物质可能是。
【查阅资料】用钳丝睡取少许含有钠元素的溶液(或物质)在洒精灯火焰上灼烧,会呈现黃色火焰。
【制订计划】为了证明咸味物质是猜想中的物质,一是要证明汗水溶液中含有阴离子
(填写离子符号),二是要证明汗水溶液中有阳离子(填写离子符号)。
【进行实验】
证明阴离子的实验:
向汗水溶液中滴加溶液,再加入少量稀硝酸,振荡,仍有白色沉淀产生。
证明阳离子的实验:
【结论】经上述实验证明,汗水中的咸味物质就是猜想中的物质。
【分析与交流】上述实验中,证明阴离子存在的化学反应方程式为:
,该反应属于复
分解反应。
17.某面包膨松剂由碳酸氢钠和碳酸氢钱两种物质组成。
化学小组为验证该膨松剂的成分,査阅资料,设计如图所示实验(实验开始前弹簧夹都处于关闭状态)。
资料:
①膨松剂在而包制作过程中发生化学反应;
2NaHCO3^Na2CO3+H2O+CO2tNH4HCO3-NH3t+H2O+CO2t:
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液为氨水。
(1)
是否需要将装巻B中的水换成澄
淸石灰水,说明理由。
(2)如果没有装置C,可能会对实验
造成的影响是什么
(3)利用上述装置验证膨松剂的成
分,简述实验操作及判断依据。
18.如图,甲乙两位同学在实验室分别完成酸与碱、酸与盐反应的实验后,依次将反应后的废液缓慢倒入同一洁净的废液缸中,当乙同学沿废液缸缓慢倾倒废液时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀.为科学处理废液,甲乙同学对废液缸中最终废液溶质成分进行探究.
【提出问题】:
最终废液中含有什么溶质
【猜想与假设】:
甲同学猜想:
只有NaCl-种溶质:
乙同学猜想:
废液中含有NaCl、CaCb两种溶质:
你的猜想是:
废液中含有的溶质是:
.
【实验探究】:
如果你的猜想是正确的,你设汁的实验方案发生
反应的化学方程式为:
•
【实验结论】:
通过实验,证明你的猜想是正确的.
【反思交流】:
随着大家环保意识的增强,实验室产生的污染越来越受到重视,实验中产生的污染物必须无害化处理后再排放.
19.现有两瓶失去标签的溶液,溶质分别可能是硝酸钠、硝酸铜、硝酸、硫酸钠、硫酸、碳酸钾中的一种,检验步骤如下:
I.分别取少呈:
混用,无明显现象,溶液无色透明,经测左混合溶液显酸性。
由此可推断这两瓶溶液中的溶质一建不是:
(填化学式,多填、少填、错填均不得分,下同)
H.向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀。
则这两瓶溶液中的溶质至少是中的
一种:
试推断这两瓶溶液的溶质可能的组合有种(填数字),请写出其中含阳离子种类最少的一种
组合。
20.
实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是碳酸钠溶液、氯化领溶液、硫酸钠溶液和稀盐酸中的一种。
【提岀问题】如何区分岀四种溶液
【进行实验】甲同学实验如图所示:
由此甲同学认为A—左不是
(1)
【表达与交流】甲同学向实验后的溶液中滴加酚駄溶液,酚駄溶液由无色变为红色,则
甲同学的结论:
A是氯化顿溶液。
乙同学不同意甲同学的结论,乙同学的理由是
(2)
于是乙同学另取少量A于试管中,向其中滴加一种试剂是(3)溶液,
观察到的明显现象是(4)・由此证明了甲同学的结论是错误的.同时确泄了A°
乙同学继续实验如图所示:
【收集证据】观察到C中产生气泡,D中产生白色沉淀。
【解释与结论】写出D中发生反应的化学方程式
稀硫酸」
•
稀硫酸二
[
1稀硫酸」
I
B』:
8血
c4
乙同学最终通过实验区分出了四种溶液。
【反思与评价】请指岀甲同学区分上述四种溶液时,在实验方法上的一点不足之处
(6),
21.小东.小林和小雨同学对氢氧化钠溶液使酚瞰溶液变红的现彖很感兴趣,决左做实验进行探究:
氢氧化钠溶液中到底是哪一种粒子使酚酥溶液变红实验中可供使用的用品有盐酸、氯化钠溶液、氯化钙溶液、氢氧化钠溶液、碳酸钠溶液、酚酥溶液及若干支试管。
【提岀假设】假设(I):
使酚臥溶液变红的是缶0。
假设
(2):
使酚酥溶液变红的是Na+。
假设(3):
使酚酥溶液变红的是°
小东认为不做实验即可说明假设
(1)不成立,原因是o
【实验验证】
(完成下「列实验操作、实验现象及实验结论)
实验步骤’
••
实验操作
实验现象
实验结论
向装有氢氧化钠溶液的试管中滴加酚駄溶液
溶液变为红色
(2)
小雨认为向实验步骤
(1)后的试管中加入盐酸也可得出正确结论,你同意她的观点吗(填“同
意”或"
不同意"
)。
【实验拓展】
小林将酚駄溶液滴入碳酸钠溶液中,发现溶液也变红。
他们经过分析、讨论、归纳,得出的结论是O
参考答案
1.除杂题例加水过滤例2.B
例3.滴加氯化领溶液,过滤滴加硝酸银溶液,过滤
例4.滴加稀盐酸
二、共存题
例5.BD
例6.C
3.鉴别题
例7.⑴闻气味⑵看颜色(3)看状态(3)看颜色
例&
C
例9.取2只试笛,分别取少疑待测试剂,再在每只试管中加水,则溶于水的是食盐:
取2只试管,分别取少量待测试剂,再在每只试管中加氯化领溶液,贝9出现沉淀的是稀硫酸:
例10.B
例11.稀硫酸
例12.B
例13.A
例15.B
2
3
4
5
•••
6
7
8
9
10
11
C
D
12.
(1)红
(2)Ca(OH)2+Na2CO3=CaCO31+2NaOH
13.⑴Ba(OH)2、Na2CO3KNO3FeCb、Na2SO4
(2)BaCO3+2HCI=BaCIz+HzO+COz^
14.【做出猜想】CaCO3化学变化过程中元素不变
【交流反思】CaO能与水反应
(一)气泡放出
(二)通入二氧化碳气体Ca(aH)2+C02=CaCO34/+H20
[或滴加碳酸钠溶液Ca(OH)2+Na2CO3=CaCOs山+2NaOH]
15.
(1)溶解过滤;
⑵已⑶完全除去碳酸钠:
⑷氢氧化钠氢氧化钠和碳酸钠
16.【假设与猜想】氯化钠【制订计划】Cl-、Na*
【进行实验】硝酸银用钳线瞧取少许汗液在洒精灯火焰上灼烧,会呈现黄色火焰。
【分析与交流】NaCl+AgNO3==AgClJz+NaN03
17.⑴不需要,水的作用是判断反应是否进行完全(没有气泡说明反应完了)
(2)(二氧化碳没有被吸收,溶于水成酸性)D装宜中可能看不到变红现象,不能判断有氨气生成
⑶关闭K2,打开K1,充分加热,D中酚駄变红,说明有氨气生成,则有碳酸氢彼存在。
化学反应中元素种类不改变。
然后关「闭K1,打开K2,当B中水里没有气泡时,试管中有剩余固体存在,说明有碳酸氢钠存在,因为碳酸氢彼分解后无固体:
18.【猜想与假设】:
NaCkNa2CO3.
Na2CO3+2HCI=2NaCI+H2O+CO2个(合理均可).
19.I.Cu(NO3)2、K2CO3II.H2SO4Na2SO44H2SO4HNO3
20.
(1)碳酸钠溶液或硫酸钠溶液
(2)若A是稀盐酸,氢氧化顿跟稀盐酸反应后氢氧化领过虽:
,也能是酚耿溶液变红
(3)碳酸钠溶液(或碳酸钾溶液:
或紫色石蕊溶液)
(4)产生气泡(或产生气泡:
或紫色石裁溶液变红色)
(5)H2SO4+BaCI2==BaSOa2HCI
(6)甲同学在实验开始时只取A,没有同时取A、B、C、D进行对比实验是不科学的方法。
21.[提出假设JOH-.酚酥溶液中含有水,而酚酥溶液无色
[实验验iiE]
向装有氯化钠溶液的试管中滴加酚瞰溶液
溶液仍为无色[或溶液颜色无变化
假设
(2)不成立
假设(3)成立
同意
[实验拓展]使酚駄溶液变红的不一龙是碱溶液(或某些盐溶液呈碱性,或其它合理答案)
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 浙教版 科学 专题 复习 导学案一 共存 鉴别
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
