 中药饮片GMP自检记录Word文件下载.docx
中药饮片GMP自检记录Word文件下载.docx
- 文档编号:19315281
- 上传时间:2023-01-05
- 格式:DOCX
- 页数:16
- 大小:20.76KB
中药饮片GMP自检记录Word文件下载.docx
《中药饮片GMP自检记录Word文件下载.docx》由会员分享,可在线阅读,更多相关《中药饮片GMP自检记录Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
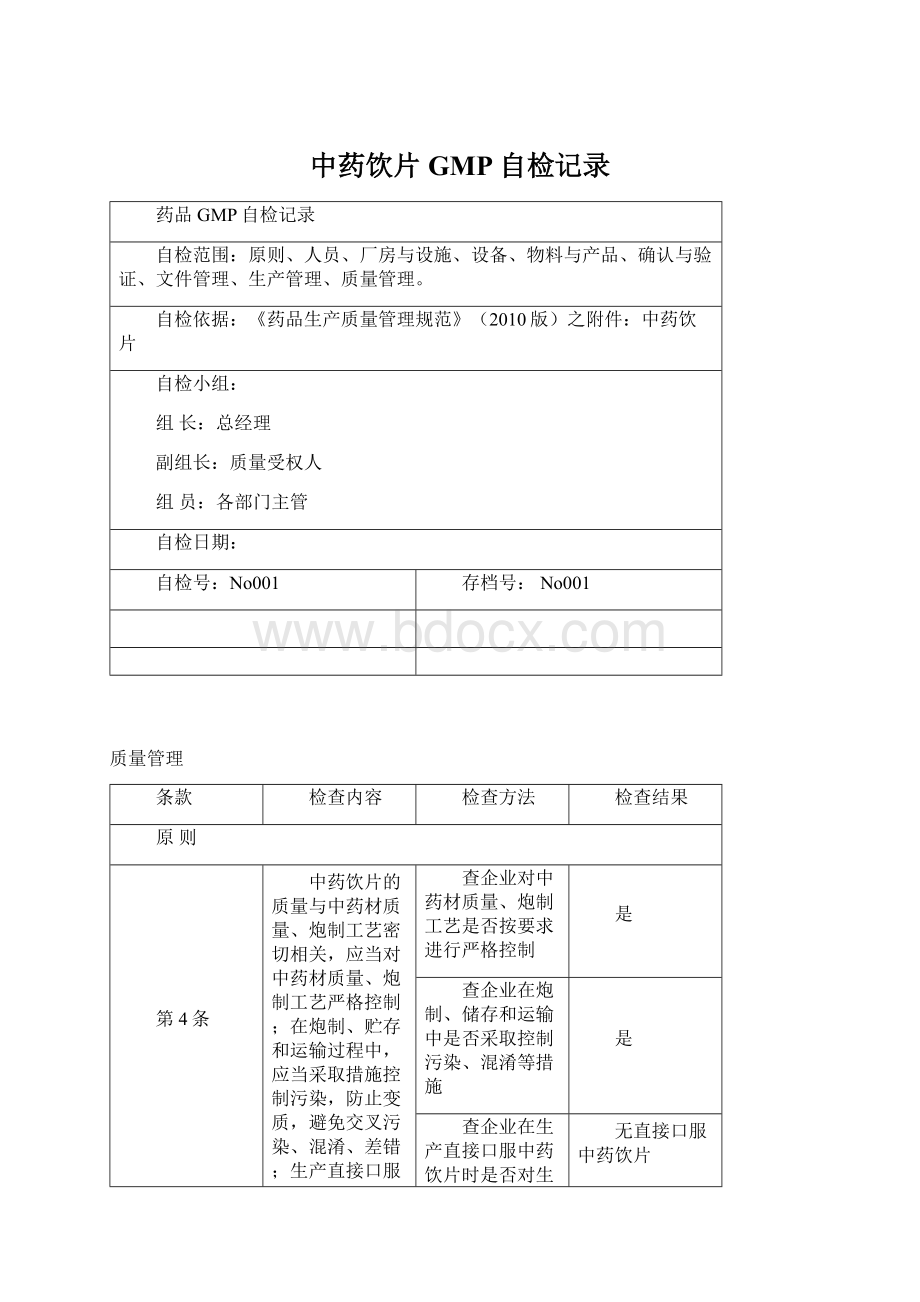
中药饮片的质量与中药材质量、炮制工艺密切相关,应当对中药材质量、炮制工艺严格控制;
在炮制、贮存和运输过程中,应当采取措施控制污染,防止变质,避免交叉污染、混淆、差错;
生产直接口服中药饮片的,应对生产环境及产品微生物进行控制。
查企业对中药材质量、炮制工艺是否按要求进行严格控制
是
查企业在炮制、储存和运输中是否采取控制污染、混淆等措施
查企业在生产直接口服中药饮片时是否对生产环境及产品微生物进行控制
无直接口服中药饮片
第5条
中药材的来源应符合标准,产地应相对稳定。
查中药材的来源是否符合标准
查中药材的产地是否稳定
第6条
中药饮片必须按照国家药品标准炮制;
国家药品标准没有规定的,必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。
查企业生产的中药饮片是否按国家药品标准炮制
第7条
中药饮片应按照品种工艺规程生产。
中药饮片生产条件应与生产许可范围相适应,不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。
查企业是否按照品种工艺规程生产
企业中药饮片的生产条件与生产许可是否相适应
查企业是否有外购中药饮片的中间产品或成品进行分包装或改换包装标签的行为。
无
人员
第8条
企业的生产管理负责人应具有药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格)、三年以上从事中药饮片生产管理的实践经验,或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。
查公司生产管理负责人履历、学历、教育背景及职称情况是否符合规范要求
符合规范要求
第9条
企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格),并有中药饮片生产或质量管理五年以上的实践经验,其中至少有一年的质量管理经验。
查公司质量管理负责人履历、学历、教育背景及职称情况是否符合规范要求
符合规范要求(没有备案)
第10条
企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员
查企业的关键人员、质量保证、质量控制等人员是否全职在岗人员
第11条
质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力,具备鉴别中药材和中药饮片真伪优劣的能力。
查企业的质量保证和质量控制人员是否具备中药材和中药饮片的质量控制能力及鉴别真伪优劣的能力
具有,都是通过培训考核后才上岗的
第12条
从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能;
从事毒性中药材等有特殊要求的生产操作人员,应具有相关专业知识和技能,并熟知相关的劳动保护要求。
查企业的中药炮制操作人员是否具备相关的专业知识和技能
具备,全部是通过培训考核后才上岗的
查企业从事毒性中药材的人员是否具备相关专业知识和技能并熟知相关劳动保护
第13条
负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。
查企业负责中药材采购及验收人员是否有鉴别药材优劣的能力
第14条
从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。
检查养护、仓储保管人员是否掌握中药材、中药饮片贮存养护知识与技能
第15条
企业应由专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识等。
查企业是否由专人负责培训管理工作,查企业的培训记录是否包括中药专业知识、岗位技能和药品GMP相关法规知识等
第16条
进入生产区的人员应进行更衣、洗手;
从事对人体有毒、有害操作的人员应按规定着装防护,其专用工作服与其他操作人员的工作服应分别洗涤、整理,并避免交叉污染。
查有无相关标准操作规程和管理规程
有
查从事有毒、有害操作的人员是否按规范进行更衣、洗手、着装和防护
第17条
生产区应与生活区严格分开,不得设在同一建筑物内。
查生产区与生活区是否严格分开
第18条
厂房与设施应按生产工艺流程合理布局,并设置与其生产规模相适应的净制、切制、炮炙等操作间。
同一厂房内的生产操作之间和相邻厂房之间的生产操作不得互相妨碍。
查企业的厂房与设施布局是否合理,设置与生产规模是否相适应。
生产操作之间和相邻厂房之间的生产操作是否互相妨碍
否
第19条
直接口服饮片的粉碎、过筛、内包装等生产区域应按照D级洁净区的要求设置,企业应根据产品的标准和特性对该区域采取适当的微生物监控措施。
查生产区域是否按照D级洁净区的要求设置
无直接口服饮片
查企业是否按产品的标准和特性采取微生物监控措施
第20条
毒性中药材加工、炮制应使用专用设施和设备,并与其他饮片生产区严格分开,生产的废弃物应经过处理并符合要求。
查毒性车间的设施和设备是否专用
与其他饮片生产区是否严格分开
废弃物处理是否符合要求
第21条
厂房地面、墙壁、天棚等内表面应平整,易于清洁,不易产生脱落物,不易滋生霉菌;
应有防止昆虫或其他动物等进入的设施,灭鼠药、杀虫剂、烟熏剂等不得对设备、物料、产品造成污染。
现场检查厂房及其设施是否符合要求
第22条
中药材净选应设拣选工作台,工作台表面应平整,不易产生脱落物。
现场检查净选工作台是否符合要求
第23条
中药饮片炮制过程中产热产汽的工序,应设置必要的通风、除烟、排湿、降温等设施;
拣选、筛选、切制、粉碎等易产尘的工序,应当采取有效措施,以控制粉尘扩散,避免污染和交叉污染,如安装捕尘设备、排风设施等。
现场检查各工序有无相关的配套的有效除尘、排风、避免污染和交叉污染的设施
第24条
仓库应有足够空间,面积与生产规模相适应。
中药材与中药饮片应分库存放;
毒性中药材和饮片等有特殊要求的中药材和中药饮片应当设置专库存放,并有相应的防盗及监控设施。
检查仓库空间、面积是否与生产规模相适应
检查中药材与中药饮片分库存放情况
查毒性中药材和饮片等有特殊要求的中药材和中药饮片是否设置专库存放,并有相应的防盗及监控措施
第25条
仓库内应当配备适当的设施,并采取有效措施,对温、湿度进行监控,保证中药材和中药饮片按照规定条件贮存;
贮存易串味、鲜活中药材应当有适当的设施(如专库、冷藏设施)。
检查仓库内是否配备有效调节温湿度的设施设备,是否能保证中药材和中药饮片按照规定条件贮存
查储存易串味、鲜活中药材是否有适当的设施
设备
第26条
应根据中药材、中药饮片的不同特性及炮制工艺的需要,选用能满足生产工艺要求的设备。
检查设备是否符合生产工艺要求
符合要求
第27条
与中药材、中药饮片直接接触的设备、工具、容器应易清洁消毒,不易产生脱落物,不对中药材、中药饮片质量产生不良影响。
现场检查设备的结构和材质是否符合要求
第28条
中药饮片生产用水至少应为饮用水,企业定期监测生产用水的质量,饮用水每年至少一次送相关检测部门进行检测。
检查有无相关规定及监测记录
物料和产品
第29条
生产所用原辅料、与药品直接接触的包装材料应当符合相应的质量标准,分别编制批号并管理;
所用物料不得对中药饮片质量产生不良影响。
查生产所用原辅料、与药品直接接触的包装材料是否符合相应的质量标准,并对中药饮片质量不会产生不良影响
查生产所用原辅料及包材是否分别编制批号并管理
第30条
质量管理部门应当对生产用物料的供应商进行质量评估,并建立质量档案;
直接从农户购入中药材应收集农户的身份证明材料,评估所购入中药材质量,并建立质量档案。
检查质量管理部门是否对生产用物料的供应商进行质量评估,并建立质量档案
检查直接从农户购入中药材是否收集农户的身份证明材料,评估所购入中药材质量,并建立质量档案
第31条
对每次接收的中药材均应当按产地、供应商、采收时间、药材规格等进行分类,分别编制批号并管理。
查每次接收的药材是否按要求进行分类,并分别编制批号并管理
第32条
购入的中药材,每件包装上应有明显标签,注明品名、规格、数量、产地、采收(初加工)时间等信息,毒性中药材等有特殊要求的中药材外包装上应有明显的标志。
检查购入中药材的包装上是否有符合要求的明显标签
毒性中药材等有特殊要求的中药材外包装上除了有符合要求
的明显的标签外,是否还有明显的特殊标志。
第33条
中药饮片应选用能保证其贮存和运输期间质量的包装材料或容器。
包装必须印有或者贴有标签,注明品名、规格、产地、生产企业、产品批号、生产日期、执行标准,实施批准文号管理的中药饮片还必须注明药品批准文号。
检查包装中药饮片的包材是否能保证运输期间的产品质量
能
检查中药饮片包装上是否附有符合相关要求的明显标签
附有
第34条
直接接触中药饮片的包装材料应至少符合食品包装材料标准。
检查直接接触中药饮片的包装材料是否符合相关标准
符合
第35条
中药材、中药饮片应按质量要求贮存、养护,贮存期间各种养护操作应当建立养护记录;
养护方法应当安全有效,以免造成污染和交叉污染。
检查中药材、中药饮片的是否按要求进行贮存和养护并建立相应的养护记录
养护方法是否安全有效
第36条
中药材、中药饮片应制定复验期,并按期复验,遇影响质量的异常情况须及时复验。
检查中药材、中药饮片管理规程中是否制定有复验期,遇影响质量的异常情况是否时复验。
第37条
中药材和中药饮片的运输应不影响其质量,并采取有效可靠的措施,防止中药材和中药饮片发生变质。
检查运输中是否有相应的防护设施
第38条
进口药材应有国家食品药品监督管理部门批准的证明文件,以及按有关规定办理进口手续的证明文件。
检查进口药材是否有国家食品药品监督管理部门批准的证明文件,以及按有关规定办理进口手续的证明文件。
公司暂无进口产品
确认与验证
第39条
净制、切制可按制法进行工艺验证,炮炙应按品种进行工艺验证,关键工艺参数应在工艺验证中体现。
检查工艺验证中,关键工艺参数在工艺验证中是否有体现。
有体现
第40条
关键生产设备和仪器应进行确认,关键设备应进行清洁验证。
直接口服饮片生产车间的空气净化系统应进行确认。
查关键设备和仪器是否进行确认和清洁验证。
直接口服饮片生产车间的空气净化系统是否进行确认
无直接口服
第41条
生产一定周期后应进行再验证。
检查生产一定周期后是否进行再验证,验证文件再验证周期规定是否合理。
第42条
验证文件应包括验证总计划、验证方案、验证报告以及记录,确保验证的真实性。
检查有无验证总计划、验证方案、验证报告以及记录,是否能确保验证的真实性。
文件管理
第43条
中药材和中药饮片质量管理文件至少应包含以下内容:
(一)制定物料的购进、验收、贮存、养护制度,并分类制定中药材和中药饮片的养护操作规程;
(二)制定每种中药饮片的生产工艺规程,各关键工艺参数必须明确,如:
中药材投料量、辅料用量、浸润时间、片型、炒制温度和时间(火候)、蒸煮压力和时间等要求;
(三)根据中药材的质量、投料量、生产工艺等因素,制定每种中药饮片的收率限度范围,关键工序应制定物料平衡参数。
(四)制定每种中药材、中药饮片的质量标准及相应的检验操作规程,制定中间产品、待包装产品的质量控制指标。
查公司的质量管理文件是否符合规范要求。
任意抽取3份文件检查其是否符合规范要求
第44条
应当对从中药饮片生产和包装的全过程的生产管理和质量控制情况进行记录,批记录至少包括以下内容:
(一)批生产和包装指令;
(二)中药材以及辅料的名称、批号、投料量及投料记录;
(三)净制、切制、炮炙工艺的设备编号;
(四)生产前的检查和核对的记录;
(五)各工序的生产操作记录,包括各关键工序的技术参数;
(六)清场记录;
(七)关键控制点及工艺执行情况检查审核记录;
(八)产品标签的实样;
(九)不同工序的产量,必要环节物料平衡的计算;
(十)对特殊问题和异常事件的记录,包括偏离生产工艺规程等偏差情况的说明和调查,并经签字批准;
(十一)中药材、中间产品、待包装产品中药饮片的检验记录和审核放行记录。
检查公司批生产记录和批包装记录是否符合规范要求。
任意抽取3批批生产记录检查其内容是否涵盖所有规范相关要求
检查对特殊问题和异常事件的记录,包括偏离生产工艺规程等偏差情况的说明和调查,是否经签字批准;
检查中药材、中间产品、待包装产品中药饮片的检验记录和审核放行记录是否齐全并符合要求
生产管理
第45条
净制后的中药材和中药饮片不得直接接触地面。
中药材、中药饮片晾晒应有有效的防虫、防雨等防污染措施。
查净制后的中药材和中药饮片是否按要求存放及有无相关防护设施
第46条
应当使用流动的饮用水清洗中药材,用过的水不得用于清洗其他中药材。
不同的中药材不得同时在同一容器中清洗、浸润。
检查生产现场是否符合要求
查有无相关书面文件规定
第47条
毒性中药材和毒性中药饮片的生产操作应当有防止污染和交叉污染的措施,并对中药材炮制的全过程进行有效监控。
检查是否有防止污染和交叉污染的措施
检查记录是否能对炮制过程进行有效的全过程监控
第48条
中药饮片以中药材投料日期作为生产日期。
查批生产记录是否以投料日期作为生产日期。
第49条
中药饮片应以同一批中药材在同一连续生产周期生产的一定数量相对均质的成品为一批。
查生产的中药饮片是否按照规范要求定批
第50条
在同一操作间内同时进行不同品种、规格的中药饮片生产操作应有防止交叉污染的隔离措施。
检查生产现场有无有效的隔离措施
第51条
中药材和中药饮片应按法定标准进行检验。
如中药材、中间产品、待包装产品的检验结果用于中药饮片的质量评价,应经过评估,并制定与中药饮片质量标准相适应的中药材、中间产品质量标准,引用的检验结果应在中药饮片检验报告中注明。
查中药饮片的检验记录、检验报告有无引用中药材和中间产品、待包装产品的检验结果的,如有是否在检验报告中有无注明。
无引用
第52条
企业应配备必要的检验仪器,并有相应标准操作规程和使用记录;
检验仪器应能满足实际生产品种要求,除重金属及有害元素、农药残留、黄曲霉毒素等特殊检验项目和使用频次较少的大型仪器外,原则上不允许委托检验。
检验仪器是否能满足实际生产品种要求
查检验仪器是否有相应标准操作规程和使用记录
查企业有无委托检验
第53条
每批中药材和中药饮片应当留样。
中药材留样量至少能满足鉴别的需要,中药饮片留样量至少应为两倍检验量,毒性药材及毒性饮片的留样应符合医疗用毒性药品的管理规定。
留样时间应当有规定,中药饮片留样时间至少为放行后一年。
查每批中药材和中药饮片是否有留样,留样是否合理。
毒性药材及毒性饮片的留样应是否符合医疗用毒性药品的管理规定。
检查中药饮片留样时间至少为放行后一年。
第54条
企业应设置中药标本室(柜),标本品种至少包括生产所用的中药材和中药饮片。
查企业是否设置中药标本室(柜)
第55条
企业可选取产量较大及质量不稳定的品种进行年度质量回顾分析,其他品种也应定期进行产品质量回顾分析,回顾的品种应涵盖企业的所有炮制范围。
查企业是否有涵盖所有炮制范围产品的年度质量回顾分析报告。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 中药饮片 GMP 自检 记录
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
