 盐类的水解Word格式.docx
盐类的水解Word格式.docx
- 文档编号:18987951
- 上传时间:2023-01-02
- 格式:DOCX
- 页数:15
- 大小:40.23KB
盐类的水解Word格式.docx
《盐类的水解Word格式.docx》由会员分享,可在线阅读,更多相关《盐类的水解Word格式.docx(15页珍藏版)》请在冰豆网上搜索。
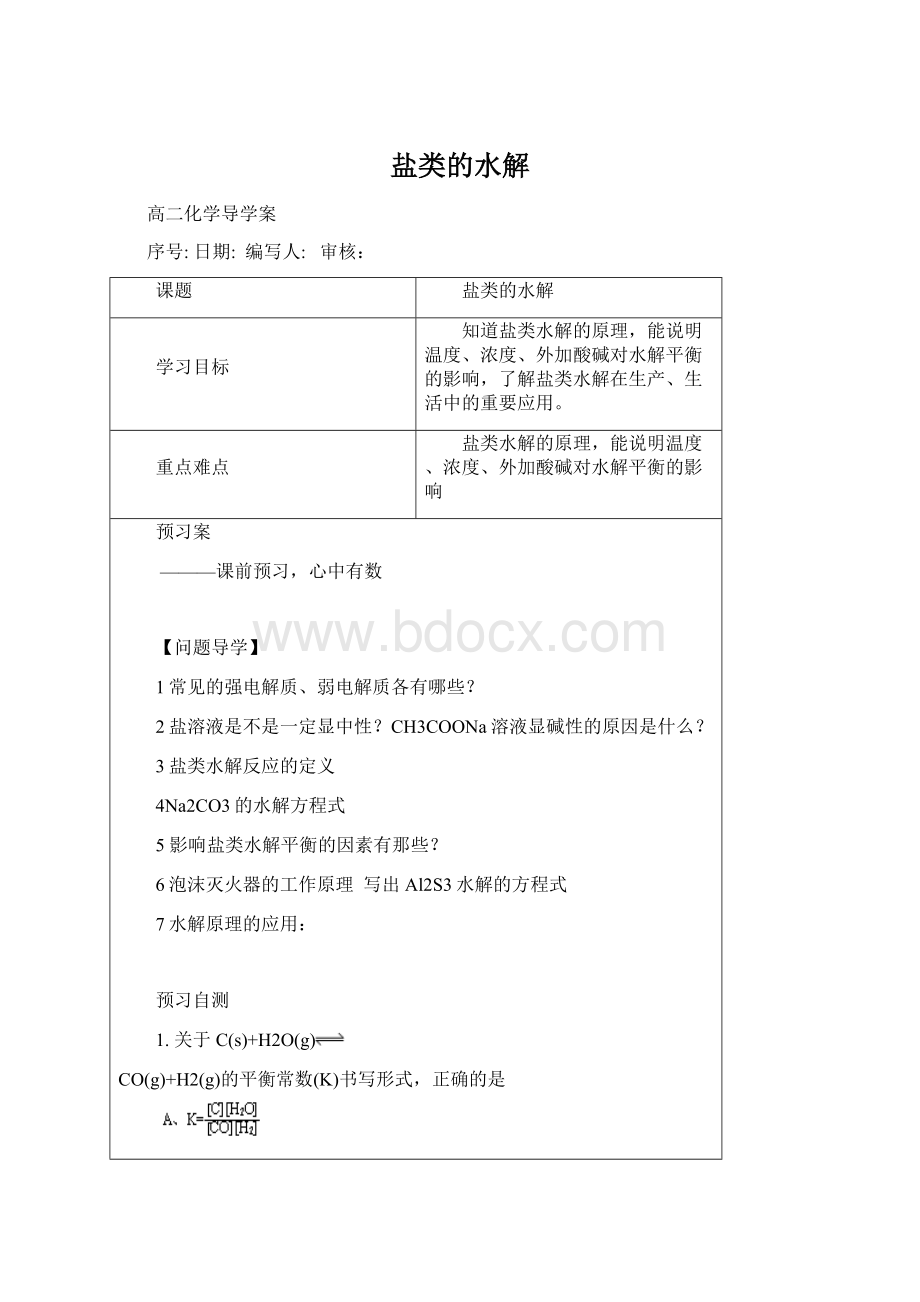
D.温度越高,K值越大
3.恒温下,在容积为2L的恒容密闭容器A中通入1molN2与1molH2的混合气体,发生如下反应:
N2(g)+3H2(g)
2NH3(g),△H<0,一段时间后,达到平衡,若平衡时氨气的物质的量为0.4mol。
(1)此温度时该反应的K值为____
。
(2)若在此温度下,向另一容积为1L的恒容容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态______(填“是”或“否”),此时若没有达平衡,反应向
方向进行。
4判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。
(1)KF:
。
(2)NH4NO3:
(3)NaHCO3:
(4)NaAlO2:
。
导学案
———深思熟虑,突破难点
突破重难点
点滴感悟
一.盐类的水解
【复习回顾】
1、什么是盐?
2、什么是电离平衡?
3、水溶液的酸碱性由什么决定?
酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?
测定下列盐溶液的PH,实验探究一下。
【实验】分别用玻璃棒蘸取少量下列溶液,滴到pH试纸上,观察颜色变化,并与标准比色卡比较,得出溶液的酸碱性。
CH3COONa溶液、Na2CO3溶液、NaCl溶液、NH4Cl溶液、CuSO4(或Al2(SO4)3)溶液、KNO3溶液。
为什么盐溶液有的呈酸性,有的呈碱性,有的呈中性呢?
要解决这个问题,大家先完成P83的表格。
【完成表格】P83
盐溶液
CH3COONa
Na2CO3
NaCl
NH4Cl
Al2(SO4)3
KNO3
溶液的PH
溶液中存在的微粒
哪些离子可能发生相互作用
溶液显示酸性或碱性的原因
【结论】
【问题】同样为盐溶液,却表现出不同的酸碱性,说明在这六种溶液里H+和OH—的浓度分别呈何种关系呢?
【问题】CH3COONa、Na2CO3、NH4Cl、Al2(SO4)3在水溶液中既不能电离出OH-也不能电离出H+,而在任何物质的水溶液中由水电离出的H+和OH—的浓度总相等,那么是谁打破了这一等量关系呢?
【探究】CH3COONa溶液显碱性的原因
【探究步骤】1、CH3COONa溶液中存在哪些电离?
2、CH3COONa溶液中存在哪些离子?
3、CH3COONa溶液中哪些离子能共存?
哪些离子不能共存?
写出离子方程式。
4、CH3COONa在水溶液中反应的本质和结果是什么?
【迁移•运用】NH4Cl溶液为什么显酸性?
Al2(SO4)3溶液为什么显酸性?
【说明】水解反应的特点——将水解离开来,再与弱离子结合。
【练习】写出下列物质的水解反应。
(1)FeCl3
(2)NaF(3)CuSO4(4)K2CO3(5)Al2(SO4)3
【问题】水解的定义、实质、结果分别是什么?
【交流讨论】什么样的盐才能水解呢?
【问题】CH3COONa是哪种酸和碱反应得到的盐?
【问题】什么样的离子可以发生水解?
如Na+、K+、Fe2+、Fe3+、NH4+、SO42—、Cl—、CH3COO—、CO32—,哪些可以发生水解?
【总结】强酸强碱
酸碱弱酸弱碱
1、强酸强碱盐:
2、强酸弱碱盐:
3、弱酸强碱盐:
4、弱酸弱碱盐
:
【提问】观察下表,盐类水解有何规律?
酸
碱
盐的类型
是否水解
盐溶液的酸碱性
强
强酸强碱盐NaCl
弱
弱酸强碱盐CH3COONa
强酸弱碱盐(NH4)2SO4
弱酸弱碱盐CH3COONH4
【总结】盐类水解的规律:
【补充说明】
多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小。
如:
碳酸钠在溶液中的变化:
第一步是Na2CO3在水溶液里电离出来的CO32—发生水解:
Na2CO3===2Na++CO32—
+
H2O
OH—+H+
HCO3—
CO32—+H2O
HCO3—+OH—
第二步是生成的HCO3—进一步发生水解:
HCO3—+H2O
H2CO3+OH—
【点拨】6、书写水解离子方程式的注意事项
(1)用可逆符号:
(2)多元弱酸根离子分步水解,第一步较易发生,水解方程式一般只需写第一步的水解。
(3)对于沉淀气体符号↓或↑-----不能标
【讲解】原因:
一般盐类的水解的程度很小,水解产物也很少,通常不生成沉淀或气体,也不发生分解。
【阅读】指导学生阅读课本P85《拓展视野》。
【讲解并板书】7、水解平衡常数Kh=Kw·
二、水解平衡的移动
实验编号
实验步骤
实验现象
实验结论
1
将盛有滴有酚酞的0.01mol•L—1CH3COONa溶液的试管放到酒精灯上加热,观察溶液的颜色变化
2
向盛有少量SnCl2•2H2O固体的试管中,注入适量水,带溶液中产生白色沉淀后,加入一定量的盐酸,振荡试管,观察现象
【问题】结合平衡移动原理分析原因
【总结】
(一)影响水解的因素
1、内因:
反应物本身的性质越弱越水解
2、外因:
符合勒夏特列原理
(1)温度
由于盐的水解作用是中和反应的逆反应,所以盐的水解是吸热反应,温度升高,水解程度增大。
(2)浓度
溶液浓度越小,盐的水解程度增大。
3)溶液的酸碱性(酸碱能够抑制水解)
【讨论】讨论在下列情况下CH3COONa溶液和NH4Cl溶液中的水解平衡将如何移动,水解程度有何变化?
(1)增加溶液中溶质的量,使盐的浓度加倍;
(2)将盐的浓度稀释为原来的一半;
(3)微微加热溶液;
(4)向溶液中滴加少量浓盐酸;
(5)向溶液中滴加少量浓NaOH溶液。
三、水解原理的应用
【讨论】讨论课本P87《交流•研讨》。
【讲解】泡沫灭火剂的使用方法和原理。
(1)泡沫灭火剂
药品:
NaHCO3溶液、Al2(SO4)3溶液
原理:
Al3++3H2O
Al(OH)3+3H+
OH—+H+===H2O
总反应:
3HCO3—+Al3+===Al(OH)3↓+3CO2↑
【举例】CH3COONH4、Al2S3的相互促进水解。
【讨论】像Al2S3这样的物质为什么不能在溶液中制备?
【阅读】阅读课本P88,回答水解的其他应用。
【
(2)明矾的净水
(3)热碱水去油污
(4)SnCl2、FeCl2的制备。
【小结】小结本节课的内容。
【作业】P893P894
【当堂检测】1、判断下列溶液的酸碱性,能水解的写出其水解离子方程式:
(1)FeCl3
(2)NaF(3)CuSO4
(4)K2CO3(5)KI(6)Al2(SO4)3
2、盐类水解过程中正确的说法是()
A.盐的电离平衡破坏B.水的电离平衡发生移动
C.溶液的pH发生改变D.没有发生中和反应
3、下列离子既能电离又能水解,且能与强酸或强碱反应的是()
A.CH3COO—B.HSO4—C.H2PO4—D.[Al(OH)4]—
4、NH4Cl溶液中,离子浓度由大到小的顺序正确的是()
A.c(NH4+)>
c(Cl—)>
c(H+)>
c(OH—)B.c(Cl—)>
c(NH4+)>
c(OH—)
C.c(H+)>
c(OH—)>
c(Cl—)D.c(Cl—)>
c(H+)
5、下列水解离子方程式正确的是()
A.Fe3++3H2O
Fe(OH)3+3H+
B.Br—+H2O
HBr+OH—
C.CO32—+2H2O
H2CO3+2OH—
D.NH4++2H2O
NH3·
H2O+H3O+
课后巩固案———跟踪训练,拓展提高
1下列事实中,能证明氯化氢是共价化合物的是()
A.氯化氢易溶于水 B.氯化氢的水溶液能导电
C.液态氯化氢不导电 D.氯化氢不易分解
2.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH()
A.>
7 B.<
7 C.=7 D.不能确定
3Na2CO3溶液存在着化学平衡:
Na2CO3+H2O
NaHCO3+NaOH
加热蒸干溶液,得到的固体是()
A.Na2CO3B.NaHCO3和NaOH C.NaOHD.Na2CO3和NaOH
4物质的量浓度相同的下列溶液:
①Na2CO3,②NaHCO3,③H2CO3,④(NH4)2CO3,⑤NH4HCO3,[CO32-]由小到大排列的顺序是()
A.⑤<
④<
③<
②<
①B.③<
⑤<
①C.③<
①D.③<
①
5明矾溶于水所得溶液中离子浓度关系正确的是()
A.[SO42-]=[K+]=[Al3+]>
[H+]>
[OH-]
B.[SO42-]=2[K+]>
[Al3+]>
[OH-]>
[H+]
C.1/2[SO42-]=[K+]>
D.[SO42-]+[OH-]=[K+]+[Al3+]+[H+]
A.①②B.③C.③④D.④
6将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是()
A.KClB.Mg(OH)2C.Na2CO3D.MgSO4
7将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系正确的是()
A.[NH4+]>
[Cl-]>
[OH-]B.[NH4+]>
[H+]
C.[Cl-]>
[NH4+]>
[OH-]D.[Cl-]>
8在某无色透明的酸性溶液中能够大量共存的离子组是()
A.K+、Na+、MnO4-、NO3- B.NH4+、Mg2+、K+、SO42-
C.Al3+、Ba2+、HCO3-、NO3-D.Ba2+、K+、CH3COO-、Cl-
9将物质的量浓度相同的醋酸和NaOH溶液混合后,溶液中[CH3COO-]=[Na+],则混合后溶液呈 (填“酸”、“碱”或“中”)性,醋酸与NaOH溶液体积大小关系是V(CH3COOH)(填“>
”、“=”或“<
”)V(NaOH)。
10在0.01mol•L-1氨水中加入物质:
①浓氨水,②纯水,③少量K2CO3,④少量浓硫酸,⑤少量NaOH固体,⑥少量Al2(SO4)3固体。
(1)能使[OH-]减小、[NH4+]增大的是 。
(2)能使[OH-]增大,[NH4+]减小的是 。
(3)能使[OH-]和[NH4+]都增大的是 。
(4)能使[OH-]和[NH4+]都减小的是 。
11已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离远大于第三步电离程度……,今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
A.HA+HC2-=A-+H2C-B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
请回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子,最易结合质子(H+)的是 ;
最难结合质子的是 。
(3)下列反应的离子方程式正确的是。
A.H3C+3A-=3HA+C3- B.HB-+A-=HA+B2-
(4)完成下列反应离子方程式
A.H3C+OH-(过量)=
B. HA(过量)+ C3-=
12(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的[HCO3-]变化趋势可能是:
①逐渐减小;
②逐渐增大;
③先逐渐增大,而后减小;
④先逐渐减小,而后增大。
4种趋势中可能的是 。
(2)pH相同的HCl溶液,H2SO4溶液、CH3COOH溶液各100mL。
①3种溶液中,物质的量浓度最大的是 。
②分别用0.1的NaOH溶液中和,其中消耗NaOH溶液最多的是 。
③反应开始时,反应速率 。
A.HCl最快 B.H2SO4最快 C.CH3COOH最快 D.一样快
(3)某温度下,纯水中的[H+]=2.0×
10-7mol•L-1,则此时[OH-]=。
相同条件下,测得①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液3种稀溶液的pH相同。
那么,它们的物质的量浓度由大到小的顺序是 。
1325℃时,KHS溶液里存在着下列平衡:
①HS-+H2O
OH-+H2S②HS-
H++S2—
(1) 是电离平衡, 是水解平衡。
(2)当向其中加入CuSO4溶液时,生成了CuS沉淀,则电离平衡向 移动,水解平衡向 移动,[H+]变 。
(填“大”或“小”)
(3)当向其中加入NaOH固体时,[S2—]变 。
(4)若将溶液加热至沸腾,[OH-]•[H+]将变 。
14常温下,pH=5的H2SO4和Al2(SO4)3溶液中,水的电离度分别为α1和α2,则α1和α2的关系为 ,由水电离出的[H+]之比为 。
15试用简单的实验证明,在醋酸溶液中存在着CH3COOH的电离平衡。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 盐类 水解
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 对中国城市家庭的教育投资行为的理论和实证研究.docx
对中国城市家庭的教育投资行为的理论和实证研究.docx
