 表格型中考化学计算题Word文档格式.docx
表格型中考化学计算题Word文档格式.docx
- 文档编号:18872560
- 上传时间:2023-01-01
- 格式:DOCX
- 页数:11
- 大小:29.89KB
表格型中考化学计算题Word文档格式.docx
《表格型中考化学计算题Word文档格式.docx》由会员分享,可在线阅读,更多相关《表格型中考化学计算题Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
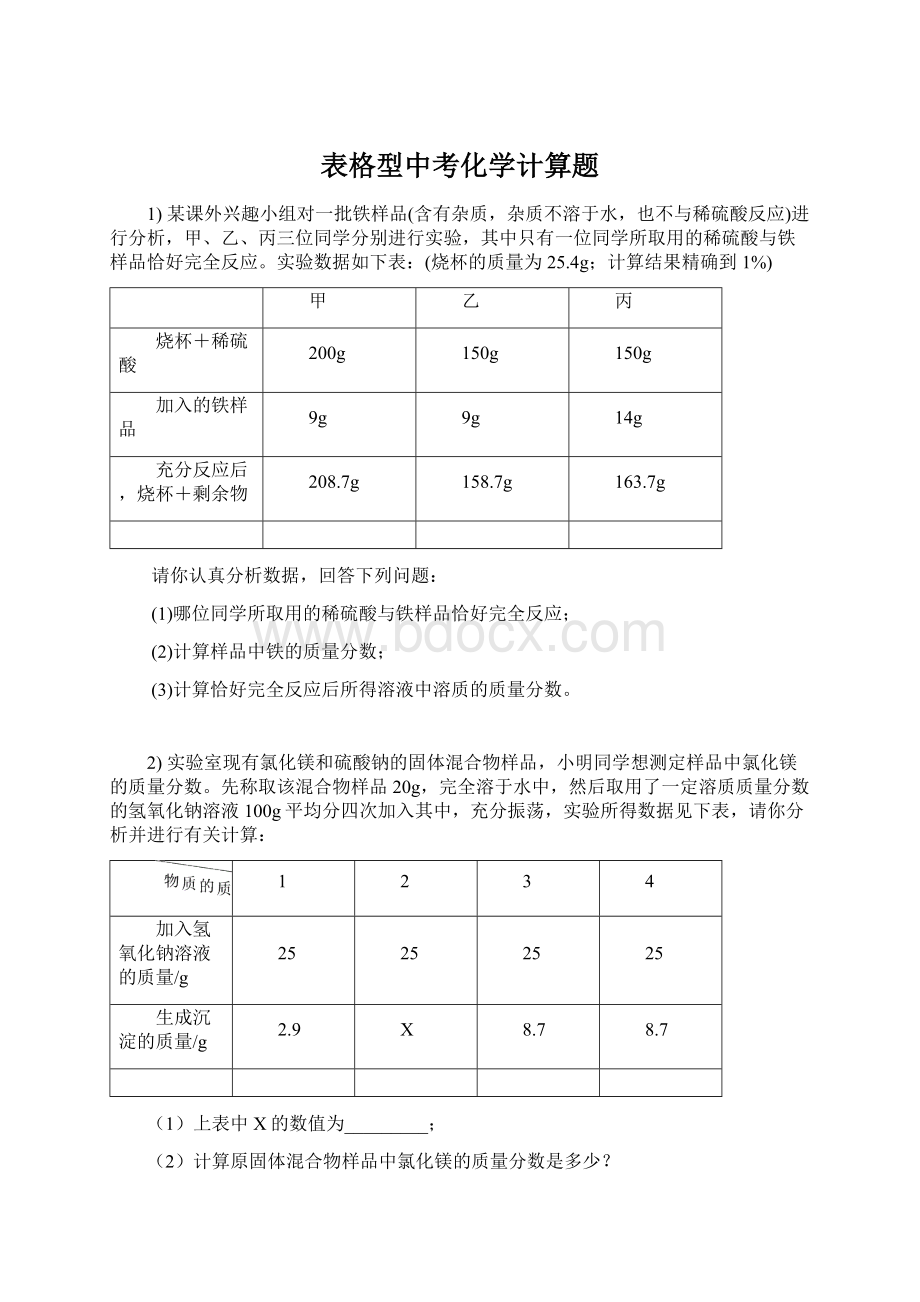
8.7
(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是多少?
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠
溶液现配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
3)某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:
碳酸钠≥96%。
为测定该产品中含碳酸钠的质量分数,进行了以下实验:
取12.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应。
实验数据记录如下:
所加盐酸的次数
第一次
第二次
第三次
第四次
盐酸的质量/g
烧杯及所盛物质总质量/g
181.2
204.4
228.6
253.6
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是g。
(2)该产品中碳酸钠的质量分数是否合格?
(要求写出计算过程,结果精确到0.1%)
4)为了测定一黄铜(铜、锌合金)样品中铜的质量分数,某中学化学实验小组的同学取一定质量的黄铜样品放入烧杯中,再取40g稀硫酸分四次加入烧杯中,均充分反应,实验数据如下:
加入稀硫酸质量(g)
10
剩余固体的质量(g)
9.10
8.45
7.90
(1)根据锌的质量求解第二次生成氢气的质量。
(4分)
(2)求出黄铜样品中铜的质量分数(精确到0.1%)(1分)
(3)求所用稀硫酸中溶质的质量分数;
(3分)
5)“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:
(烧杯质量均为56g)
烧杯+稀盐酸质量
139g
129g
加入黄铜样品质量
20g
24g
充分反应后,烧杯+剩余物质质量
158.8g
152.8g
148.8g
请回答下列问题:
(1)
同学取用的稀盐酸和样品恰好完全反应.
(2)第
(1)问中该同学制取的氢气质量是多少克?
。
(3)计算黄铜样品中锌的质量分数。
6)某市(课改实验区)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量
第一次加入5g
第二次加入5g
第三次加入5g
第四次加人5g
剩余固体的质量
3g
2g
lg
1g
(1)该石灰石样品中碳酸钙的质量分数是;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)
7)为了对海水中的氯化物(假设以NaCl计算)进行成分分析,甲、乙、丙三位同学分别进行实验数据如下,请仔细观察分析,回答下列问题:
所取海水样品的质量/g
100
50
加入AgNO3溶液的质量/g
75
反应后所得的沉淀物的质量/g
1.435
(1)两溶液恰好完全反应的是__________的实验。
(2)请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?
8)在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
配料
氯化钠、碘酸钾(KIO3)
含碘量
(20mg~30mg)/kg
保质期
18个月
食用方法
勿长时间炖炒
贮存方法
避光、避热、蜜蜂、防潮
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是;
(2)计算碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比;
(3)计算碘酸钾(KIO3)中,碘元素的质量分数是多少?
;
(计算结果精确到0.01,下同)
(4)计算1kg这样的食盐中,应加入g碘酸钾(用最高含碘量计算)
9)青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH2)2]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g。
(1)30g尿素中含氮元素多少克?
(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?
(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需
求(可以只摄取一种食物,也可同时摄取几种食物)。
食物
白面
鸡蛋
瘦猪肉
牛奶
蛋白质含量
10%
14%
20%
3%
10)某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用8g石灰石样品,把40g稀盐酸分为4次加入样品中(杂质既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
序号
加入稀盐酸的质量(g)
5.5
m
1.2
n
(1)从以上数据可知,这四次实验中,第_______次实验后石灰石样品中的碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
(3)上表中m和n的数值应均为多少?
(4)足量盐酸与100t这种石灰石反应,能得到二氧化碳的质量是多少?
11)甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:
各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
加入氢氧化钠溶液质量(g)
35.0
40.0
45.0
反应得到沉淀的质量(g)
2.5
试回答下列问题:
(1)上述实验中,__________同学所用的氢氧化钠溶液一定过量。
(2)求样品中氯化镁的含量(写出计算过程,结果精确到0.1%,下同)。
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数。
12)
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s
t0
t1
t2
t3
t4
t5
t6
反应后固体的质量m∕g
80
70
66
62
58
(1)当石灰石完全反应后,生成CO2的质量为g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
(3)请在下面坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线。
13)某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
实验序号
样品的质量/g
滤渣的质量/g
3.4
0.3
3.6
0.4
5.0
0.5
(1)该样品中碳酸钙质量分数的平均值为:
(结果精确到0.1%)。
(2)引起三次实验数据差异的操作原因可能是:
。
(3)若利用题
(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?
(结果精确到0.1t)
14)黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途。
晓军同学为了测定黄铜屑样品组成,分四次取样品与稀硫酸反应,其实验数据记录如下表:
样品质量/g
25.0
30.0
稀硫酸质量/g
120
产生气体质量/g
计算:
(1)黄铜样品(25.0g)中锌的质量
(2)所用稀硫酸中溶质质量分数
15)某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表。
样品
第1份
第2份
第3份
第4份
取样品质量(g)
50.0
取稀硫酸质量(g)
80.0
120.0
160.0
产生气体质量(g)
0.8
1.0
试计算:
⑴经分析,在第1份样品测得的数据中,(填物质)完全反应了。
(1分)
⑵列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数。
(6分)
⑶请在图4中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图。
(1分)
16)某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。
他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
实验次数
加入锌粒的质量(g)
8
12
充分反应后剩余物质的总质量(g)
103.9
107.8
111.8
请回答下列问题:
(1)第次实验,锌粒与稀硫酸恰好完全反应。
(2)计算稀硫酸的质量分数(写出计算过程)。
17)课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:
取40g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一
实验二
实验三
实验四
原固体混合物质量
10g
加入CaCl2溶液质量21世纪教育网
20g
30g
40g
生成的沉淀的质量
2g
m
5g
请分析表中数据回答并计算[(4)要求写计算过程]
(1)生成的沉淀是(填写化学式)。
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为g。
(3)m=g。
(4)原固体混合物中Na2CO3的质量分数是多少?
18)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。
某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。
每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g)
充分反应后剩余固体的质量(g)
第1次
20
17.4
第2次
14.8
第3次
12.2
第4次
12.0
第5次
(1)上述表格中m的值为;
(2)黄铜样品中锌的质量分数为;
(3)所用稀硫酸中硫酸的质量分数是多少?
19)今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:
为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。
分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯①
烧杯②
烧杯③
烧杯④
烧杯⑤
加入样品的质量/g
加入稀盐酸的质量/g
30
40
充分反应后生成气体的质量/g
0.88
1.76
3.52
(1)表中X的值为;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为g。
20)我市某校初三
(1)班学生去湖光岩春游,带回了几小块石灰石样品。
为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来讲行实验测定,(样品中的杂质不溶于水,且不与盐酸反应),测得数据如下表:
甲同学
乙同学
丙同学
丁同学
所取石灰石样品质量(g)
10.0
加入盐酸的质量(g)
20.0
30.0
45.0
50.0
剩余固体的质量(g)
6.0
4.0
1.0
试问答:
(1)10.0g样品与45g盐酸充分反应后,盐酸是否还剩余_____(填“是”或“否”),样品中碳酸钙的质量分数是______。
(2)10.0g样品与足量稀盐酸反应后可产生二氧化碳多少克?
(写出计算过程,计算结果精确到小数点后两位)
21)某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
5
稀盐酸的累计加入量
5.0g
10.0g
15.0g
20.0g
25.0g
1.5g
1.0g
0.5g
0.3g
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为,石灰石中碳酸钙的质量分数为。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 表格 中考 化学 算题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 对中国城市家庭的教育投资行为的理论和实证研究.docx
对中国城市家庭的教育投资行为的理论和实证研究.docx
 五大工具(三)MSA测量系统分析PPT格式课件下载.ppt
五大工具(三)MSA测量系统分析PPT格式课件下载.ppt
