 北京市海淀区届高三上学期期末考试化学试题解析版Word文档下载推荐.docx
北京市海淀区届高三上学期期末考试化学试题解析版Word文档下载推荐.docx
- 文档编号:18857779
- 上传时间:2023-01-01
- 格式:DOCX
- 页数:24
- 大小:1.15MB
北京市海淀区届高三上学期期末考试化学试题解析版Word文档下载推荐.docx
《北京市海淀区届高三上学期期末考试化学试题解析版Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《北京市海淀区届高三上学期期末考试化学试题解析版Word文档下载推荐.docx(24页珍藏版)》请在冰豆网上搜索。
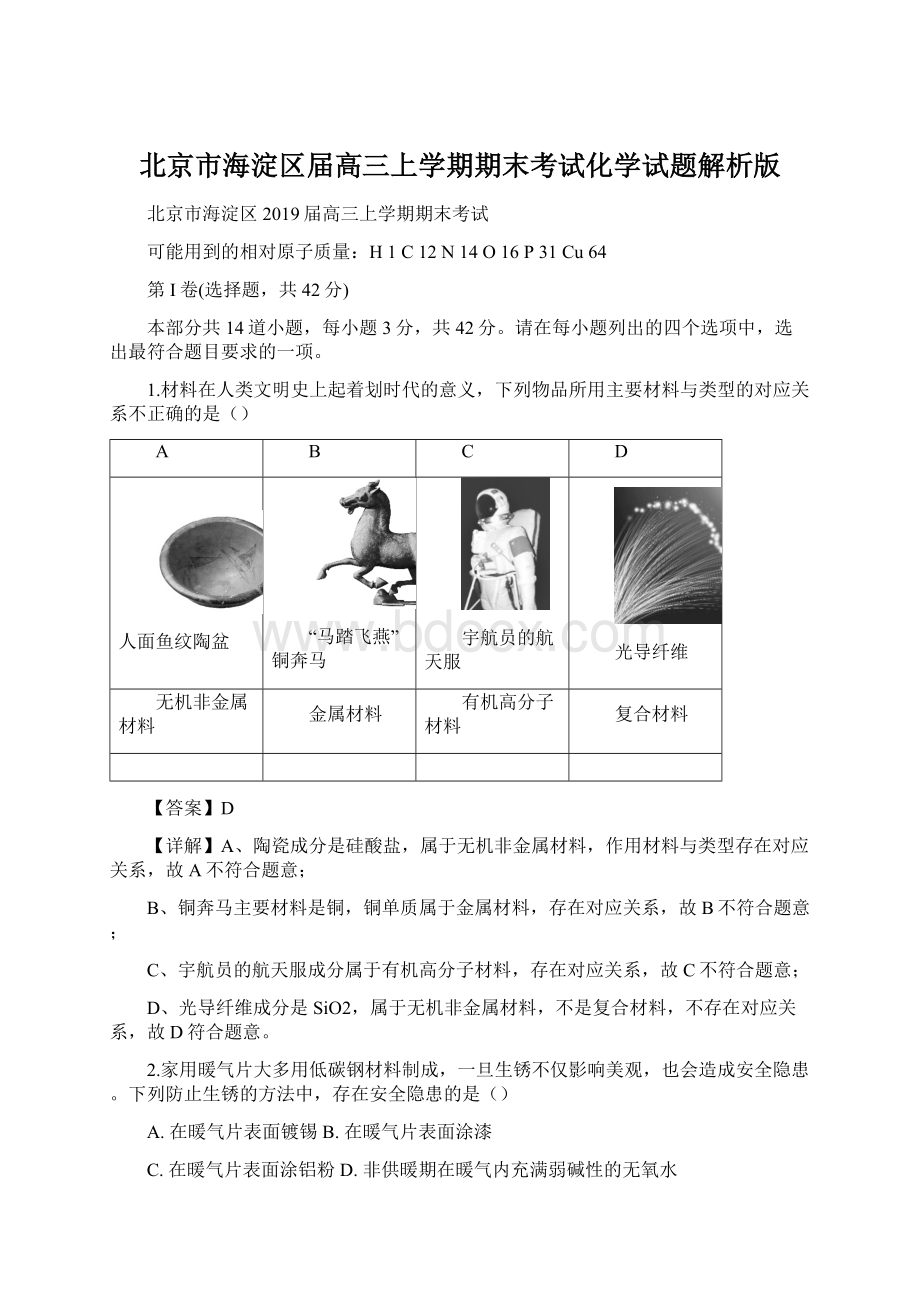
3.常温下,将2种一元酸HX和HY分别和NaOH溶液等体积混合,实验数据如下:
组别
混合前
混合后
甲
c(HX)=0.1mol·
L-1
c(NaOH)=0.1mol·
pH=9
乙
c(HY)=0.1mol·
pH=7
下列说法正确的是()
A.HY为强酸B.HX溶液的pH=1
C.甲的混合液中c(X-)=c(Na+)D.乙的混合液中c(Na+)>
c(Y-)
【分析】无论哪组溶液都是恰好完全反应,都生成正盐,依据盐类水解的规律,以及混合后的pH,判断HX和HY是强酸还是弱酸。
【详解】A、根据乙组,两种溶液等体积混合,且两种溶液浓度相等,两种溶液恰好生成NaY,溶液显中性,该盐为强酸强碱盐,即HY为强酸,故A正确;
B、两种溶液物质的量浓度相同,即两种溶液等体积混合,恰好完全反应生成NaX,混合后pH=9,溶液显碱性,即HX为弱酸,HX溶液的pH>
1,故B错误;
C、甲的混合液中,溶质为NaX,HX为弱酸,X-发生水解,即c(Na+)>
c(X-),故C错误;
D、以的混合液中,溶质为NaY,HY为强酸,即c(Na+)=c(Y-),故D错误。
4.NaCl是我们生活中必不可少的物质。
将NaCl溶于水配成1mol·
L-1的溶液,溶解过程如图所示,下列说法正确的是()
A.a离子为Na+
B.溶液中含有NA个Na+
C.水合b离子的图示不科学
D.室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
【答案】C
【分析】根据半径大小比较的方法,a离子为Cl-,b离子为Na+,然后溶解过程图示进行分析。
【详解】A、Na+核外有2个电子层,Cl-核外有3个电子层,即Cl-的半径大于Na+,a离子为Cl-,b为Na+,故A错误;
B、题目中没有说明溶液的体积,无法计算NaCl的物质的量,即无法判断Na+的数目,故B错误;
C、H2O中H+显+1价,b为Na+,根据同电相斥异电相吸的原理,Na+应被氧原子“包围”,即水合b离子的图示不科学,故C正确;
D、NaCl是强酸强碱盐,水溶液显中性,即pH=7,故D错误。
【点睛】易错点是选项B,学生仍为NaCl物质的量浓度为1mol·
L-1,则溶液Na+的物质的量为1mol,忽略了物质的量、物质的量浓度之间的关系,即n=Vc。
5.114号元素为Fl(中文名“
”),它是主族元素,其原子核外最外层电子数是4。
下列说法不正确的是()
A.Fl的原子核外有114个电子B.Fl是第七周期第IVA族元素
C.Fl在同主族元素中金属性最强D.Fl的原子半径小于同主族其他元素
【详解】A、根据核电荷数=原子序数=质子数,即F1的核电荷数为114,F1原子:
质子数=核外电子数=117,故A说法正确;
B、F1为主族元素,最外层电子数是4,即属于IVA族,114号元素位于第七周期,即F1位于第七周期第IVA族元素,故B说法正确;
C、同主族从上到下金属性逐渐增强,即F1在同主族元素中金属性最强,故C说法正确;
D、同主族从上到下,原子半径逐渐增大,即F1的原子半径大于同主族其他元素,故D说法错误。
【点睛】易错点是选项B,判断元素在周期表的位置,需要掌握每一周期最后一种元素的系数,即2、10、18、36、54、86、118,然后根据主族元素的最外层电子数等于族序数进行判断。
6.锌锰碱性干电池是依据原电池原理制成的化学电源。
电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。
下列关于原电池和干电池的说法不正确的是()
A.两者正极材料不同
B.MnO2的放电产物可能是KMnO4
C.两者负极反应式均为Zn失电子
D.原电池中Zn与稀H2SO4存在自放电现象
【答案】B
【详解】A、左图为干电池,干电池的正极材料是碳棒,右图为原电池,正极材料是铜单质,两者正极材料不同,故A说法正确;
B、干电池中MnO2应作氧化剂,Mn的化合价降低,故B说法错误;
C、所给装置中Zn为负极,Zn失去电子,故C说法正确;
D、根据自放电现象的定义,Zn与稀硫酸能够发生反应,即原电池中Zn与稀硫酸存在自放电现象,故D说法正确。
7.取1mL0.1mol·
L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1mol·
L-1):
A.实验①白色沉淀是难溶的AgClB.由实验②说明AgI比AgCl更难溶
C.若按①③顺序实验,看不到黑色沉淀D.若按②①顺序实验,看不到白色沉淀
【分析】利用反应向着更难溶的方向进行分析。
【详解】A、AgNO3溶液中加入NaCl溶液,发生Ag++Cl-=AgCl↓,即实验①中白色沉淀是AgCl,故A说法正确;
B、实验②中加入过量KI溶液,出现黄色沉淀,说明产生AgI,即发生AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),推出AgI比AgCl更难溶,故B说法正确;
C、实验③得到黑色沉淀,该黑色沉淀为Ag2S,推出Ag2S比AgI更难溶,溶解度由大到小的顺序是AgCl>
AgI>
Ag2S,按①③顺序实验,能观察黑色沉淀,故C说法错误;
D、根据选项C分析,按照②①顺序实验,生成更难溶的AgI,不能得到AgCl,即无法观察到白色沉淀,故D说法正确。
8.下列事实与所对应的离子方程式正确的是()
A.室温下,测定醋酸钠溶液的pH>
7:
CH3COONa===CH3COO-+Na+
B.实验室用氯化铝溶液和氨水制备氢氧化铝:
Al3++3OH-===Al(OH)3↓
C.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:
Na2S2O3+2H+===SO2↑+S↓+2Na++H2O
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:
CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)
【详解】A、CH3COONa属于强碱弱酸盐,CH3COO-发生水解,CH3COO-+H2O
CH3COOH+OH-,是溶液显碱性,故A错误;
B、NH3·
H2O是弱碱,不能拆写成离子形式,正确的是Al3++3NH3·
H2O=Al(OH)3↓+3NH4+,故B错误;
C、Na2S2O3是可溶的强电解质,需要拆写成离子形式,正确的是S2O32-+2H+=SO2↑+S↓+H2O,故C错误;
D、CaSO4是微溶物,CaCO3是难溶物,因此可以发生CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),故D正确。
9.聚碳酸酯(
)的透光率良好。
它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。
它可用绿色化学原料X(
)与另一原料Y反应制得,同时生成甲醇。
A.Y的分子结构中有2个酚羟基B.Y的分子式为C15H18O2
C.X的核磁共振氢谱有1个吸收峰D.X、Y生成聚碳酸酯发生的是缩聚反应
【分析】根据该化合物结构简式,以及题中信息,推出形成该化合物的单体为
和
,然后进行分析。
【详解】根据该化合物结构简式,推出形成该化合物的单体为
,
A、根据上述分析,Y的结构简式为
,Y分子中含有2个酚羟基,故A说法正确;
B、Y的分子式为C15H16O2,故B说法错误;
C、X的结构简式为
,只有一种氢原子,核磁共振氢谱有1个吸收峰,故C说法正确;
D、根据聚碳酸酯的结构简式,X和Y生成聚碳酸酯的反应是缩聚反应,故D说法正确。
10.为探究电解的放电规律,进行如下实验:
序号
阳极材料
阴极材料
电解质
阳极产物
阴极产物
①
石墨
0.1mol·
L-1CuCl2溶液
Cl2
Cu
②
L-1NaCl溶液
H2
③
0.2mol·
L-1CuSO4溶液
O2
④
铜
Cu2+
⑤
熔融NaCl
Na
A.对比①②可知,阴极放电顺序是:
Cu2+>
H+>
Na+
B.对比①③可知,阳极放电顺序是:
Cl->
OH->
SO42-
C.对比③④可知,阳极是铜时,会先于溶液中的离子放电
D.对比①⑤可知,电解得到金属只能用熔融态,不能用水溶液
【详解】A、①中阳离子是Cu2+和H+,阴极产物是Cu,放电顺序是Cu2+>
H+,②中阳离子是Na+和H+,阴极产物是H2,放电顺序是H+>
Na+,综上所述,放电顺序是Cu2+>
H+>
Na+,故A说法正确;
B、根据选项A的分析,阳极放电顺序是Cl->
OH->
SO42-,故B说法正确;
C、根据④实验,Cu为阳极时,Cu先失去电子,故C说法正确;
D、①实验中电解质为水溶液,通过电解得到金属单质,故D说法错误。
11.以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为:
反应I:
SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq)ΔH1=﹣213kJ·
mol-1
反应II:
H2SO4(aq)===SO2(g)+H2O(l)+
O2(g)ΔH2=+327kJ·
反应III:
2HI(aq)===H2(g)+I2(g)ΔH3=+172kJ·
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为:
2H2O(l)===2H2(g)+O2(g)ΔH=+286kJ·
D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
【详解】A、通过流程图,反应II和III,实现了太阳能到化学能的转化,故A说法正确;
B、根据流程总反应为H2O=H2↑+1/2O2↑,SO2和I2起到催化剂的作用,故B说法正确;
C、反应I+反应II+反应III,得到H2O(l)=H2(g)+1/2O2(g)△H=(-213+327+172)kJ·
mol-1=+286kJ·
mol-1,或者2H2O(l)=2H2(g)+O2(g)△H=+572kJ·
mol-1,故C说法错误;
D、△H只与始态和终态有关,该过程降低了水分解制氢的活化能,△H不变,故D说法正确。
12.科学家很早就提出锂-空气电池的概念,它直接使用金属锂作电极,从空气中获得O2,和以LiFePO4作电极的锂离子电池相比,增大了电池的能量密度(指标之一是单位质量电池所储存的能量)。
右图是某种锂-空气电池的装置示意图,放电时,下列说法不正确的是()
A.金属锂为负极
B.若隔膜被腐蚀,不会影响该电池正常使用
C.多孔碳电极上发生的电极反应为:
O2+2H2O+4e-===4OH-
D.锂-空气电池能量密度大的原因之一是转移等量电子时,金属锂比LiFePO4质量小
【分析】通过原电池的工作原理进行分析。
【详解】A、Li是活泼金属,根据装置示意图,金属锂为负极,故A说法正确;
B、锂是活泼金属,能与水发生反应,隔膜被腐蚀后,锂与水接触,锂与水反应,不符合该电池设计原理,因此隔膜被腐蚀,影响该电池正常使用,故B说法错误;
C、根据装置示意图,多孔碳电极为正极,电解质溶液显碱性,正极反应式为O2+2H2O+4e-=4OH-,故C说法正确;
D、锂作负极,其电极反应式为Li-e-=Li+,LiFePO4作电极时,电极反应式为FePO4+Li+e-=LiFePO4,根据电池能量密度的定义,相同质量时,Li失去电子物质的量多,锂-空气电池能量密度大的原因之一是转移等量电子时,金属锂比LiFePO4质量小,故D说法正确。
【点睛】本题难点是选项B,学生弄不清楚选项B是否正确,因为忽略了锂是碱金属,能与水反应,隔膜破损后,锂与水发生反应,不符合该电池设计原理。
需要学生平时对基础知识熟记和学会运用。
13.H2O2是一种“绿色”试剂,许多物质都会使较高浓度的H2O2溶液发生催化分解。
实验发现,向H2O2溶液中加入Br2可以加快其分解速率。
有人提出反应机理可能有2步,第1步反应为:
H2O2+Br2===2H++O2↑+2Br-。
A.H2O2分子中含有离子键和非极性键
B.在第1步反应中,每生成0.1molO2,转移0.4mol电子
C.机理中第2步反应为:
2H++H2O2+2Br-===2H2O+Br2
D.若在加入Br2的H2O2溶液中检出Br-,则说明第1步反应发生了
【详解】A、H2O2属于共价化合物,其结构式为H-O-O-H,含有共价键,不含离子键,故A错误;
B、第1步反应中,生成0.1molO2,转移电子物质的量为0.1×
2×
1mol=0.2mol,故B错误;
C、H2O2分解反应方程式为2H2O2=2H2O+O2↑,根据第1步反应,推出第2步反应为2H++H2O2+Br-=2H2O+Br2,故C正确;
D、Br2能与水反应生成Br-,因此该溶液中检验出Br-,不能说明第1步发生,故D错误。
【点睛】易错点选项B,注意H2O2中氧原子化合价,H2O2中O显-1价,转变成0价的氧原子,化合价变化1价,转移电子物质的量为0.1×
1mol=0.1mol。
14.某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。
为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:
Cu(OH)2+4NH3
[Cu(NH3)4]2++2OH-;
平衡II:
Cu(OH)2+2OH-
[Cu(OH-)4]2-
项目
废水水质
排放标准
pH
1.0
6~9
Cu2+/mg·
72
≤0.5
NH4+/mg·
2632
≤15
A.废水中Cu2+处理的最佳pH约为9
B.b~c段:
随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C.c~d段:
随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
【详解】A、根据图像,在pH=9时,Cu元素的含量最小,即废水中Cu2+处理的最佳pH约为9,故A说法正确;
B、b~c段:
pH增大,c(OH-)增大,根据勒夏特列原理,平衡I中,Cu(OH)2增大,平衡向逆反应方向移动,故B说法错误;
C、c~d段:
pH增大,c(OH-)增大,平衡I向逆反应方向进行,铜元素含量下降,故C说法正确;
D、d点以后,c(OH-)增大,平衡II向正反应方向进行,生成Cu[(OH-)4]2-,铜元素含量增大,故D说法正确。
第II卷(非选择题,共58分)
15.香豆素类化合物M具有抗病毒、抗癌等多种生物活性。
下图是M和聚合物E的合成路线。
已知:
(1)A中官能团是_______。
(2)B→
的反应类型是________。
(3)化合物F能与FeCl3溶液发生显色反应,其结构简式是________。
F有多种同分异构体,其中属于芳香族化合物、且为醇类物质的结构简式是________。
(4)G的结构简式是________。
(5)D→聚合物E的化学方程式是________。
(6)已知
,将下列G→K的流程图补充完整:
【答案】
(1).羧基(或—COOH)
(2).取代反应(3).
(4).
(5).
(6).
(7).I为:
J为:
K为:
【分析】根据A的分子式,以及A与Cl2反应生成的产物,推出A结构简式为CH3COOH,CH2ClCOOH与碳酸钠反应生成B,利用羧酸的酸性碳酸,推出B为CH2ClCOONa,根据信息①,以及D的分子式,推出D的结构简式为CH3CH2OOCCH2COOC2H5,根据信息②,以及E为聚合物,推出E的结构简式为
,根据问题(3),F能与FeCl3溶液发生显色反应,说明F中含有酚羟基,根据流程中F的生成的产物,推出F中含有甲基,且酚羟基和甲基邻位,F的结构简式为
,根据信息③,推出G的结构简式为
,根据M的结构简式,推出K的结构简式为
;
【详解】根据A的分子式,以及A与Cl2反应生成的产物,推出A结构简式为CH3COOH,CH2ClCOOH与碳酸钠反应生成B,利用羧酸的酸性强于碳酸,推出B为CH2ClCOONa,根据信息①,以及D的分子式,推出D的结构简式为CH3CH2OOCCH2COOC2H5,根据信息②,以及E为聚合物,推出E的结构简式为
(1)根据上述分析,以及A的结构简式,推出A中官能团是羧基;
(2)根据上述分析,B与NaCN发生反应类型为取代反应;
(3)F的结构简式为
,同分异构体符合的条件是属于芳香族化合物和醇,因此符合条件的结构简式为
(4)G的结构简式为
(5)根据信息②,D生成聚合物E的化学反应方程式为
(6)G生成I发生水解反应,即I的结构简式为
,I生成J发生酸化和酯化反应,即J的结构简式为
,K的结构简式为
。
16.以废治废、变废为宝可以实现资源的综合利用。
用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,转化关系如图所示:
(1)A溶液中一定含有的溶质是_______。
(2)若使③中水解程度变大,可采取的措施是_______(填字母序号)。
a.加热b.加入NaHCO3c.加入NH4Cl
(3)写出③中水解生成Fe2(OH)mCl6-m反应的化学方程式:
______。
(4)将废铁块进行预处理制成电极,通过电解制备高铁酸钠,该装置原理示意图如图所示。
铁块做_______(填“阳极”或“阴极”),对应的电极反应式为_______。
(5)高铁酸钠在水中缓慢产生红褐色沉淀和一种气体,该反应的离子方程式:
_______。
【答案】
(1).FeCl2
(2).ab(3).2FeCl3+mH2O
Fe2(OH)mCl6-m+mHCl(4).阳极(5).Fe-6e-+8OH-===FeO42-+4H2O(6).4FeO42-+10H2O===4Fe(OH)3↓+3O2↑+8OH-(Fe2O3或水合物,合理正确)
【详解】
(1)废铁快与盐酸反应:
Fe+2HCl=FeCl2+H2↑,即A溶液中一定含有的溶质为FeCl2;
(2)a、A溶液被氧化,即FeCl2被氧化成FeCl3,FeCl3发生水解,水解是吸热反应,即加热促进Fe3+水解,故a正确;
b、加入NaHCO3,Fe3+与HCO3-发生双水解反应,促进Fe3+水解,故b正确;
c、加入NH4Cl,NH4+水解生成H+,
抑制Fe3+水解,水解程度降低,故c错误;
(3)根据聚合氯化铁的化学式,生成聚合氯化铁的化学反应方程式为2FeCl3+mH2O
Fe2(OH)mCl6-m+mHCl;
(4)根据实验目的,制备高铁酸钠,Fe应失去电子转化成FeO42-,Fe的化合价升高,根据电解原理,铁作阳极,环境为碱性,阳极反应式为Fe+8OH--6e-=FeO42-+4H2O;
(5)红褐色沉淀为Fe(OH)3,Fe元素化合价降低,氧元素的化合价升高,即气体为O2,该反应的离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-。
【点睛】难点是电极反应式的书写,一般先写出还原剂、氧化产物,或氧化剂、还原产物,本题制备高铁酸钠,应是铁失去电子转化成FeO42-,即Fe→FeO42-,标出得失电子物质的量,化合价变化3价,即Fe-3e-→FeO42-,应注意电解质的酸碱性,因此电极反应式为Fe+8OH--6e-=FeO42-+4H2O。
17.含氮、磷污水过量排放引起的水体富营养化是当前备受关注的环境问题。
(1)氮肥、磷肥都可以促进作物生长。
氮、磷元素在周期表中处于同一主族,从原子结构角度分析它们性质相似的原因是_______,性质有差异的原因是_______。
(2)氮的化合物在水中被细菌分解,当氧气不充足时,在反硝化细菌的作用下,细菌利用有机物(又称碳源,如甲醇)作为电子供体,将硝态氮的化合物(含NO3-)连续还原最终生成N2,发生反硝化作用,完成下述反应的方程式:
+5CH3OH
↑+CO32-+4HCO3-+
(3)某小组研究温度对反硝化作用的影响。
在反应器内添加等量的相同浓度的甲醇溶液,从中取污泥水混合液分置于4个烧杯中,使4个烧杯内的温度不同,将实验数据作图如图。
由图像分析产生差异的原因是:
(4)某小组研究浓度对反硝化作用的影响。
①保持其他条件相同,在反应器内添加不等量的甲醇溶液,使4个烧
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 北京市 海淀区 届高三上 学期 期末考试 化学试题 解析
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 对中国城市家庭的教育投资行为的理论和实证研究.docx
对中国城市家庭的教育投资行为的理论和实证研究.docx
