 最新高中化学第二章分子结构与性质第一节共价键课时作业Word文档下载推荐.docx
最新高中化学第二章分子结构与性质第一节共价键课时作业Word文档下载推荐.docx
- 文档编号:18487402
- 上传时间:2022-12-17
- 格式:DOCX
- 页数:16
- 大小:48.65KB
最新高中化学第二章分子结构与性质第一节共价键课时作业Word文档下载推荐.docx
《最新高中化学第二章分子结构与性质第一节共价键课时作业Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《最新高中化学第二章分子结构与性质第一节共价键课时作业Word文档下载推荐.docx(16页珍藏版)》请在冰豆网上搜索。
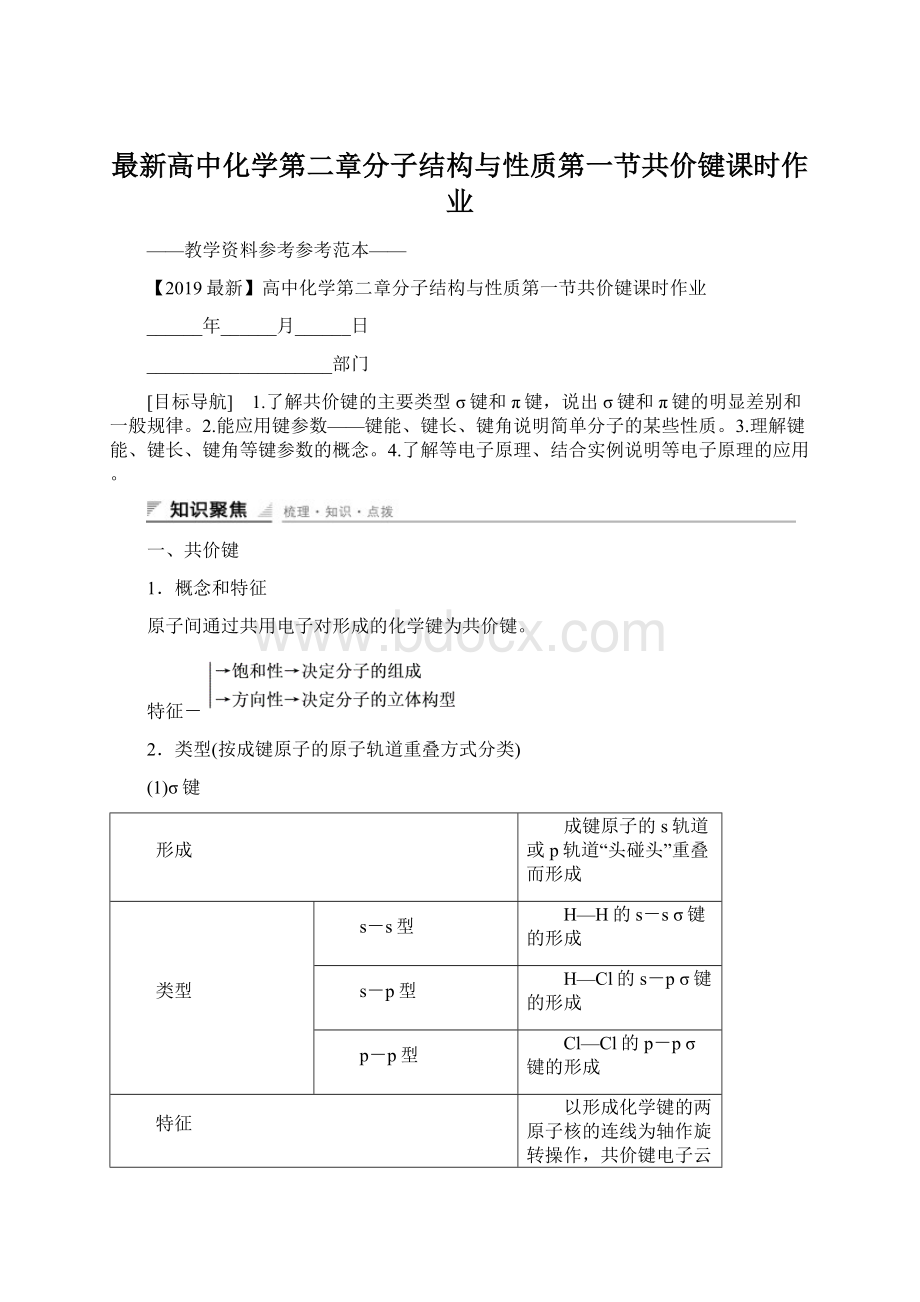
乙烯分子中由5个σ键和1个π键组成;
乙炔分子中由3个σ键和2个π键组成。
二、键参数——键能、键长与键角
1.概念和特点
概 念
特 点
键能
气态基态原子形成1mol化学键释放的最低能量
键能越大,键越稳定
键长
形成共价键的两个原子之间的核间距
键长越短,键能越大,键越稳定
键角
分子内两个共价键之间的夹角
表明共价键有方向性,决定分子的立体结构
2.对物质性质的影响
2.N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
答案 由教材表2 1中键能的数值可知:
H—F>
H—O>
H—N,而键长:
H—F<
H—O<
H—N,说明分子的稳定性:
HF>
H2O>
NH3,所以N2、O2、F2跟H2的反应能力依次增强。
三、等电子体
1.等电子原理
原子总数相同、价电子总数相同的分子具有相似的结构特征,它们的许多性质是相近的。
2.等电子体
满足等电子原理的分子称为等电子体。
如CO和N2具有相同的原子总数和相同的价电子总数,属于等电子体,它们的许多性质相似。
3.写出常见的18电子微粒,讨论电子数相同的微粒与等电子体是否相同?
答案 电子数相同的微粒是指微粒中所有的电子数之和相同,但微粒中原子的数目不一定相同,如18电子的微粒有S2-、HS-、Cl-、Ar、K+、Ca2+、H2S、H2O2、N2H4、C2H6、CH3OH等。
等电子体是指原子总数相等、价电子总数相同的微粒,其电子总数不一定相同。
如N2O与CO2,其原子数、价电子数、电子总数相等;
SO2和O3其原子数相同、价电子数相同,但电子总数SO2为32,O3电子总数为24,显然电子总数不同。
一、共价键的类型——σ键和π键
【例1】 下列有关化学键类型的判断不正确的是( )
A.s—sσ键与s—pσ键的对称性不同
B.分子中含有共价键,则至少含有一个σ键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
答案 C
解析 s—sσ键无方向性,s—pσ键轴对称,A项对;
在含有共价键的分子中一定有σ键,可能有π键,如HCl、N2等,B项对。
单键都为σ键,乙烷分子结构式为,其6个C—H键和1个C—C键都为σ键,D项正确;
共价双键中有一个为σ键,另一个为π键,共价三键中有一个为σ键,另外两个为π键,故乙炔(H—C≡C—H)分子中有2个C—Hσ键,C≡C键中有1个σ键、2个π键,C项错。
规律总结
1.共价键
2.σ键和π键的比较
键类型
σ键
π键
原子轨道重叠方式
沿键轴方向相对重叠
沿键轴方向平行重叠
原子轨道重叠部位
两原子核之间,在键轴处
键轴上方和下方,键轴处为零
原子轨道重叠程度
大
小
键的强度
较大
较小
化学活泼性
不活泼
活泼
变式训练1 下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有1个σ键,2个π键
解析 气体单质分子中,可能有σ键,如Cl2;
可能有π键,如N2;
也可能没有化学键,如稀有气体。
【例2】 关于键长、键能和键角,下列说法中不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.C===C键等于C—C键键能的2倍
D.因为O—H键的键能小于H—F键的键能,所以O2、F2与H2反应的能力逐渐增强
解析 键角是描述分子立体结构的重要参数,如H2O中两个H—O键的键角为105°
,故H2O为V形分子,A项正确;
键长的大小与成键原子的半径有关,如Cl的原子半径小于I的原子半径,Cl—Cl键的键长小于I—I键的键长,此外,键长还和成键数目有关,如乙烯分子中C===C键的键长比乙炔分子中C≡C键的键长要大,B项正确;
C===C键的键能为615kJ·
mol-1,C—C键的键能为347.7kJ·
mol-1,二者不是2倍的关系,C项错误;
O—H键的键能为462.8kJ·
mol-1,H—F键的键能为568kJ·
mol-1,O—H键与H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定,O2、F2跟H2反应的能力依次增强,D项正确。
共价键强弱的判断
1.由原子半径和共用电子对数判断:
成键原子的原子半径越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。
2.由键能判断:
共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。
3.由键长判断:
共价键的键长越短,共价键越牢固,破坏共价键消耗的能量越多。
4.由电负性判断:
元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键越稳定。
变式训练2 下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间可能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键的键能为467kJ·
mol-1,即18gH2O分解成H2和O2时,消耗能量为934kJ
答案 B
解析 D项中,H—O键键能为467kJ·
mol-1,指的是气态基态氢原子和氧原子形成1molH—O键时释放的最低能量,则拆开1molH—O键形成气态氢原子和氧原子所需吸收的能量也为467kJ,18gH2O即1molH2O中含2molH—O键,断开时需吸收934kJ的能量形成气态氢原子和氧原子,再进一步形成H2和O2时,还需释放出一部分能量,故需知H—H键和O===O键的键能,D项错误;
查表知Li的电负性为1.0,I的电负性为2.5,其差值为1.5<
1.7,所以LiI中存在共价键,B项正确。
三、等电子体的判断和应用
【例3】
(1)根据等电子原理,仅由第二周期元素组成的共价分子中,互为等电子体的是________和________;
________和________。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。
在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
________。
答案
(1)N2 CO CO2 N2O
(2)SO2、O3
解析
(1)仅由第二周期元素组成的共价分子中,即C、N、O、F组成的共价分子,如N2与CO价电子总数均为10,CO2与N2O价电子总数均为16个电子。
(2)依题意,只要原子数相同,各原子最外层电子数之和也相同,即可互称等电子体,NO2-为三原子,各原子最外层电子数之和为(5+6×
2+1),SO2、O3也为三原子,各原子最外层电子数之和为6×
3=18。
1.判断方法
原子总数相同,价电子总数相同的分子。
2.应用
等电子体的许多性质是相近的,空间构型是相同的。
利用等电子体可以:
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
(3)利用等电子原理针对某物质找等电子体。
3.一些常见的等电子体
二原子10电子的等电子体:
N2、CO、CN-、C22-
二原子11电子的等电子体:
NO、O2+
三原子16电子的等电子体:
CO2、CS2、N2O、CNO-、N3-
三原子18电子的等电子体:
NO2-、O3、SO2
四原子24电子的等电子体:
NO3-、CO32-、BF3、SO3(g)
4.等电子体的快速找法
(1)将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、N3-和CNO-互为等电子体。
(2)将粒子中的一个或几个原子换成原子序数增加(或减少)n的元素带n个单位电荷的阳离子(或阴离子),如N2O和N3-互为等电子体。
(3)同主族元素最外层电子数相等,故可将粒子中的元素原子换成同主族元素原子,如O3和SO2互为等电子体。
变式训练3 1991年,Langmuir提出:
“凡原子数与价电子总数均相等的物质,其结构相同,物理性质相近”,称为等电子原理。
相应的物质互称为等电子体。
化学科学家常用“等电子体”来预测不同物质的结构与性质。
例如,CH4与NH4+有相同的价电子数及空间构型。
请你根据等电子原理在下表空格处填上相应的化学式:
CH4
CO32-
C2O42-
NH4+
N2H62+
NO2+
答案 见下表:
C2H6
CO2
NO3-
N2O4
解析 本题考查等电子原理的应用。
等电子体的要求是必须具有相同的原子总数和价电子总数,分子与离子也可以是等电子体。
N2H62+是含有8个原子和14个价电子的微粒,比NH4+多3个原子和6个价电子,NH4+与CH4互为等电子体,而比CH4多3个原子和6个价电子的微粒为C2H6,同理可得其他几组答案。
1.下列关于共价键的说法不正确的是( )
A.H2S分子中两个共价键的键角接近90°
的原因是共价键有方向性
B.N2分子中有一个σ键,两个π键
C.两个原子形成共价键时至少有1个σ键
D.在双键中,σ键不如π键稳定
答案 D
2.与NO3-互为等电子体的是( )
A.SO2B.BF3C.CH4D.NO2
解析 等电子体是原子总数和价电子总数均相同的粒子,NO3-的原子数是4,价电子数是24,与其相同的是BF3。
3.下列分子中最难断裂成原子的是( )
A.HFB.HClC.HBrD.HI
答案 A
解析 因为原子半径I>
Br>
Cl>
F,电负性F>
I,所以它们与H原子形成的氢化物分子的键能EH-F>
EH-Cl>
EH-Br>
EH-1。
键能越大,化合物越难断裂成原子。
4.下列说法中能说明BF3分子中的4个原子位于同一平面的是( )
A.任意两个B—F键间的夹角相等
B.3个B—F键键能相等
C.3个B—F键键长相等
D.任间两个B—F键间的夹角为120°
解析 键参数中,键能和键长是用于判断共价键稳定性的依据,而键角是判断分子立体构型的依据。
3个B—F键间的夹角均为120°
时,正好构成一个以B原子为中心的平面结构,因此4个原子共平面。
5.下面物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③B.③④⑤⑥C.①③⑥D.③⑤⑥
解析 当两个原子间能形成多对共用电子对时,要先形
成一个σ键,另外的原子轨道只能形成π键,N2分子中有三个共价键:
一个σ键,两个π键,C2H4分子中两个碳原子之间有两个共价键;
一个σ键,一个π键;
C2H2分子中碳碳原子之间有三个共价键:
一个σ键,两个π键。
6.某些共价键的键能数据如下表(单位:
kJ·
mol-1)
共价键
H—H
436
Cl—Cl
243
Br—Br
193
H—Cl
432
H—I
298
I—I
151
N≡N
946
H—O
463
H—N
393
(1)把1molCl2分解为气态原子时,需要________(填“吸收”或“放出”)________kJ能量。
(2)由表中所列化学键形成的单质分子中,最稳定的是________,最不稳定的是________;
形成的化合物分子中最稳定的是________,最不稳定的是________。
(3)试通过键能数据估算下列反应的反应热:
H2(g)+Cl2(g)===2HCl(g) ΔH=________。
答案
(1)吸收 243
(2)N2 I2 H2O HI
(3)-185kJ·
mol-1
解析 本题主要考查键能的定义以及键能与化学键稳定性的关系。
(1)键能是指气态基态原子形成1mol化学键释放的最低能量,新键形成释放能量,则旧键断裂必然吸收能量,根据能量守恒定律断开1molCl—Cl键吸收的能量等于形成1molCl—Cl键释放的能量。
(2)键能越大,化学键越稳定,越不容易断裂,化学性质越稳定,因此最稳定的单质为N2,最不稳定的单质是I2,最稳定的化合物是H2O,最不稳定的化合物是HI。
(3)ΔH=E(反应物键能之和)-E(生成物键能之和)=(436+243-2×
432)kJ·
mol-1=-185kJ·
mol-1。
[经典基础题]
1.下列说法中正确的是( )
A.p轨道之间以“肩并肩”重叠可形成σ键
B.p轨道之间以“头对头”重叠可形成π键
C.s和p轨道以“头对头”重叠可形成σ键
D.共价键是两个原子轨道以“头对头”方式重叠形成的
解析 A项p轨道之间以“肩并肩”重叠形成的是π键;
B项p轨道之间以“头对头”重叠可形成σ键;
D项形成共价键还可能是两个原子轨道以“肩并肩”重叠形成。
2.下列有关σ键的说法错误的是( )
A.如果电子云图像是由两个s电子重叠形成的,即形成s—sσ键
B.s电子与p电子形成s—pσ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个s—pσ键
解析 p电子与p电子若“头碰头”重叠即形成p—pσ键。
3.下列分子中存在的共价键类型完全相同的是( )
A.CH4与NH3B.C2H6与C2H4
C.H2与Cl2D.Cl2与N2
解析 A项中全是s—pσ键;
B项中C2H6只存在σ键,而C2H4存在σ键和π键;
C项中H2中的键为s—sσ键,Cl2中的键为p—pσ键;
D项与B项类似。
4.参考下表化学键的键能数据,判断下列分子中受热最稳定的是( )
化学键
H—F
H—Br
键能/kJ·
568
431
366
A.H2B.HFC.HClD.HBr
解析 共价键的键能越大,越不容易被破坏,意味着化学键越稳定,分子也越稳定。
5.下列说法正确的是( )
A.键角决定了分子的结构
B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C.CH4、CCl4中键长相等,键角不同
D.C===C中的键能是C—C中的键能的两倍
解析 分子结构是由键角和键长共同决定的,A项错。
CH4、CCl4分子均为正四面体型,它们的键角相同,键长不等,C错。
C===C中的双键由一条σ键和一条π键构成,通常而言σ键键能大于π键键能,故C===C中的键能应小于C—C键键能的两倍,D错。
6.N2的结构可以表示为,CO的结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是( )
A.N2分子与CO分子中都含有三键
B.CO分子与N2分子中的π键并不完全相同
C.N2与CO互为等电子体
D.N2与CO的化学性质相同
解析 从题图可以看出,N2分子与CO分子中均含有一个σ键和两个π键,所以二者都含有三键,A项正确;
N2分子中的π键是由每个氮原子各提供两个p电子以“肩并肩”方式形成的,而CO分子中的一个π键是由氧原子单方面提供电子对形成的,B项正确;
N2与CO的原子总数和价电子总数均相同,互为等电子体,二者化学性质相似,但并不完全相同,C项正确,D项错误。
7.下列说法中正确的是( )
A.在气体单质分子中,一定含有σ键,可能含有π键
B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C.等电子体结构相似,化学性质相同
D.共价键的方向性决定了原子在形成分子时相互结合的数量关系
解析 在单质分子中,可能存在σ键(如H2、Cl2)、π键(如N2分子中存在σ键、π键),而稀有气体为单原子分子,不存在化学键,A项错误;
烯烃中含有碳碳双键,其中一个是π键,因π键易断裂,故化学性质较活泼,B项正确;
等电子体结构相似,但化学性质不同,C项错误;
共价键的方向性决定分子的立体构型,饱和性决定分子中各原子的数量关系,D项错误。
8.能够用键能的大小作为主要依据来解释的是( )
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是难挥发性酸
C.稀有气体一般难发生化学反应
D.空气中氮气的化学性质比氧气稳定
解析 共价分子构成物质的状态与分子内共价键的键能无关;
物质的挥发性与分子内键能的大小无关;
稀有气体是单原子分子,无化学键,难发生化学反应的原因是它们的价电子已达稳定结构;
氮气比氧气稳定是由于N2分子中共价键的键能(946kJ·
mol-1)比O2分子中共价键的键能(497.3kJ·
mol-1)大,在化学反应中更难断裂。
9.有以下物质:
①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2O2,⑧HCN(H—C≡N)。
(1)只含有极性键的是________。
(2)只含有非极性键的是________。
(3)既有极性键,又有非极性键的是________。
(4)只有σ键的是________。
(5)既有σ键,又有π键的是________。
答案
(1)①③⑧
(2)②④ (3)⑤⑥⑦ (4)①②③⑥⑦
(5)④⑤⑧
解析 根据同种原子形成的共价键是非极性键,不同种原子形成的共价键是极性键,共价单键是σ键,双键中一个是σ键、另一个是π键,共价三键由一个σ键、两个π键组成,进行分析、判断。
[能力提升题]
10.现有四种短周期元素A、B、C、D,已知:
①C、D在同一周期,A、B在同一主族;
②它们可以组成化合物A2C、B2C2、DC2、D2A4等;
③B的阳离子与C的阴离子的核外电子排布相同;
④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。
请回答:
(1)写出元素符号:
A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为________;
按原子轨道重叠方式,其非极性键的类型是________。
化合物DC2的结构式________。
(3)A2C分子的电子式________,按原子轨道重叠方式,其共价键的类型是________。
D2A4是平面形分子,其分子中含有________个σ键,________个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式______________________________________;
B2C2与DC2反应的化学方程式______________________________________;
B与A2C反应的离子方程式__________________________________________。
答案
(1)H Na O C
(2)Na+[·
×
O·
·
·
]2-Na+ p—pσ键 O===C===O
(3)H·
H s—pσ键 5 1
(4)2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
2Na+2H2O===2Na++2OH-+H2↑
解析 由A2与气体C2按体积比2∶1混合后点燃能发生爆炸,其产物是一种常温下常见的无色无味的液体,可知该液体是H2O,A是H元素,C是O元素;
由B与A2C反应生成气体A2知,B是Na元素;
由B2C2同A2C或DC2反应都生成气体C2知,D是碳元素。
11.已知下表中的数据是破坏1mol物质中的化学键所消耗的最低能量(kJ)。
物质
能量(kJ)
Cl2
Br2
I2
H2
HF
565
HCl
HBr
363
HI
297
根据表中数据回答问题:
(1)下列物质本身具有的能量最低的是________。
A.H2B.Cl2C.Br2D.I2
(2)下列氢化物中,最稳定的是________。
A.HFB.HClC.HBrD.HI
(3)X2+H2===2HX(X代表F、Cl、Br、I)的反应是吸热反应还是放热反应?
(4)相同条件下,X2分别与H2反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
2molCl2在一定条件下与等物质的量的H2反应,放出或吸收的热量是________kJ。
(5)若无上表中的数据,你能正确回答出问题(4)的第一问吗?
________;
你的理由是__________________________________________________________。
答案
(1)A
(2)A (3)放热反应 (4)F2 366 (5)能 生成物越稳定,放出的热量就越多,在HX中,HF最稳定
解析 能量越低越稳定,破坏其中的化学键需要的能量就越多,形成其中的键时放出的能量也越多。
12.下列粒子:
N2、CO2、NH3、N2O、O2、NO2、NO和CO。
(1)互为等电子体的粒子有
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 最新 高中化学 第二 分子结构 性质 第一节 共价键 课时 作业
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《雷雨》中的蘩漪人物形象分析 1.docx
《雷雨》中的蘩漪人物形象分析 1.docx
