 化学平衡教案基于问题的教案Word格式文档下载.docx
化学平衡教案基于问题的教案Word格式文档下载.docx
- 文档编号:18419929
- 上传时间:2022-12-16
- 格式:DOCX
- 页数:11
- 大小:26.23KB
化学平衡教案基于问题的教案Word格式文档下载.docx
《化学平衡教案基于问题的教案Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化学平衡教案基于问题的教案Word格式文档下载.docx(11页珍藏版)》请在冰豆网上搜索。
提出反应程度的问题,引入化学平衡的概念。
结合所学过的速率、浓度知识有助于理解抽象的化学平衡的概念的实质。
【分析】在一定条件下,2molSO2与1molO2反应体系中各组分速率与浓度的变化并画图。
回忆,思考并作答。
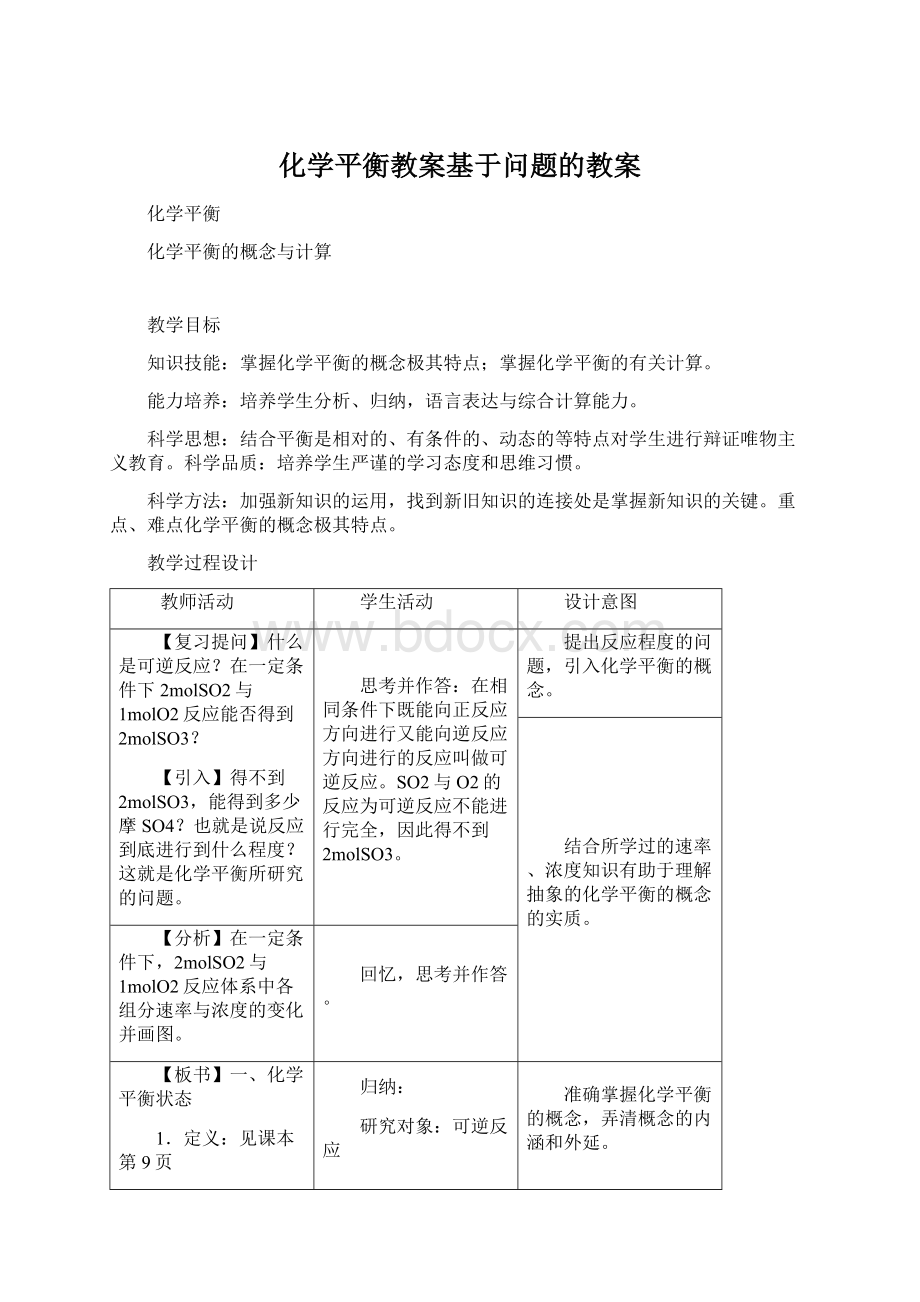
【板书】一、化学平衡状态
1.定义:
见课本第9页
【分析】引导学生从化学平衡研究的范围,达到平衡的原因与结果进行分析、归纳。
归纳:
研究对象:
可逆反应
平衡前提:
温度、压强、浓度一定
原因:
v正=v逆(同一种物质)
结果:
各组成成分的质量分数保持不变。
准确掌握化学平衡的概念,弄清概念的内涵和外延。
【提问】化学平衡有什么特点?
【引导】引导学生讨论并和学生一起小结。
讨论并小结。
平衡特点:
等(正逆反应速率相等)
定(浓度与质量分数恒定)
动(动态平衡)
变(条件改变,平衡发生变化)
培养学生分析问题与解决问题的能力,并进行辩证唯物主义观点的教育。
加深对平衡概念的理解。
讨论题:
在一定温度下,反应
2NO2
N2O4达平衡的标志是()。
(A)混合气颜色不随时间的变化
(B)数值上v(NO2生成)=2v(N2O4消耗)
(C)单位时间内反应物减少的分子数等于生成物增加的分子数
(D)压强不随时间的变化而变化
(E)混合气的平均分子量不变
讨论结果:
因为该反应如果达平衡,混合物体系中各组分的浓度与总物质的量均保持不变,即颜色不变,压强、平均分子量也不变。
因此可作为达平衡的标志(A)、(D)、(E)。
加深对平衡概念的理解,培养学生分析问题和解决问题的能力。
【过渡】化学平衡状态代表了化学反应进行达到了最大程度,如何定量的表示化学反应进行的程度呢?
2.转化率:
在一定条件下,可逆反应达化学平衡状态时,某一反应物消耗量占该反应物起始量的质量分数,叫该反应物的转化率。
公式:
a=△c/c始×
100%
通过讨论明确由于反应可逆,达平衡时反应物的转化率小于100%。
通过掌握转化率的概念,公式进一步理解化学平衡的意义。
3.平衡的有关计算
(1)起始浓度,变化浓度,平衡浓度。
例1
445℃时,将0.1molI2与0.02molH2通入2L密闭容器中,达平衡后有0.03molHI生成。
求:
①各物质的起始浓度与平衡浓度。
②平衡混合气中氢气的体积分数。
【小结】①起始浓度、变化浓度、平衡浓度三者的关系,只有变化浓度
引导学生分析:
I2+H2(气)
2HI
c始/mol/L0.010.050
c变/mol/Lx
x
2x
c平/mol/L/
0.015
0+2x=0.015
x=0.0075mol/L
平衡浓度:
c(I2)平=C(I2)始-△C(I2)
=0.05-0.0075
=0.0425mol/L
c(H2)平=0.01-0.0075
通过具体计算弄清起始浓度、变化浓度、平衡浓度三者之间的关系,掌握有关化学平衡的计算。
才与方程式前面的系数成比例。
②可逆反应中任一组分的平衡浓度不可能为0。
(2)转化率的有关计算
例2
02molCO与0.02×
100%=4.2%mol水蒸气在2L密闭容器里加热至1200℃经2min达平衡,生成CO2和H2,已知V(CO)=0.003mol/(L·
min),求平衡时各物质的浓度及CO的转化率。
【小结】变化浓度是联系化学方程式,平衡浓度与起始浓度,转化率,化学反应速率的桥梁。
因此,抓变化浓度是解题的关键。
(3)综合计算
例3
一定条件下,在密闭
容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有100molN2,求平衡后N2、H2、NH3的物质的量及N2的转化率。
【小结】方法一是结合新学的起始量与平衡量之间的关系从每种物质入手来考虑,方法二是根据以前学过的差量从总效应列式,方法二有时更简单。
=0.0025mol/L
c(HI)平=c(HI)始+△c(HI)
=0.015mol/L
w(H2)=0.0025/(0.05+0.01)
思考并分析:
CO+H2O
CO2+H2
△c(CO)=V(CO)·
t
=0.003mol/(L·
min)×
2min
=0.006mol/L
a=△c/c(始)×
=0.006/0.01×
=60%
分析
方法一:
设反应消耗xmolN2
N2+3H2
2NH3
△n(始)100
300
0
△n
3x2
x
n(平)100-x300-3x
(mol)
x=40mol
n(N2)平=100-x=100-40
=60mol
n(N2)平=300-3x=180mol
a=40/100×
100%=40%
方法二:
设有xmolN2反应
2NH3
△n
1
2
2
x
2x
巩固转化率的概念并弄清转化率与变化浓度,速率化学方程式之间的关系。
通过一题多解将不同过程的差量计算与平衡计算联系起来加深对平衡的理解,加强对所学知识(如差量的计算,阿伏加德罗定律的计算)的运用,培养学生综合思维能力和计算能力。
强调重点,加强学法指导。
设计意图
【课堂小结】今天我们重点学习了化学平衡的概念及有关计算,比较抽象,希望大家加强练习,以便熟练地掌握平衡的概念。
【随堂检测】1.对于一定温度下的密闭容器中,可逆反应H2+I2
2HI达平衡的标志是()。
(A)压强不随时间的变化而变化
(B)混合气的平均分子量一定
(C)生成nmolH2同时生成2nmolHI
(D)v(H2)=v(I2)
2.合成氨生产中,进入塔内的氮气和氢气体积比为1∶3,p=1.52×
107Pa(150atm),从合成塔出来的氨占平衡混合气体积的16%,求合成塔出来的气体的压强。
平衡时NH3的体积分数为:
n(平NH3)/n(平总)×
=n(平NH3)/(n始-△n)
=2x/(400-2x)×
=25%
x=40mol
(以下计算与上面相同)
巩固课堂所学内容。
附:
随堂检测答案1.(C)2.1.31×
107Pa(129.4atm)
浓度、温度对化学平衡的影响
掌握化学平衡移动的概念及浓度,温度对化学平衡的影响。
依据对实验的观察和所学的知识进行分析、判断、综合等,培养学生的逻辑思维能力。
化学平衡是有条件的,相对的,对学生进行辩证唯物主义观点的教育。
培养严谨、求实的科学思想。
激发学生的求知欲,去探索自然科学的奥秘。
重点、难点
浓度、温度对化学平衡的影响。
【复习提问】上节课我们已经学习了化学平衡,什么是化学平衡状态?
它有什么特点?
回忆,思考并回答。
加深对平衡概念的理解并为本节课所学内容作知识上的铺垫。
【实验引入】取6mL0.01mol/L
FeCl3溶液,加入2滴0.01mol/L
KSCN溶液。
将所得溶液分为两等
份,在其中一份中加入2滴1mol/
LKSCN溶液。
【提问】
(1)上述混合体系是否达到了化学平衡状态?
为什么?
(2)这两次平衡是否是同一平衡状态?
【分析】引导学生分析平衡态一变为平衡态二的过程中速率的变化,同时画出v-t图(速率-时间图),引出化学平衡移动的概念。
(见附1)
分析:
达到了化学平衡状态,因为颜色不再变化说明混合体系中各组分的浓度一定,但这两次平衡不能叫同一平衡状态,因为外加条件发生了变化,各组分的浓度也发生了变化,表现在第二次达平衡的平衡体系中血红色加深
了。
通过具体的实验引出平衡移动的概念,吸引学生的注意力,激发学习
兴趣。
【板书】二、影响化学平衡的条件
(一)化学平衡的移动
引导学生看书第10页并强调:
移动原因:
正逆反应速率由相
等到不等最后又相等。
移动结果:
混合体系中各物质
的质量分数发生了变化。
看书并画出重点:
如果一个可逆反应达到平衡状态以后,反应条件(如浓度,压强,温度等)改变了,平衡混合物里各组成物质的含量也就随着改变而达到新的平衡状态,这叫做化学平衡的移动。
准确掌握化学
平衡移动概念。
【过渡】哪些条件可以使化学平衡发生移动?
速率发生了变化,化学平衡一定移动吗?
(二)影响化学平衡(移动)的条件
1.浓度
结合上面所做的实验与学生一
起分析归纳。
讨论归纳。
培养学生语言表达能力,逻辑思维能力及科学思维方法。
条件改变
平衡移动方向
原因
结果
增大反应物浓度
正反应方向
v正>v逆消
耗反应物
减小反应物浓度逆
反应方向
v正<v逆
补充反应物
增大生成物浓度逆
反应方向
v正<v逆
消耗生成物
减小生成物浓度正
v正>v逆
补充生成物
【小结】
(1)平衡移动方向与外加条件、正逆反应速率相对大小、平衡移动结果三者的关系,谁增耗谁,谁减补谁,但不能将外加条件削减为0。
(2)对于固体或纯液体来说,它们的浓度是常数,改变它们的量,平衡不移动。
2.温度对化学平衡的影响
【实验】
观察实验并思考:
(1)在升温和降温时,容器内气体颜色发生了怎样的变化?
平衡如何移动?
(2)在升温或降温过程中正逆反应速率如何变化?
(3)如何用速率的变化解释平衡移动方向?
培养学生结合实验和所学知识分析、归纳、综合思考,最后得出正确结论的能力。
并弄清温度对化学反应速率的影响与化学平衡之间的关系。
【提问】上述思考题
【引导】引导学生分析温度对反应速率,平衡移动方向之间的关系。
小结:
(1)升温
速率:
v吸增大>v放增大,平衡向吸热反应方向移动。
(2)降温
v吸减小<v放减,小平衡向放热反应方向移动。
(3)平衡移动削弱了温度的改变,但并不等于完全消除。
【提问】催化剂能改变化学反应速率,能否使化学平衡发生移动?
请大家阅读课本第14页,并画出v-t(速率-时间)曲线图。
看书画出v-t(速率-时间)曲线图并得出以下结论:
化学平衡发生移动,速率一定发生变化;
但速率发生变化,平衡不一定发生移动。
进一步加深对化学平衡移动概念的理解。
【随堂检测】
1.在下列反应中,升高温度能使混合气平均分子量减小同时能使反应物转化率增大的是(
)。
(A)CO+H2O(气)CO2+H2+Q
(B)2SO3(气)2SO2+O2-Q
(C)2HCl
H2+Cl2-Q
(D)CaO+CO2
CaCO3+Q
2.某一可逆反应A+B→C在一定条件下达平衡,C的质量分数与时间、温度的关系如下图所示,则正反应为()反应。
3.对于平衡体系CO(气)+H2O(气)CO2(气)+H2(气)+Q,当其他条件不变时,增大某一反应物的浓度,平衡向正反应方向移动,则下列说法一定正确的是(
(A)生成物浓度一定增大
(B)反应物的浓度一定减小
(C)任一生成物的体积分数一定增大
(D)反应物转化率一定增大
【小结】今天我们重点学习了化学平衡移动的概念及浓度,温度对化学平衡的影响,下节课我们将着重讨论压强对化学平衡的影响。
【作业】课本第14页1,2题
附1:
附2:
随堂检测答案1.(B)
2.放热
3.(A)
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 化学平衡 教案 基于 问题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《雷雨》中的蘩漪人物形象分析 1.docx
《雷雨》中的蘩漪人物形象分析 1.docx
