 化学四川省德阳市龙台中学学年高二上学期期中考试Word文档下载推荐.docx
化学四川省德阳市龙台中学学年高二上学期期中考试Word文档下载推荐.docx
- 文档编号:17983546
- 上传时间:2022-12-12
- 格式:DOCX
- 页数:13
- 大小:221.32KB
化学四川省德阳市龙台中学学年高二上学期期中考试Word文档下载推荐.docx
《化学四川省德阳市龙台中学学年高二上学期期中考试Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《化学四川省德阳市龙台中学学年高二上学期期中考试Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
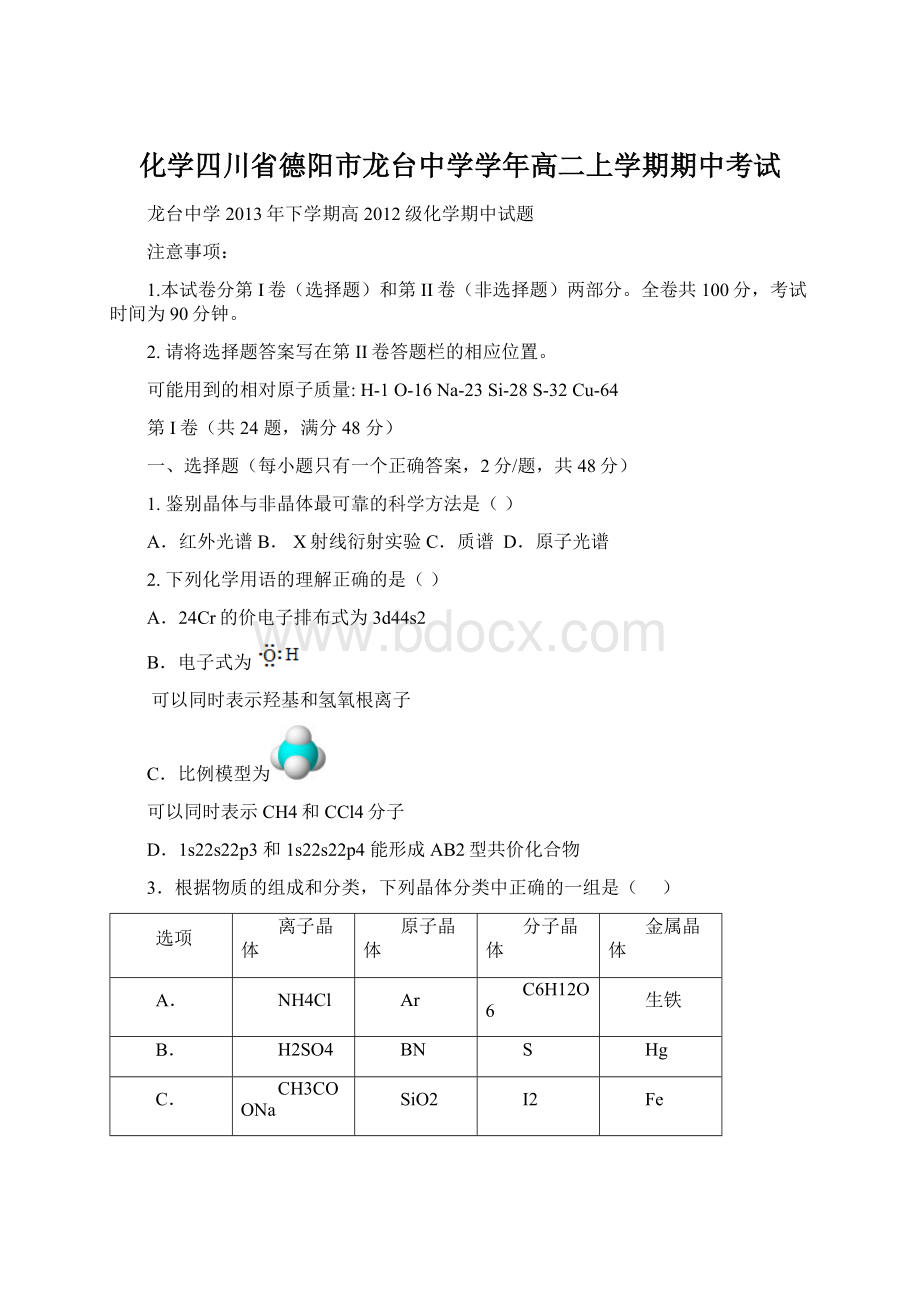
Hg
C.
CH3COONa
SiO2
I2
Fe
D.
Ba(OH)2
玛瑙
普通玻璃
Cu
4.已知含氧酸可用通式XOm(OH)n来表示,如X是S,当m=2,n=2,则可表示H2SO4。
一般而言,该式中m大的是强酸。
下列酸性最强的是( )
A.HMnO4B.H2SeO3C.H3BO3D.HClO2
5.下列推论正确的是( )
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH
为正四面体结构,可推测PH
也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线形的非极性分子,可推测C5H12也是碳链为直线形的非极性分子
6.下列的排序不正确的是( )
A.晶体熔点由低到高:
CF4<
CCl4<
CBr4<
CI4B.沸点由高到低:
Na>
M
g>
Al
C.硬度由大到小:
金刚石>
SiC>
晶体硅D.晶格能由大到小:
MgF2>
NaCl>
NaBr
7.下列关于杂化轨道的叙述中,错误的是()
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.气体单质中(除稀有气体),一定有σ键,可能有π键
C.杂化前后的轨道数不变,但轨道的形状发生了改变
D.sp3、sp2、sp杂化轨道的夹角分别一定为109°
28′、120°
、180°
8.同分异构体现象在有机化学中是非常普遍的,下列互为同分异构体的是()
①
②
③CH3CH2CH3
④HC
CCH3⑤
⑥CH3CH=CHCH3
A.①和②B.①和③C.①和④D.⑤和⑥
9.现有四种晶体的晶胞,其微粒排列方式如下图,其中化学式不属AB型的是()
10.在通常条件下,下列性质排列正确的是( )
A.熔点:
MgO>
KCl>SiO2>CO2B.水中溶解性:
HCl>NH3>H2S>SO3
C.热稳定性:
HF>H2O>NH3D.沸点:
戊烷>2-甲基丁烷>乙烷>丁烷
11.A元素的阳离子与B元素的阴离子具有相同的电子层结构,下列叙述正确的组合是()
①原子半径A<B;
②离子半径A>B;
③原子序数A>B;
④原子最外层电子数A﹤B;
⑤A的正价与B的负价绝对值一定相等;
⑥A的电负性小于B的电负性;
⑦A的第一电离能大于B的第一电离能。
A.①②⑦B.③④⑥C.③⑤D.③④⑤⑥⑦
12.根据物质的熔点、沸点数据,推断错误的是( )
晶体
NaCl
MgO
AlCl3
SiCl4
B(硼)
熔点℃
801
2852
180
-70
2300
沸点℃
1465
-----
177
57
2500
A.晶体的沸点CCl4<SiCl4B.在火山喷出的岩浆,晶出顺序为MgO先于NaCl
C.用AlCl3通过电解法冶炼铝D.硼的硬度大,不溶于水,但能与NaOH溶液反应
13.对作用力、性质叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·
5H2O都存在配位键
⑥NaCl、HF、CH
3CH2OH、SO2都易溶于水,但原因不完全相同
A.①③B.②④C.②⑤D.④⑥
14.科学家经研究证实光可诱发下列化学变化:
这一事实可解释人眼的夜视功能。
有关X、Y的叙述中错误的是()
A.X和Y不互为手性异构B.X和Y的所有原子都可能处于同一平面内
C.一定条件下X和Y都可与7molH2加成反应D.X和Y都易溶于水
15.查资料表知,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4。
下列关于钋的说法错误的是()
A.上图的堆积方式空间利用率太低,金属极少采取这种堆积方式
B.钋晶体中原子的配位数为6
C.钋基态原子的能层数=周期序数=价电子数
D.钋的常见化合价为+4、+6、-2价
16.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:
①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:
①6,②8,③8,④12
D.空间利用率的大小关系为:
①<
②<
③<
④
17.下列有关晶体的大小比较不正确的是( )
A.阴离子的配位数:
CsCl>NaCl>CaF2B.热分解温度:
BaCO3>CaCO3>MgCO3
C.熔点:
NaF>MgF2>AlF3D.硬度:
C3N4>金刚石>碳化硅
18.某有机物的结构为下图,该有机物不可能具有的性质是()
①可以燃烧氧化;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生一个分子内或n个分子间酯化反应;
⑤能发生加聚反应;
⑥它有手性碳原子
⑦能被催化氧化成醛⑧该有机物的碳原子存在sp2、sp3杂化
A.①④B.④⑥C.⑤⑦D.只有⑥
19.除去下列物质的少量杂质(括号内为杂质),所选试剂和分离方法不能达到实验目的是( )
混合物(杂质)
试剂
分离方法
A
乙酸乙酯(乙酸)
饱和的Na2CO3溶液
分液
B
淀粉(氯化钠)
蒸馏水
渗析
C
BaSO4(AgCl)
氨水
过滤
D
BeO(Al2O3)
NaOH溶液
20.氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。
常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是()
A.S2Cl2的结构式为Cl-S-S-Cl
B.S2Br2与S2Cl2结构相似,熔沸点:
S2Br2>
S2Cl2
C.S2Cl2为含有极性键和非极性键的非极性分子
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
21.NA表示阿伏加德罗常数的值,下列说法中正确的是()
A.标准状况下4.48LSO2和2.24LO2充分反应后,生成0.2NASO3
B.12gSiO2原子晶体中含有0.4NASi-O键
C.1.8g冰中含有氢键数为0.4NA
D.7.8gNa2S和Na2O2混合物中含有的阴离子数目为0.1NA
22.下列说法正确的是()
A.氢键有方向性和饱和性,属于共价键
B.分子形成氢键一定使物质的熔沸点升高
C.甲醇(CH3OH)比甲硫醇(CH3SH)熔点高,原因是甲醇分子间易形成氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
23.正硼酸(H3BO3)是一种片层状结构白色晶体,受热易分解。
层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中正确的是( )
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.1molH3BO3晶体中含有3mol氢键
D.分子中硼原子最外层为8电子稳定结构
第II卷(共5题,满分52分)
24.(7分)现有下列物质,请用对应的化学用语和解释填空:
金刚石二氧化硅过氧化钠Al干冰冰氩气N2CH4
(1)通过非极性键形成的原子晶体的杂化轨道类型为。
(2)与N2互为等电子体的常见气体在水中的溶解性比N2(“大、小”)。
(3)不含化学键的分子晶体,其组成元素在周期表中的位置为:
(写出周期和族)。
(4)Al能导电的原因是
(5)(3分)食盐晶体如下图所示。
在晶体中,表示Na+,表示Cl—。
已知食盐的密度为g/cm3,NaCl摩尔质量Mg/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl的间距大约是
25.(共10分)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为,微粒间存在的作用力是。
(3)氧化物MO的电子总数与SiC的相等,则M为(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是
。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。
CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健。
从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
。
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;
B的分子也属于非极性分子,但既有非极性键,又有极性键;
C的分子属于极性分子。
则可推出:
A的电子式是,B的结构式是。
(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol。
则可计算出1mol硅与足量氧气反应时将放出kJ的热量。
26.(13分)现有部分前四周期元素的性质、原子结构如下表:
元素编号
元素性质、原子结构
第三周期中的半导体材料
L层s电子数比p电子数少1
第三周期主族元素中其电负性最大
D
元素的2p轨道无空轨道,且有两个单电子
(1)B常见单质分子的电子式为,含有σ键和π键个数比为。
元素B的气态氢化物的VSEPR模型为,B的气态氢化物、Cl2、O2三种气体在水中的溶解性差异大的的原因是有
。
(2)这四种元素形成的单质晶体的沸点从高到低顺序为>>>(写对应化学式),你的比较依据是。
(3)BC3分子中B原子的杂化轨道类型为,用电子式表示其形成过程为:
(4)元素B的10e-氢化物与元素C的18e-的氢化物反应得到的产物的晶体类型为
(5)如图所示某A与氧离子的空间结构示意图(虚线不表示共价键)。
通过观察分析,下列叙述正确的有()
A、键角为120℃B、化学组成为SiO32-
C、键角为109°
28′D、化学组成为SiO44-
27.(9分)雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:
AlMg、金属性AlMg。
(选填“>”、“<”、“=”)
(2)一种铝镍合金的结构如下图,与其结构相似的化合物是。
A.氯化钠B.氯化铯C.石英D.金刚石
(3)雷尼镍催化的一实例为:
化合物b中进行sp3杂化的原子有(填元素符号)
(4)实验室检验Ni2+可用丁二酮肟与之作用生成红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为。
②在配合物中画氢键、配位键(已知镍的配位数为4)。
28.(13分)铜及其合金是人类最早使用的金属材料。
(1)金属铜采用下列堆积方式(填字母代号)。
(2)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下:
则胆矾晶体中含有
A.配位键B.离子键C.极性共价键D.金属键E.氢键F.非极性共价键
(3)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____。
晶胞中与Ca距离最近的Ca原子有___个。
(4)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①除去Al(OH)3中混有的少量Cu(OH)2,选用足量的溶液,后进行过滤、洗涤、干燥后得到Al(OH)3,则画出滤液中生成的阳离子的空间结构图为______
②若除去Cu(OH)2中混有的少量Al(OH)3,则可以选用稍足量的溶液,对应发生的离子方程式为。
(5)下图是铜的某种氧化物的晶胞结构示意图,该晶体的密度为ag/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为cm3
龙台中学2013年下期高2012级化学期中试题参考答案
一、选择题(2分/题共48分)
1-5:
BDCAB6-10:
BDDBC11-15:
BCBDD16-23:
BCDD
二、填空题(共52分)
24.【共7分⑸小题2分,其余每空1分】
25.(共10分)(09年山东理综·
32)(除注明外其余每空1分)
26.【共13分文字叙述3分⑸小题2分其余每空1分】
⑴:
NN:
(1分);
1:
2(1分);
四面体(1分);
NH3与水反应程度大,和水极性相同,并且可形成氢键;
Cl2.O2极性与水不同,Cl2可与水反应(3分)
⑵SiCrCl2O2N2(1分);
晶体类型和对应破坏的作用力大小等决定因素(1分)
⑶sp3(1分);
略⑷离子晶体(1分)⑸CD(2分)
27.【共9分⑶⑷小题每空2分,其余每空1分】
⑴<
<
(1分)
⑵B(1分)
⑶C、N、O(2分)
⑷①1s22s22p63s23p63d8(2分)
②
(2分)
28.【共13分⑵⑸小
题、方程式2分,其余每空1分】
⑴A(1分)
NH32+
↓
H3N→Cu←NH3
↑
NH3
⑵ABCE(2分)
⑶1:
5(2分);
6(1分)
⑷①NH3·
H2O氨水(1分);
(1分)
②NaOH(1分);
Al(OH)3+OH–=AlO2–+2H2O(2分)
⑸
(2分)
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 化学 四川省 德阳市 台中 学学 年高 上学 期中考试
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
