 高三化学复习单元集训检测卷18Word文档下载推荐.docx
高三化学复习单元集训检测卷18Word文档下载推荐.docx
- 文档编号:17710544
- 上传时间:2022-12-08
- 格式:DOCX
- 页数:9
- 大小:270.75KB
高三化学复习单元集训检测卷18Word文档下载推荐.docx
《高三化学复习单元集训检测卷18Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高三化学复习单元集训检测卷18Word文档下载推荐.docx(9页珍藏版)》请在冰豆网上搜索。
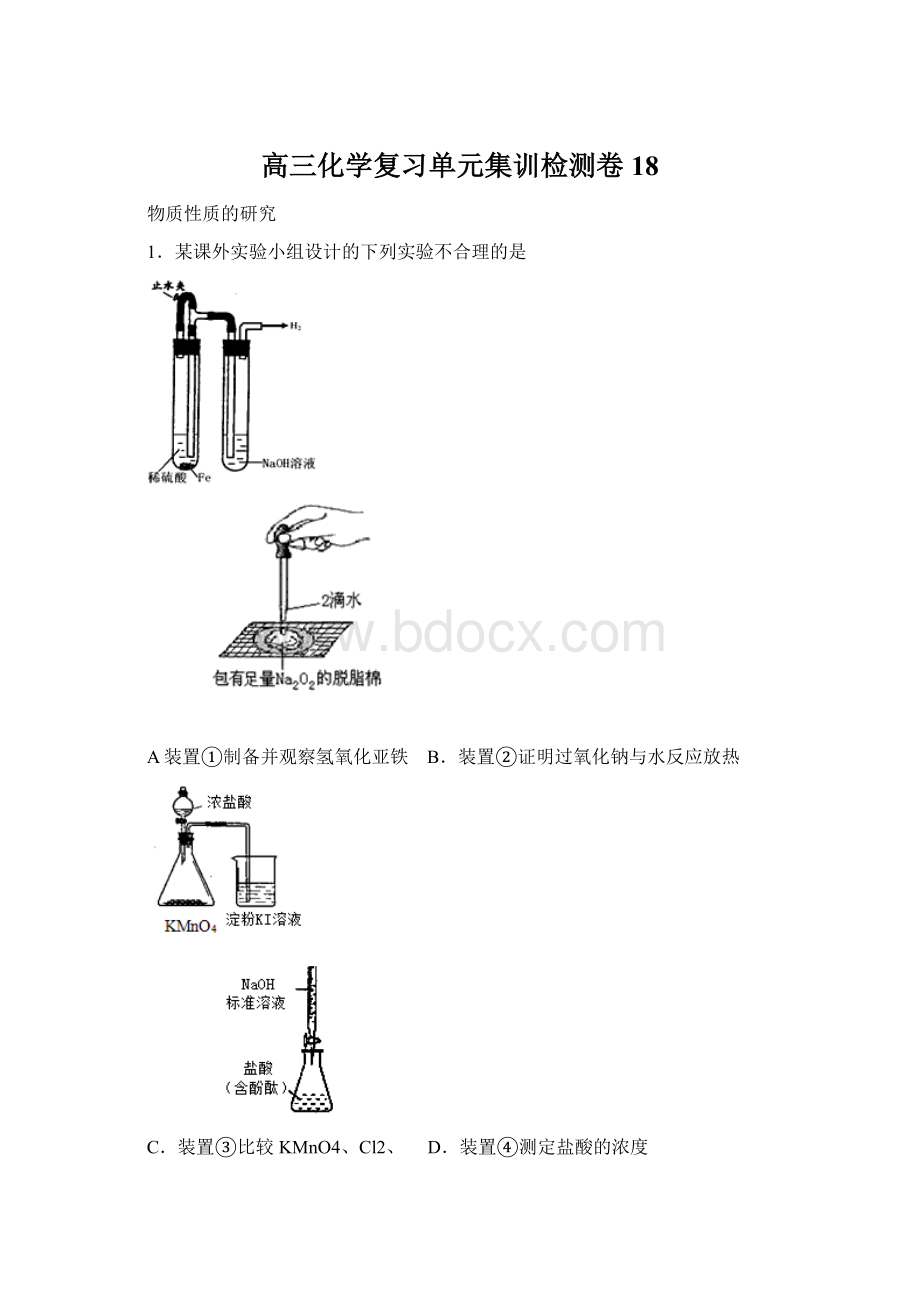
⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。
文中所述操作有错误的序号为()
A.④⑥⑦B.①⑤⑥⑦C.③⑤⑦D.①③⑤⑦
3.下列实验操作或装置(略去部分加持仪器)正确的是
【答案】C
4.下列关于实验操作的叙述正确的是
A.用四氯化碳萃取溴水中的溴时,将溴的四氣化碳溶液从分液漏斗下口放出
B.用氢氧化钠溶液滴定盐酸的实验中,可通过旋转玻璃活塞调节滴定速率
C.在配制一定物质的量浓度溶液的实验中,若定容时加水超过刻度线应立即用滴管吸出少量水
D.用玻璃棒蘸取溶液滴到放在洁净表面皿上用蒸锻水润湿的pH试纸上,测溶液的pH
【答案】A
5.下述实验能达到预期目的的是
编号
实验内容
实验目的
A
将含有HC1杂质的CO2通入饱和Na2CO3溶液中
除去CO2中的HC1
AB
将适量一定量的NaNO3和KC1的混合液加热并浓缩
至有晶体析出,趁热过滤
分离出NaCI晶体
C
在淀粉-KI溶液中滴加少量市售食盐配制的溶液
鉴别真假碘盐
D
将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸
化,再滴加KSCN溶液
检验Fe(NO3)2
试样是否变质
【答案】B
6.下列实验操作或装置可以达到实验目的或符合实际的是
7.下列装置或操作能达到实验目的的是
A.分离乙醇和水B.除去氯气中的氯化氢C.葡萄糖的银镜反应D.石油的蒸馏
8.下列实验设计能够成功的是
实验步骤及现象
检验亚硫酸钠试样是否变质
B
检验某盐是否为铵盐
证明酸性条件H2O2氧化性比I2强
除去氯化钠晶体中少量硝酸钾
9.化学是一门以实验为基础的自然科学,下列实验中所选用的仪器合理的是
①用50mL量筒取3.6mL稀盐酸;
②用分液漏斗分离苯和乙醇的混合物:
③用托盘天平称量11.7g氯化钠晶体;
④用瓷坩埚灼烧各种钠的化合物;
⑤用酸式滴定管取23.10mLNa2CO3溶液;
⑥用500mL容量瓶配制所需490mL0.1mol/L的NaC1溶液。
A.①②④B.②③④⑥C.③⑥D.③⑤⑥
10.某课外实验小组设计的下列实验合理的是
11.下列有关实验操作的叙述正确的是
A.用量筒取5.00mL1.00mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol/L盐酸
B.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
C.用10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15%
12.某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠②碳酸氢钠③碳酸氢铵④氯化铵⑤熟石灰⑥氢氧化钠
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:
铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是____(填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的(填下列各项序号)
A.Na2CO3B.AgNO3C.H2SO4D.FeSO4
(4)图E中持续通人氧气的作用为。
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:
。
【答案】
(1)③
(2)吸收二氧化碳和水蒸气并产生氧气
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2OBC
(4)使有害气体吸收更完全
(5)D装置的液体易倒流入玻璃管C中,使玻璃管破裂,在C装置与D装置之间连接一防倒吸装置。
13.(10分)
(1)玻璃棒是化学实验中常用的仪器。
下列实验过程中,一般不需要用玻璃棒的是(填写编号)
①粗盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·
8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)①读取滴定管中滴体体积时,仰视液面,读取的体积数实际体积数(填“>
”、“=”或“<
”)
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为g。
③实验需用480mL0.1mol·
L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是,所称取NaOH固体的质量为g。
(1)③⑤
(2)①>②9.6③500ml容量瓶2.0
14.(15分)为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计了如下实验。
查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·
2H2O)在100°
C时开始升华,157°
C时大量升华并开始分解;
草酸蒸气在低温下可冷凝为固体且草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I、乙二酸的不稳定性:
根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置,
请回答下列问题:
①装置的连接顺序为:
A→B→→→F→E→C→G。
②装置中冰水混合物的作用是。
③能证明产物中C0的实验现象是。
④整套装置存在不合理之处为。
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol·
L-1的草酸溶液480ml。
(2)配置该溶液需要草酸晶体g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1molL-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1molL-1草酸溶液和0.1molL-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为。
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。
该反应的离子方程式为_。
(1)①D、G
②除去草酸蒸气,防止干扰实验
③黑色固体变成红色,且澄清石灰水变浑浊
④没有CO尾气处理装置
(2)6.3(3)B、D(4)c(Na+)>
c(HC2O4-)>
c(H+)>
c(C2O42-)>
c(OH-)
(5)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
15.碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl−)制备碱式碳酸铜,其制备过程如下:
已知:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
Cu(OH)2
Fe(OH)2
Fe(OH)3
开始沉淀pH
4.2
5.8
1.2
完全沉淀pH
6.7
8.3
3.2
①氯酸钠的作用是
;
②反应A后调节溶液的pH范围应为
③第一次过滤得到的产品洗涤时,如何判断已经洗净?
④造成蓝绿色产品中混有CuO杂质的原因是
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因
。
此时B装置中发生反应的离子方程式是
③写出A溶液中具有强氧化性微粒的化学式
若向A溶液中加入NaHCO3粉末,会观察到的现象是
(1)①将Fe2+氧化成Fe3+并最终除去。
②3.2-4.2。
③取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净。
④反应B的温度过高。
(2)①分液漏斗
②不能证明,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白。
2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
③Cl2
HClO
ClO-
有无色气体产生
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 化学 复习 单元 集训 检测 18
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
广东省普通高中学业水平考试数学科考试大纲Word文档下载推荐.docx
