 江苏省如东县学年高一上学期期中四校联考化学试题Word版含答案Word文档下载推荐.docx
江苏省如东县学年高一上学期期中四校联考化学试题Word版含答案Word文档下载推荐.docx
- 文档编号:16964487
- 上传时间:2022-11-27
- 格式:DOCX
- 页数:11
- 大小:69.09KB
江苏省如东县学年高一上学期期中四校联考化学试题Word版含答案Word文档下载推荐.docx
《江苏省如东县学年高一上学期期中四校联考化学试题Word版含答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《江苏省如东县学年高一上学期期中四校联考化学试题Word版含答案Word文档下载推荐.docx(11页珍藏版)》请在冰豆网上搜索。
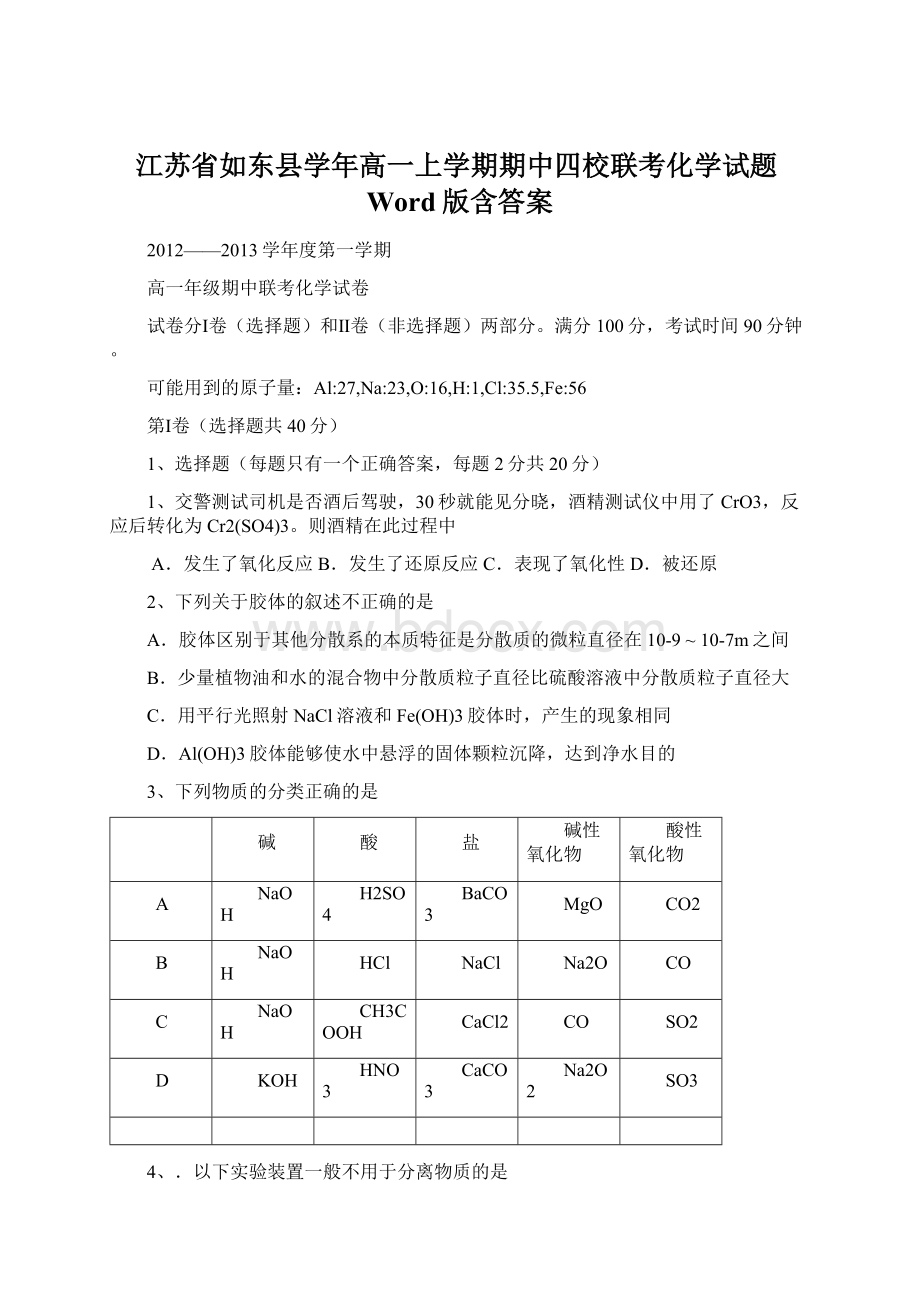
A
NaOH
H2SO4
BaCO3
MgO
CO2
B
HCl
NaCl
Na2O
CO
C
CH3COOH
CaCl2
SO2
D
KOH
HNO3
CaCO3
Na2O2
SO3
4、.以下实验装置一般不用于分离物质的是
ABCD
5、下列说法正确的是
A.锌、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质
D.蔗糖、酒精在水溶液和熔融状态下均不能导电,所以它们均是非电解质
6、氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是
A.2H2+O2点燃2H2O
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.CuO+CO
Cu+CO2
D.Zn+H2SO4=ZnSO4+H2↑
7、为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法正确的是
物质
除杂试剂
分离方法
硝酸铜溶液(硝酸银)
铜粉
结晶
NaCl溶液(CuCl2)
NaOH溶液
萃取
乙醇(水)
——
分液
铜粉(铁粉)
稀盐酸
过滤
8、下列叙述正确的是
A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32—
B.用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是排除SO42-以外的其它阴离子及Ag+的干扰。
C.做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净后,在酒精灯外焰上灼烧至没有颜色时,再蘸取待测溶液进行实验
D.在某待测液中先滴加盐酸再加入硝酸银溶液有白色沉淀产生,说明待测液中必有Cl-。
9、常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:
Fe2+、NO
、SO
、Na+
B.c(Fe3+)=0.1mol·
L-1的溶液中:
K+、SO
、SCN-
C.加入Al能放出H2的溶液中:
Mg2+、Cl-、K+
D.酸性溶液中:
Al3+、Mg2+、Cl-、SO42-
10、R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;
X2++Z=X+Z2+;
Y+Z2+=Y2++Z。
这四种离子的氧化性大小顺序正确的是
A.R2+>
X2+>
Z2+>
Y2+B.X2+>
R2+>
Y2+>
Z2+
C.Y2+>
X2+D.Z2+>
Y2+
二、选择题(每题有1~2个正确答案,每题4分,漏选给2分,错选、多选不得分,共20分)
11、FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含铜
12、设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1molNa在空气中燃烧,转移的电子数为2nA
B.常温下,2.7g铝与足量氢氧化钠溶液反应,失去的电子数为0.3nA
C.0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10nA
D.11.2LCl2含有的原子数为NA
13、下列反应的离子方程式书写正确的是
A.用小苏打治疗胃酸过多:
HCO3-+H+=CO2↑+H2O
B.过氧化钠加到冷水中:
Na2O2+H2O=2Na++2OH-+O2↑
C.过量氢氧化钠溶液与氯化铝溶液反应:
Al3++3OH-=Al(OH)3↓
D.用氢氧化钠溶液除去铝表面的氧化膜:
Al2O3+2OH-===2AlO
+H2O
14、在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1molCr3+反应所需PbO2的物质的量是
A.3.0molB.1.5molC.1.0molD.0.75mol
15、将agNa,Na2O,Na2O2的混合物,与足量水完全反应,得到常温常压下的气体bmL;
该气体用电火花引燃恰好反应完全,原混合物中Na,Na2O,Na2O2的物质的量比可能是
A.2∶1∶1B.0.5a∶b∶1C.4∶3∶2D.数据不足无法计算
第Ⅱ卷(非选择题共60分)
16、(14分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:
相对分子质量:
36.5
密度:
1.19g·
cm-3HCl的质量分数:
36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________mol·
L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol·
L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面。
( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。
(4)①假设该同学成功配制了0.400mol·
L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
17、(12分)已知反应:
3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为。
(2)氧化剂与还原剂的质量比为,氧化产物与还原产物的物质的量之比为。
(3)在标准状况下,3.36LNO2与H2O完全反应转移的电子数目为。
(4)用线桥标出该反应中电子转移的方向和数目。
(5)写出HNO3与石灰水反应的离子方程式。
18、(10分)如下图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。
它们的焰色反应均为黄色。
请填写下列空白:
(1)写出反应
的实验现象。
(2)以上反应中属于氧化还原反应的有
。
(填写编号)
(3)反应
的离子反应方程式
;
反应
的化学方程式
。
向D中滴入少量盐酸的化学方程式
19、(14分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)________________________________________________________________________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式为:
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为__________,请设计实验检验所得溶液中溶质的阴离子______________________________
________________________________________________________________________。
20、(10分)把铝、铁混合物1.1g溶于200mL5mol·
L—1盐酸中,反应后盐酸的浓度变为4.6mol·
L—1(溶液体积变化忽略不计)。
求:
(1)反应中消耗HCl的物质的量。
(2)该混合物中铝、铁的物质的量。
高一年级期中联考化学试卷答卷
16、(14分)
(1)、___________________mol·
L-1;
(2)________________________
3、①_______________mL;
②a.______________________b._________________________;
4、①_______________mL;
②___________________________________;
17、(12分)
(1)________________________________________________________________;
(2)_____________________________;
_____________________________;
(3)_________________________________;
(4)_________________________________________________________________;
(5)_________________________________________________________________;
18、(10分)
(1)_____________________________________________________________;
(2)______________________________________________________________________;
(3)_____________________________________________________________________;
_____________________________________________________________________;
19、(14分)
(1)_______________________________________;
_______________________________________________________________;
____________
B.______________________________________________________________________;
C.①_____________________________________________________________________;
②_______________________;
___________________________________________________
______________________________________________________________________;
20.(10分)
(1)
(2)
高一年级期中联考化学试卷参考答案
5、选择题(每题2分共20分)
1A
2C
3A
4C
5D
6C
7D
8B
9D
10A
6、选择题(每题4分,漏选给2分,错选、多选不给分)
11C
12B
13AD
14B
15AC
1、(本题14分,每空2分)
(1)11.9
(2)BD(漏选给1分,错选、多选不给分) (3)①16.8 ②B B (4)①25②C
17、(12分,每空2分)
(1)3NO2+H2O==2H++2NO3-+NO(2分)
(2)1:
22:
1(4分)(3)0.1mol(2分)(4)略(2分)(5)H++OH-=H2O(2分)
18.(本题10分每空2分)
(1)浮、熔、游、响(写出2个或3个现象给1分,写全给2分)
(2)①②③④(写出2个或3个给1分,写全给2分,错写、多写不给分)
(3)2Na+2H2O
2Na++2OH-+H2↑
2NaHCO3
Na2CO3+CO2↑+H2O
Na2CO3+HCl
NaHCO3+NaCl
19、(本题14分,除第一问、第二问中的最后一问为1分,其余每空2分)
(1)Ⅱ
(2)2NaHCO3
Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O D(3)NaHCO3 (4)①Ca2++OH-+HCO
===CaCO3↓+H2O
②Na2CO3 取少量上层清液(或过滤后的滤液或所得溶液)于洁净(若无“洁净”也可)的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO
20.(本题10分)
(1)(4分)消耗HCl的物质的量:
0.2L×
5mol·
L—1-0.2L×
4.6mol·
L—1=0.08mol
(2)(6分)设Al、Fe的物质的量分别为x、y
Al~3HClFe~2HCl
x3xy2y
27x+56y=1.1
3x+2y=0.08(4分)
得x=0.02moly=0.01mol(各1分)
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 江苏省 如东县 学年 高一上 学期 期中 联考 化学试题 Word 答案
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 如何打造酒店企业文化2刘田江doc.docx
如何打造酒店企业文化2刘田江doc.docx
