 普通高等学校全国统一考试信息卷三化学试题 及答案Word文档格式.docx
普通高等学校全国统一考试信息卷三化学试题 及答案Word文档格式.docx
- 文档编号:16794628
- 上传时间:2022-11-26
- 格式:DOCX
- 页数:11
- 大小:157.10KB
普通高等学校全国统一考试信息卷三化学试题 及答案Word文档格式.docx
《普通高等学校全国统一考试信息卷三化学试题 及答案Word文档格式.docx》由会员分享,可在线阅读,更多相关《普通高等学校全国统一考试信息卷三化学试题 及答案Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
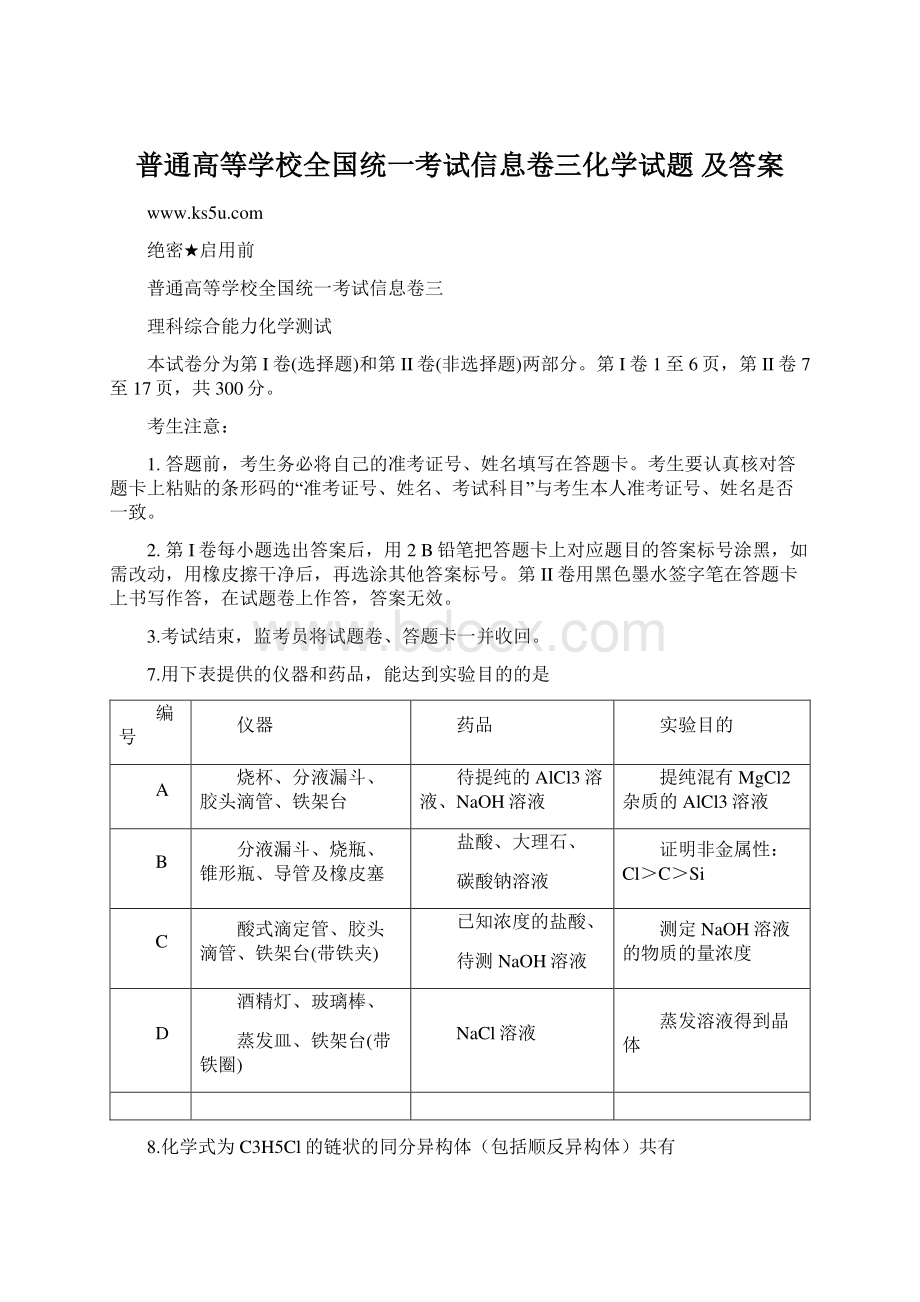
ClCSiC酸式滴定管、胶头滴管、铁架台(带铁夹)已知浓度的盐酸、待测NaOH溶液测定NaOH溶液的物质的量浓度D酒精灯、玻璃棒、蒸发皿、铁架台(带铁圈)NaCl溶液蒸发溶液得到晶体8.化学式为C3H5Cl的链状的同分异构体(包括顺反异构体)共有A3种B4种C5种D6种9.对下列图像的描述正确的是A.根据图可判断反应的Hr(X)D.Y、W的最高价氧化物的水化物均能溶解金属Z12.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。
其转化过程如下:
下列说法错误的是A.酪氨酸既能与盐酸反应,又能与氢氧化钠反应B.1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个D.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3131966年美国福特汽车公司首次发表了Na-S电池的有关报导。
其结构如图所示,电池反应为2NaS8Na2Sn。
下列说法不正确的是A.熔钠电极作电池的正极B.放电时Na向正极移动C.充电时熔钠电极与电源的负极相连D.充电时阳极反应式为8S16e=nS826.(15分)全国各地都遭遇“十面霾伏”。
其中,机动车尾气和燃煤产生的烟气对空气质量恶化影响较大。
汽车尾气净化的主要原理为:
2NO(g)+2CO(g)2CO2(g)+N2(g)H0。
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
(下图中正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:
CH4(g)+2NO2(g)N2(g)CO2(g)+2H2O(g)H867kJ/mol2NO2(g)N2O4(g)H56.9kJ/molH2O(g)H2O(l)H44.0kJmol写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
。
(3)用NH3催化还原NOx也可以消除氮氧化物的污染。
右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:
脱氮率即氮氧化物转化率),反应原理为:
NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g)。
该反应的S0,H0(填“”、“”或“”)。
对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP。
以下说法正确的是。
A.第种催化剂比第种催化剂脱氮率高B.相同条件下,改变压强对脱氮率没有影响C.催化剂、分别适合于250和450左右脱氮(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见右图。
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为。
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素CO(NH2)2溶液除去。
反应生成对大气无污染的气体。
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:
1)的质量为_g。
27.(14分)以明矾石主要成分为K2SO4Al2(SO4)32A12O36H2O为原料生产硫酸铝晶体Al2(SO4)318H2O和明矾KAl(SO4)212H2O的实验流程如下:
两种不同形态的氧化铝的部分性质如下表:
物质Al2O3A12O3性质不溶于水和酸不溶于水,溶于强酸或强碱,加热至1200可转化为-Al2O3Al2(SO4)3、明矾在不同温度下的溶解度如下表:
温度/溶解度/g020406080100Al2(SO4)331.236.446.159.273.089.0明矾3.05.911.72571154
(1)“焙烧”温度过高,会导致硫酸铝晶体产量降低,其原因是。
(2)从“母液”制备硫酸铝晶体的实验步骤为:
;
过滤、洗涤、干燥。
(3)测定硫酸铝晶体样品中Al2(SO4)318H2O质量分数的实验步骤为(EDTA分别能与Al3或Pb2以物质的量之比1:
1进行反应):
步骤1:
准确称取硫酸铝晶体样品mg,溶于25mL水中。
步骤2:
加入c1mo1L1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100mL。
步骤3:
取25.00mL上述稀释液,滴加指示剂,用c2molL1Pb(NO3)2标准溶液滴定过量的EDTA溶液,达到终点时消耗V2mLPb(NO3)2标准溶液。
步骤2中“稀释至100mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、。
根据上述数据计算,该样品中Al2(SO4)318H2O的质量分数为(用含字母的代数式表示)。
(4)铝的阳极氧化法是把铝作为阳极,置于硫酸等电解液中,施加阳极电压进行电解,在铝的表面形成一层致密的氧化膜。
电解过程中阳极的电极反应为。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是。
(用离子方程式表示)28.(14分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略)。
(1)制备氯气选用的药品为:
漂粉精固体主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为:
(2)装置B中饱和食盐水的作用是;
同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入。
abcdI干燥的有色布条干燥的有色布条湿润的有色布条湿润的有色布条II碱石灰硅胶浓硫酸无水氯化钙III湿润的有色布条湿润的有色布条干燥的有色布条干燥的有色布条(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。
当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。
打开活塞,将装置D中少量溶液加入装置E中,振荡。
观察到的现象是。
该现象(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
36化学选修2:
化学与技术(15分)工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为_。
通过冷却结晶析出大量K2Cr2O7的原因是。
(2)向Na2Cr2O7母液中加碱液调pH的目的是_。
(3)固体A主要为_(填化学式)。
固体B主要为_(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液_(填“”“”或“”)中,既能提高产率又可使能耗最低。
37化学选修3:
物质结构与性质(15分)含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为_。
(2)与OH-互为等电子体的一种分子为_(填化学式)。
(3)醛基中碳原子的轨道杂化类型是_;
1mol乙醛分子中含有的键的数目为_。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为_。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。
铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为_。
38化学选修5:
有机化学基础(15分)281.(2017江苏单科,17,15分)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
请回答下列问题:
(1)非诺洛芬中的含氧官能团为_和_(填名称)。
(2)反应中加入的试剂X的分子式为C8H8O2,X的结构简式为_。
(3)在上述五步反应中,属于取代反应的是_(填序号)。
(4)B的一种同分异构体满足下列条件:
.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:
_。
(5)根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
CH3CH2BrCH3CH2OHCH3COOCH2CH3答案78910111213CADBCDD26.(14分)
(1)C(s,石墨)+O2(g)=CO(g)H2=(20xy)kJmol-1(2分)
(2)2MgSO4+CO2MgO+SO2+CO2+SO3(3分)Mg+ClO-+H2O=Cl-+Mg(OH)2(2分)(3)(3分)(1分)(1分)0.4c1(2分)27.(15分)1、4FeSO4+2H2SO4+O2=2Fe2(SO4)3+2H2O(3分)
(2)(每格1分,8分)实验步骤实验操作实验操作的目的步骤1加入H2O2把二价铁氧化成三价步骤2加入适量氧化铜,调节pH到3.7保证三价铁完全沉淀步骤3过滤滤出氢氧化铁步骤4除去杂质步骤5向沉淀中加入适量稀硫酸和适量铁粉(3)不正确(1分),因为该计算没有考虑Cu与Fe3+的反应(3分)28.(14分)
(1)Cu2H2SO4(浓)CuSO4SO2+2H2O(2分)品红溶液褪色(2分)SO2+2OH-=SO32-+H2O(2分)
(2)d(1分)试剂瓶中液面下降,长颈漏斗中液面上升(2分)(3)随反应进行,浓硫酸变为稀硫酸后不能和铜反应(2分)B(1分)2Cu2H2SO4+O22CuSO42H2O(2分)36.(15分)
(1)(各1分,共3分)
(2)(2分)(3)Ca2+SCaSO4Mg(OH)269.6(每空2分,共6分)(4)MgCl2Mg+Cl2(2分)Mg+2H2OMg(OH)2+H2(2分)37.(15分)
(1)1s22s22p4(3分)Cl(2分)
(2)V形(2分)O(2分)(3)21(3分)(4)2Cu+8NH3H2O+O22Cu(NH3)42+4OH-+6H2O(3分)38.(15分)
(1)羧基(2分)
(2)a、c(2分,缺一不得分)(3)(3分)(4)取代反应(2分)保护氨基(2分)+H2O+CH3COOH(4分)
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 普通高等学校全国统一考试信息卷三化学试题 及答案 普通高等学校 全国 统一 考试 信息 化学试题 答案
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 转基因粮食的危害资料摘编Word下载.docx
转基因粮食的危害资料摘编Word下载.docx
