 学年人教版必修二 第1章 第二节 元素周期律第1课时 学案Word文件下载.docx
学年人教版必修二 第1章 第二节 元素周期律第1课时 学案Word文件下载.docx
- 文档编号:15748711
- 上传时间:2022-11-15
- 格式:DOCX
- 页数:19
- 大小:162.41KB
学年人教版必修二 第1章 第二节 元素周期律第1课时 学案Word文件下载.docx
《学年人教版必修二 第1章 第二节 元素周期律第1课时 学案Word文件下载.docx》由会员分享,可在线阅读,更多相关《学年人教版必修二 第1章 第二节 元素周期律第1课时 学案Word文件下载.docx(19页珍藏版)》请在冰豆网上搜索。
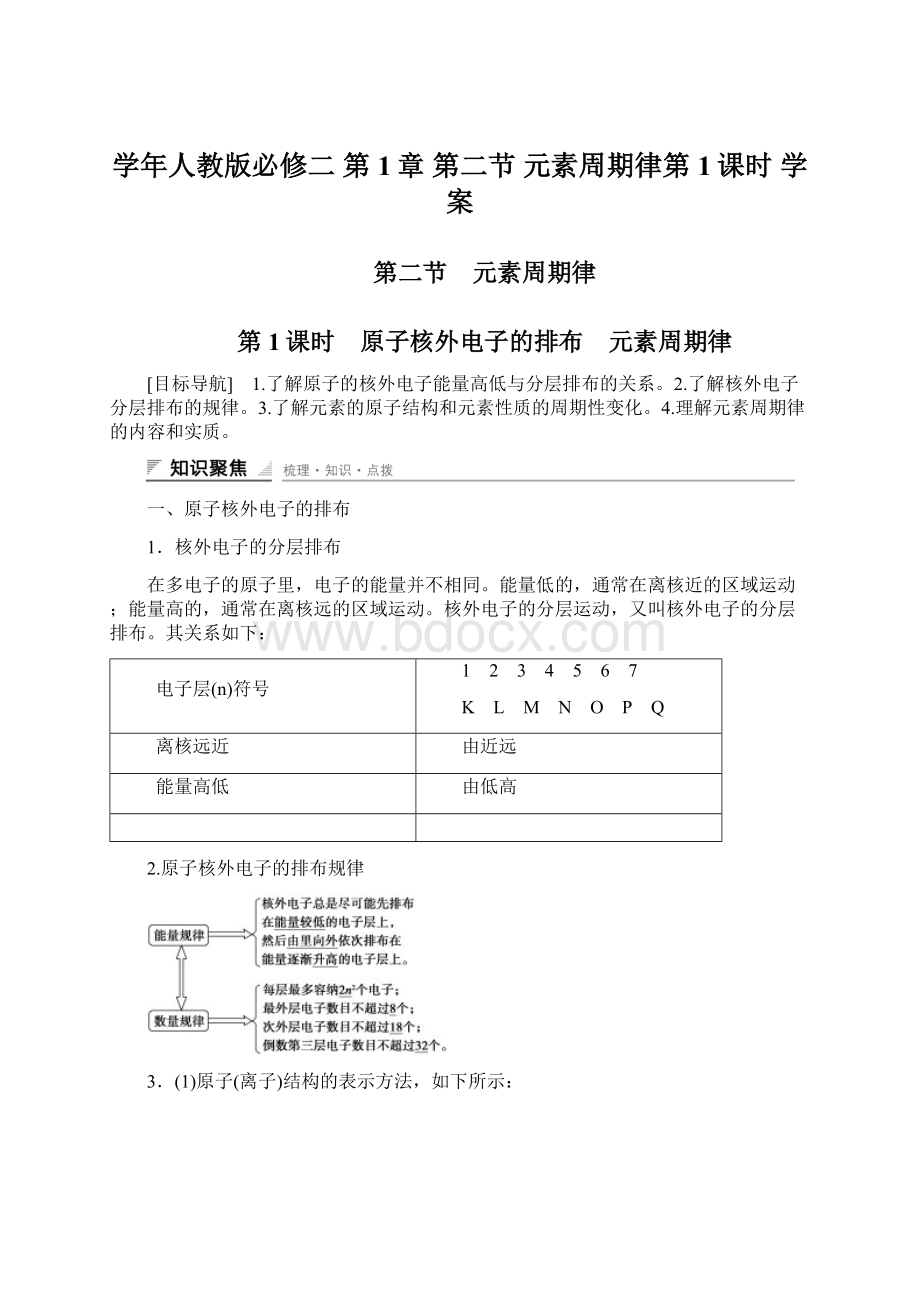
阳离子:
核外电子数小于核电荷数。
阴离子:
核外电子数大于核电荷数。
点拨 ①电子层实质上是一个“区域”,或者说是一个“空间范围”,它与宏观上层的含义完全不同。
②核外电子排布的规律是互相联系的,不能孤立地理解。
如钙原子由于受最外层电子数不超过8个的限制。
其原子结构示意图为
而不应该是
。
【议一议】
1.判断正误
(1)锂的原子结构示意图是
( )
(2)某原子M层电子数为L层电子数的4倍。
(3)某离子M层和L层电子数均为K层的4倍。
(4)离子的核电荷数一定等于其核外电子数。
答案
(1)×
(2)×
(3)√ (4)×
二、元素周期律
1.原子结构的周期性变化
(1)元素原子核外电子排布的周期性变化。
规律:
随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
(2)元素原子半径的周期性变化。
随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
2.元素性质的周期性变化
(1)元素主要化合价的周期性变化
随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
点拨 元素化合价的“三个二”
①二“特殊”。
F无正价,O无最高正价;
②二“只有”。
金属只有正价,只有非金属才有负价;
③二“等式”(主族元素)。
最高正价=最外层电子数,
|最低负价数值|+|最高正价数值|=8。
(2)元素金属性、非金属性的周期性变化
①Na、Mg、Al与水(或酸)反应的比较
Na
Mg
Al
规律(同周期从左到右)
单质与水(或酸)反应
与冷水剧烈反应,产生氢气
与冷水几乎不反应,与沸水反应缓慢,放出氢气;
与酸反应剧烈,放出氢气
与酸反应较快,放出氢气
从水或酸中置换H2能力逐渐减弱
最高价氧化物对应的水化物碱性强弱
NaOH 强碱
Mg(OH)2 中强碱
Al(OH)3两性氢氧化物
最高价氧化物对应的水化物碱性逐渐减弱
②Si、P、S、Cl四种元素性质的比较
Si
P
S
Cl
单质与氢气反应的条件
高温
磷蒸气与氢气能反应
加热
光照或点燃时发生爆炸而化合
与H2化合能力逐渐增强
形成的气态氢化物的热稳定性
SiH4很不稳定
PH3不稳定
H2S受热分解
HCl稳定
氢化物稳定性逐渐增强
最高价氧化物对应的水化物(含氧酸)酸性强弱
H2SiO3弱酸
H3PO4中强酸
H2SO4强酸
HClO4强酸(比H2SO4酸性强)
最高价氧化物对应的水化物酸性逐渐增强
结论:
随着原子序数的递增,元素的金属性、非金属性呈现周期性的变化。
3.元素周期律
内容:
元素的性质随着原子序数的递增而呈现周期性变化的规律。
实质:
元素周期律是核外电子排布发生周期性变化的必然结果。
点拨 ①元素的性质包括:
原子半径、元素的主要化合价、金属性、非金属性等。
②物质的性质:
物理性质:
颜色、状态、气味、挥发性、溶解性、密度、硬度、熔沸点、导电性、延展性等。
化学性质:
氧化性、还原性、稳定性、酸性、碱性等。
2.在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号);
(2)金属性最强的元素是________(填元素符号);
(3)最高价氧化物对应水化物酸性最强的是________(用化学式回答,下同);
(4)最不稳定的气态氢化物是________;
(5)最高价氧化物对应水化物碱性最强的是________;
(6)氧化物中具有两性的是________。
答案
(1)Cl
(2)Na (3)HClO4 (4)SiH4 (5)NaOH
(6)Al2O3
解析
(1)第三周期元素从左到右原子半径逐渐减小,原子半径最小的是Cl。
(2)金属性最强的元素在最左边,应为Na。
(3)非金属性最强的元素,其最高价氧化物对应水化物的酸性最强,氯的非金属性最强,其对应的酸是HClO4。
(4)非金属性最弱的元素Si的气态氢化物最不稳定。
(5)金属性最强的Na对应的NaOH的碱性最强。
(6)铝的氧化物Al2O3具有两性。
一、原子核外电子排布规律的应用
【例1】 核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
A.1种B.2种C.3种D.4种
答案 B
解析 在1号~18号元素中,符合题给要求的元素原子的电子排布依次为2、1和2、8、5。
知识归纳
1.确定元素的种类
根据原子核外电子排布的某些特点可以确定元素的种类,注意1~20号元素原子结构的特殊关系。
特殊关系
元素
最外层电子数等于次外层电子数的一半
Li、Si
最外层电子数等于次外层电子数
Be、Ar
最外层电子数等于次外层电子数的2倍
C
最外层电子数等于次外层电子数的3倍
O
最外层电子数等于次外层电子数的4倍
Ne
最外层电子数等于电子层数
H、Be、Al
最外层有1个电子
H、Li、Na、K
最外层有2个电子
He、Be、Mg、Ca
内层电子数之和是最外层电子数2倍的元素
Li、P
电子总数为最外层电子数2倍的元素
Be
2.推断元素的性质
最外层电子数
得失电子能力
化学性质
主要化合价
稀有气体元素
8(He为2)
一般不易得失电子
较稳定,一般不参与化学反应
金属元素
<4
易失电子
金属性
只有正价,一般是+1→+3
非金属元素
≥4
易得电子
非金属性
既有正价又有负价
特别提醒
(1)通常把最外层有8个电子(K层为最外层时电子数是2个)的结构,称为相对稳定结构。
稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。
当元素的原子最外层电子数小于8(K层小于2)时是不稳定结构。
在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子等)趋向达到相对稳定结构。
(2)过渡元素原子最外层电子数不超过2个,若原子最外层有n个电子:
①n=1,位于第ⅠA族或过渡元素区。
②n=2,位于第ⅡA族、0族或过渡元素区。
③n≥3时,则一定位于第n主族(n=8时,位于0族)。
变式训练1 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;
B元素原子最外层电子数是其内层电子总数的3倍;
C元素原子M层电子数等于其L层电子数的一半;
D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>AB.D>B>A>C
C.A>D>C>BD.B>A>C>D
答案 A
解析 A元素原子的次外层电子数只能是2,最外层电子数是4。
A的原子序数为6;
B元素的内层电子总数只能是2,最外层电子数为6,B的原子序数为8;
C元素原子有3个电子层,L层必有8个电子,M层有4个电子,C的原子序数为14;
D的阳离子与B的阴离子(即O2-)电子层结构相同,D为Na,原子序数为11;
故原子序数:
C>D>B>A。
【例2】 已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A.气态氢化物的稳定性:
HX>H2Y>ZH3
B.非金属活泼性:
Y<X<Z
C.原子半径:
X>Y>Z
D.原子最外层电子数:
答案 AD
解析 本题的关键是“最高价氧化物对应水化物的酸性相对强弱”这一信息,由此可推知X、Y、Z为非金属元素,原子序数相连意味着它们属同周期元素,故活泼性:
X>Y>Z,原子半径:
X<Y<Z,气态氢化物的稳定性顺序为:
HX>H2Y>ZH3。
1.元素周期表中元素及其单质和化合物性质的变化规律
项目
同周期(左→右)
同主族(上→下)
原
核电荷数
逐渐增大
子
电子层数
相同
增多
结
构
原子半径
逐渐减小
元素的化合价
最高正价:
+1→+7
负价数=族序数-8
最高正价(O、F除外)、负价数相同,最高正价=族序数
减弱
增强
2.元素的金属性、非金属性强弱判断规律
(1)金属性强弱的判断依据
①元素的单质与水或酸置换出氢气的反应越容易进行,则其金属性越强。
②元素的最高价氧化物的水化物的碱性越强,则其金属性越强。
③金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,则A的金属性强于B。
④在金属活动性顺序表中,前面的金属性强于后面的。
⑤金属阳离子的氧化性越强,则其单质的还原性越弱,元素的金属性越弱(注:
Fe的阳离子仅指Fe2+)。
(2)非金属性强弱的判断依据
①非金属元素的单质与氢气化合生成气态氢化物的反应越容易进行,则其非金属性越强。
②非金属元素气态氢化物的稳定性越强,则元素的非金属性越强。
③元素的最高价氧化物的水化物的酸性越强,则其非金属性越强。
④非金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,并且A体现出氧化性,则A的非金属性强于B。
⑤非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。
变式训练2 X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
答案 C
解析 X原子半径比Y的大,说明X在Y的左边,原子序数X比Y小,X的非金属性比Y的弱,因此最高价氧化物对应水化物的酸性X比Y的弱,X的阴离子比Y的阴离子还原性强,X的气态氢化物不如Y的稳定。
三、微粒半径大小的比较——“四同”规律
【例3】 下列微粒半径大小的比较中,正确的是( )
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Cs<Rb<K<Na
解析 四种离子核外电子数相同,随着核电荷数的增多,离子半径依次减小,即微粒半径:
Al3+<Mg2+<Na+<O2-,A项错;
因S2-、Cl-比Na+、Al3+多一个电子层,则S2-、Cl-半径比Na+、Al3+大,再根据“序小径大”的规则,则微粒半径:
S2->Cl->Na+>Al3+,B项正确;
Na、Mg、Al、S的原子半径依次减小,C项错;
Na、K、Rb、Cs最外层电子数相
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 学年人教版必修二 第1章 第二节 元素周期律第1课时 学案 学年 人教版 必修 第二 元素周期律 课时
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 铝散热器项目年度预算报告.docx
铝散热器项目年度预算报告.docx
