 完整版初中化学方程式汇总打印版doc.docx
完整版初中化学方程式汇总打印版doc.docx
- 文档编号:1564453
- 上传时间:2022-10-23
- 格式:DOCX
- 页数:19
- 大小:23.21KB
完整版初中化学方程式汇总打印版doc.docx
《完整版初中化学方程式汇总打印版doc.docx》由会员分享,可在线阅读,更多相关《完整版初中化学方程式汇总打印版doc.docx(19页珍藏版)》请在冰豆网上搜索。
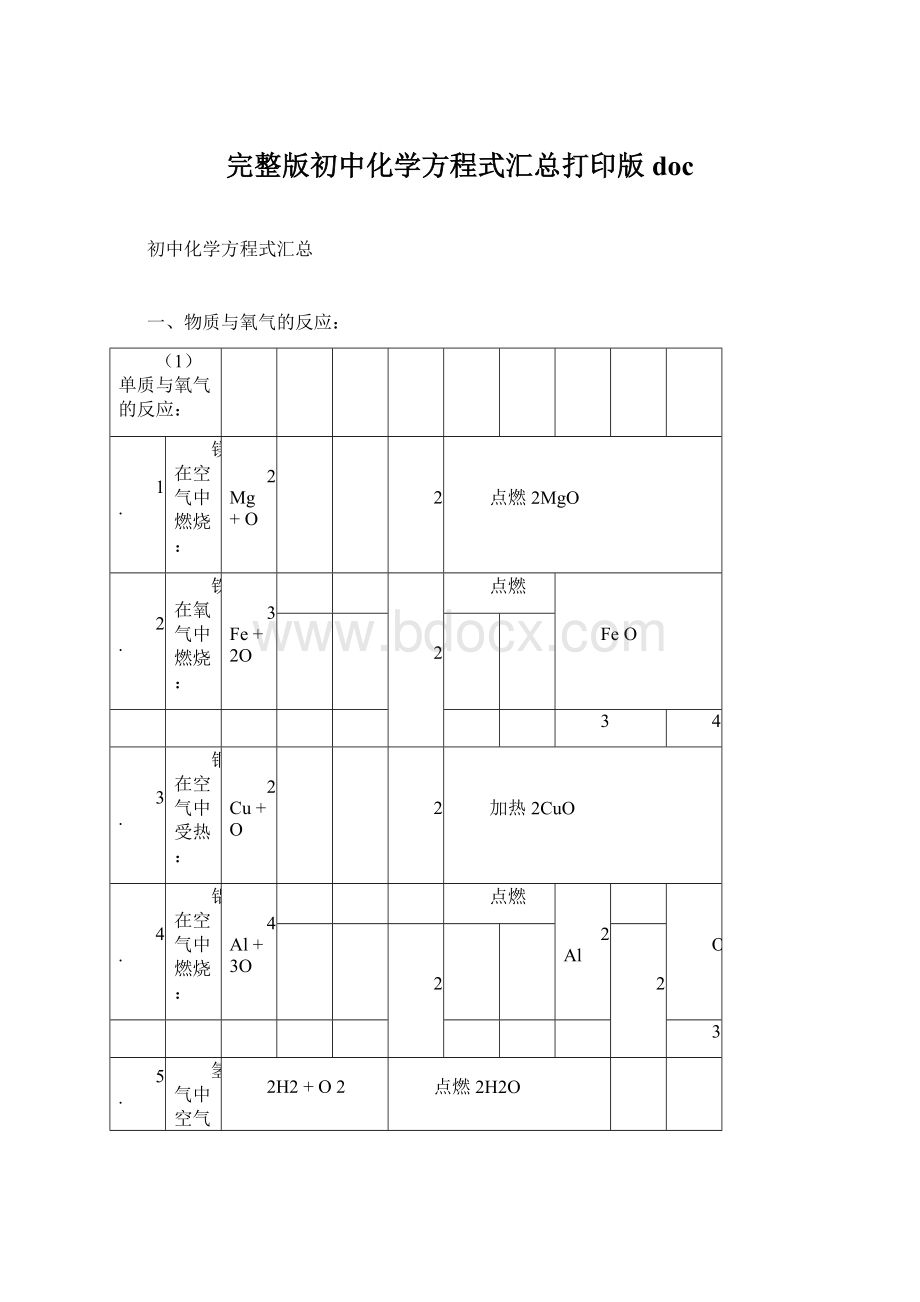
完整版初中化学方程式汇总打印版doc
初中化学方程式汇总
一、物质与氧气的反应:
(1)单质与氧气的反应:
1.
镁在空气中燃烧:
2Mg+O
2
点燃2MgO
2.
铁在氧气中燃烧:
3Fe+2O
2
点燃
FeO
3
4
3.
铜在空气中受热:
2Cu+O
2
加热2CuO
4.
铝在空气中燃烧:
4Al+3O
点燃
2Al
O
2
2
3
5.
氢气中空气中燃烧:
2H2+O2
点燃2H2O
6.
红磷在空气中燃烧:
4P+5O
2
点燃
2PO
2
5
7.
硫粉在空气中燃烧:
S+O
2
点燃SO2
8.
碳在氧气中充分燃烧:
C+O
2
点燃CO2
9.
碳在氧气中不充分燃烧:
2C+O
2
点燃2CO
1
(2)化合物与氧气的反应:
10.
一氧化碳在氧气中燃烧:
2CO+O2
点燃2CO
11.
甲烷在空气中燃烧:
CH
4+2O2
点燃CO2+2H2O
12.
酒精在空气中燃烧:
CHOH+3O
点燃
2CO+3H
2
O
2
5
2
2
二、几个分解反应:
13.水在直流电的作用下分解:
2H
2
O
通电
2H
↑+O
↑
2
2
14.加热碱式碳酸铜:
Cu2(OH)2CO3加热2CuO+H2O+CO2↑
15.
加热氯酸钾(有少量的二氧化锰):
2KClO3
MnO22KCl+3O2↑
16.
加热高锰酸钾:
2KMnO
加热
KMnO+MnO+O
4
2
2
4
2
↑
17.
碳酸不稳定而分解:
H
2CO3===H2O+CO2↑
18.
高温煅烧石灰石:
CaCO
3
高温CaO+CO2↑
18-1.
双氧水(过氧化氢)催化分解:
Mn
2HOO2HO+O↑
2
2
2
2
三、几个氧化还原反应:
19.
氢气还原氧化铜:
H
2+CuO加热Cu+H2O
20.
木炭还原氧化铜:
C+2CuO
高温2Cu+CO2↑
21.
焦炭还原氧化铁:
3C+2Fe
2O3
高温4Fe+3CO2↑
22.
焦炭还原四氧化三铁:
2C+Fe
3O4
高温3Fe+2CO2↑
23.
一氧化碳还原氧化铜:
CO+CuO
加热Cu+CO2
24.
一氧化碳还原氧化铁:
3CO+Fe
2O3
高温2Fe+3CO2
25.
一氧化碳还原四氧化三铁:
4CO+Fe
3
O
高温
3Fe+4CO
4
2
四、单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+
酸┈┈┈┈
盐+
氢气
(置换反应)
26.
锌和稀硫酸
Zn+H
2SO4
===ZnSO4+H2↑
27.
铁和稀硫酸
Fe+H
2SO4
===FeSO4
+H2↑
28.
镁和稀硫酸
Mg+H
2SO4
===MgSO4+H2↑
29.
铝和稀硫酸
2Al+3H
2
SO
===Al(SO)
3
+3H↑
4
2
4
2
30.
锌和稀盐酸
Zn+2HCl
===ZnCl2
+H2↑
2
31.
铁和稀盐酸
Fe+2HCl
===FeCl2
+H2
↑
32.
镁和稀盐酸
Mg+2HCl
===MgCl
+H
↑
2
2
33.
铝和稀盐酸
2Al+6HCl
===2AlCl3+3H2↑
(2)金属单质+盐(溶液)
┈┈┈┈另一种金属+
另一种盐
34.
铁和硫酸铜溶液反应:
Fe+CuSO
4
===FeSO4
+Cu
35.
锌和硫酸铜溶液反应:
Zn+CuSO
4
===ZnSO+Cu
4
36.铜和硝酸汞溶液反应:
Cu+Hg(NO3)2===Cu(NO3)2+Hg
(3)碱性氧化物+酸┈┈┈┈
盐+
水
37.氧化铁和稀盐酸反应:
FeO+6HCl===2FeCl
3
+3HO
2
3
2
38.氧化铁和稀硫酸反应:
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
39.氧化铜和稀盐酸反应:
CuO+2HCl===CuCl2+H2O
40.氧化铜和稀硫酸反应:
CuO+H2SO4===CuSO4+H2O
41.氧化镁和稀硫酸反应:
MgO+H2SO4===MgSO4+H2O
42.氧化钙和稀盐酸反应:
CaO+2HCl===CaCl2+H2O
(4)酸性氧化物+碱┈┈┈┈盐+水
43.苛性钠暴露在空气中变质:
2NaOH+CO2====Na2CO3+H2O
44.苛性钠吸收二氧化硫气体:
2NaOH+SO2====Na2SO3+H2O
45.苛性钠吸收三氧化硫气体:
2NaOH+SO3====Na2SO4+H2O
46.消石灰放在空气中变质:
Ca(OH)2+CO2====CaCO3↓+H2O
47.消石灰吸收二氧化硫:
Ca(OH)2+SO2====CaSO3↓+H2O
(5)酸+碱┈┈┈┈
盐+
水
48.盐酸和烧碱起反应:
HCl+NaOH====NaCl+H
2O
49.
盐酸和氢氧化钾反应:
HCl+KOH====KCl+H2O
50.盐酸和氢氧化铜反应:
2HCl+Cu(OH)
2
====CuCl
2
+2H
2O
51.
盐酸和氢氧化钙反应:
2HCl+Ca(OH)
2
====CaCl
2
+2H
2O
52.
盐酸和氢氧化铁反应:
3HCl+Fe(OH)
3
====FeCl
3
+3H
O
2
53.氢氧化铝药物治疗胃酸过多:
3HCl+Al(OH)3
==AlCl3+3H2O
3
54.
硫酸和烧碱反应:
H
2
SO+2NaOH====NaSO+2H
2
O
4
2
4
55.
硫酸和氢氧化钾反应:
H
2
SO+2KOH====K
SO+2HO
4
2
4
2
56.
硫酸和氢氧化铜反应:
H2SO4+Cu(OH)2
====CuSO4+2H2O
57.
硫酸和氢氧化铁反应:
3H
SO+2Fe(OH)===Fe(SO)
+6HO
2
4
3
2
4
3
2
58.
硝酸和烧碱反应:
HNO
+NaOH====NaNO+HO
3
3
2
(6)酸+盐┈┈┈┈
另一种酸+另一种盐
59.大理石与稀盐酸反应:
CaCO3+2HCl==CaCl
2+H2O+CO2↑
60.碳酸钠与稀盐酸反应:
Na
2CO3+2HCl=2NaCl+H
2O+CO2↑
61.碳酸镁与稀盐酸反应:
MgCO
3
+2HCl==MgCl
2
+HO+CO↑
2
2
62.盐酸和硝酸银溶液反应:
HCl+AgNO===AgCl↓+HNO
3
3
63.硫酸和碳酸钠反应:
Na
2CO3+H2SO4===Na2SO4+H2O+CO2
↑
64.硫酸和氯化钡溶液反应:
HSO+BaCl
2
====BaSO↓+2HCl
2
4
4
(7)碱+盐┈┈┈┈另一种碱+另一种盐
65.氢氧化钠与硫酸铜:
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
66.氢氧化钠与氯化铁:
3NaOH+FeCl3====Fe(OH)3↓+3NaCl
67.氢氧化钠与氯化镁:
2NaOH+MgCl2====Mg(OH)2↓+2NaCl
68.氢氧化钠与氯化铜:
2NaOH+CuCl2====Cu(OH)2↓+2NaCl
69.氢氧化钙与碳酸钠:
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
(8)盐+盐┈┈┈┈两种新盐
70.氯化钠溶液和硝酸银溶液:
NaCl+AgNO3===AgCl↓+NaNO3
71.硫酸钠和氯化钡:
Na2SO4+BaCl2====BaSO4↓+2NaCl
五、其它反应:
72.二氧化碳溶解于水:
CO2+H2O===H2CO3
73.生石灰溶于水:
CaO+H2O===Ca(OH)2
74.氧化钠溶于水:
Na2O+H2O====2NaOH
75.三氧化硫溶于水:
SO3+H2O====H2SO4
4
76.硫酸铜晶体受热分解,不同温度下分解产物不同。
(1)45℃左右时失去两分子结晶水:
CuSO4·5H2O==CuSO4·3H2O+2H2O
(2)110℃以上失去四分子结晶水:
CuSO4·5H2O==CuSO4·H2O+4H2O
(3)258℃以上将失去全部水结晶成为白色粉末状无水硫酸铜:
CuSO4·5H2O==CuSO4
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 完整版 初中 化学方程式 汇总 打印 doc
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 转基因粮食的危害资料摘编Word下载.docx
转基因粮食的危害资料摘编Word下载.docx
