 届高考化学高考模拟适应性考试一化学试题及答案Word下载.docx
届高考化学高考模拟适应性考试一化学试题及答案Word下载.docx
- 文档编号:15155147
- 上传时间:2022-10-28
- 格式:DOCX
- 页数:10
- 大小:219.07KB
届高考化学高考模拟适应性考试一化学试题及答案Word下载.docx
《届高考化学高考模拟适应性考试一化学试题及答案Word下载.docx》由会员分享,可在线阅读,更多相关《届高考化学高考模拟适应性考试一化学试题及答案Word下载.docx(10页珍藏版)》请在冰豆网上搜索。
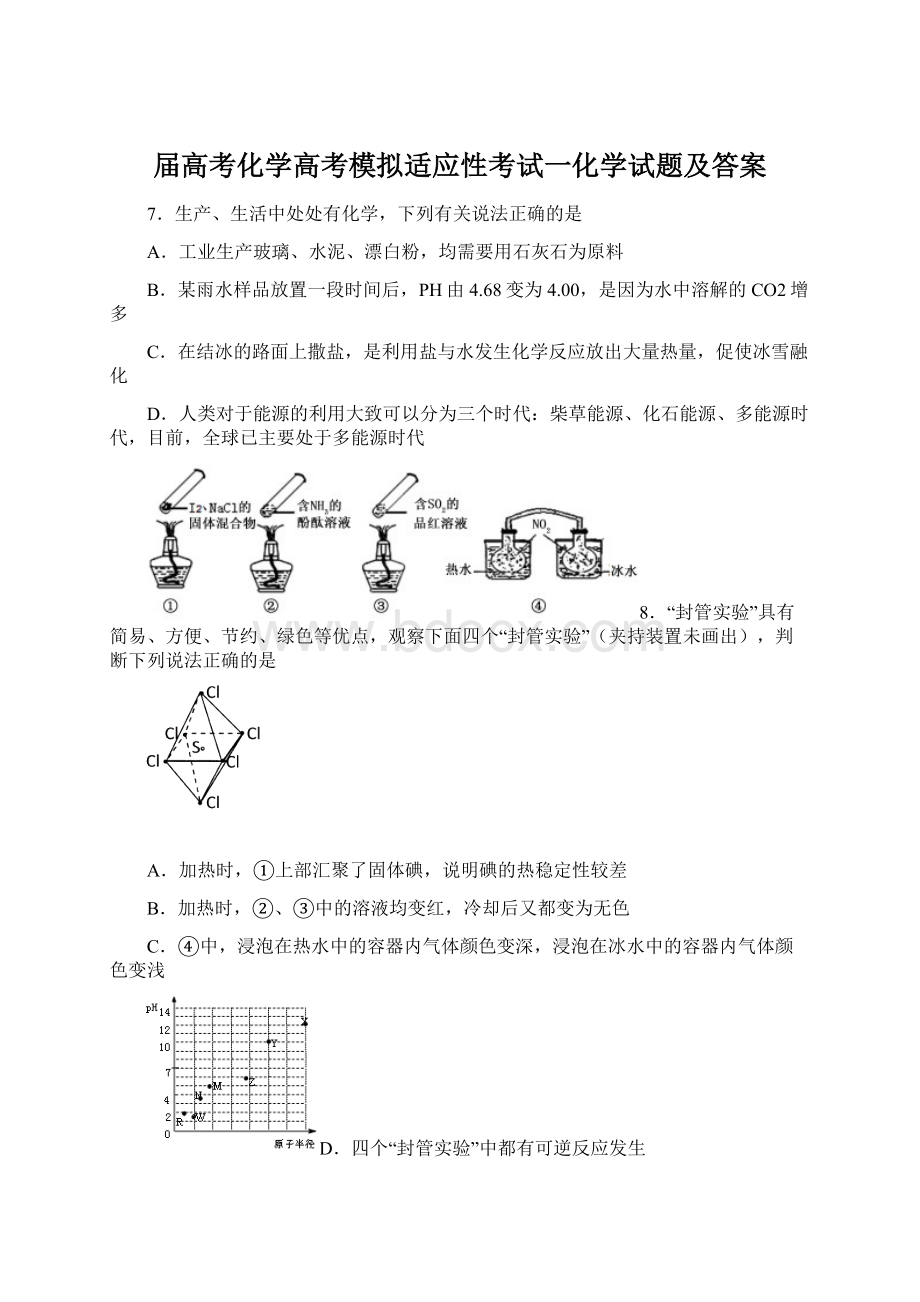
应后溶液的pH>7
10.石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;
石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能,还可用于H2的提纯;
将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都增加一个氢原子可得最薄的绝缘新材料石墨烷。
下列有关说法中不正确的是
A.石墨烯和石墨炔互为同素异形体
B.石墨炔有望替代二氧化硅用作半导体材料
C.12g石墨烯完全转变为石墨烷需标况下11.2L氢气
D.石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜
11.已知:
是碳酸
甲乙酯的工业生产原理。
下图是投料比[]
分别为3:
1和1:
1、反应物的总物质的量相同时,的平衡转化率与温度的
关系曲线。
下列说法正确的是
A.曲线b所对应的投料比为3:
1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯
的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总
物质的量之比为2:
1
12.高铁酸盐在能源环保领域有广泛用途。
用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。
下列推断合理的是
A.镍是阳极,电极反应为4OH--4e一=O2↑+2H2O
B.电解时电流的方向为:
负极→Ni电极→溶液→Fe
电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
13.下列有关电解质溶液的叙述正确的是
A.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<
7,则滤液中:
c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,不断增大
C.室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入0.05molCaO,所得溶液中增大
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>
7,则H2A是弱酸;
若pH<
7,则H2A是强酸
26.(14分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·
xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小。
用氧化还原滴定法测定TiO2的质量分数:
一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·
xH2O的化学方程式为
(2)玻璃棒有多种用途,下列实验操作中玻璃棒的作用完全相同的是(填字母)
①测定醋酸钠溶液的pH②加热食盐溶液制备NaCl晶体
③配制0.1mol/L的硫酸溶液④用淀粉—KI试纸检验溶液中氧化性离子
⑤配制10%的硫酸钠溶液
A.①⑤B.②⑤C.①④D.③④
(3)水洗时检验TiO2·
xH2O已洗净的方法是
(4)下列可用于测定TiO2粒子大小的方法是(填字母代号)
a.核磁共振氢谱b.红外光谱法c.质谱法d.透射电子显微镜法
(5)滴定终点的现象是
(6)滴定分析时,称取TiO2(摩尔质量为Mg·
mol-1)试样wg,消耗cmol·
L-1NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为%
(7)下列操作会导致TiO2质量分数测定结果偏高的是
A.滴定终点读取滴定管刻度时,俯视标准液液面
B.配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出
C.容量瓶清洗之后,未干燥
D.配制标准溶液定容时,俯视刻度线
27.(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。
因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:
H2(g)+1/2O2(g)═H2O(g)△H1=—241.8kJ•mol-1
2C(s)+O2(g)═2CO(g)△H2=—221kJ•mol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:
H2S:
Ka1=1.3×
10-7,Ka2=7.1×
10-15;
H2CO3:
Ka1=4.4×
10-7,Ka2=4.7×
10-11)
(3)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:
CO(g)+H2O(g)CO2(g)+H2(g)ΔH,得到两组数据
实验组
温度℃
起始量/mol
平衡量/mol
达到平衡
所需时间/min
CO
H2O
H2
650
4
2
1.6
2.4
6
900
0.4
3
该反应的H0(填“<”或“>”);
若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0molCO,5mo1H2O,2mo1CO2,5molH2,则此时ʋ正ʋ逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)
C(g)+D(g)△H>0的化学平衡,其时间速率图像如
右图,下列选项中对于t1时刻采取的可能操作及其平
衡移动情况判断正确的是
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×
104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=。
(6)在不同条件下,NO的分解产物不同。
在高压下,
NO在40℃下分解生成两种化合物,体系中各组分
物质的量随时间变化曲线如图所示。
写出Y和Z
的化学式:
28.(15分)为减少铬渣的危害并从中提取硫酸钠,设计工艺如下:
已知:
①铬渣含有Na2SO4及少量Cr2O72-、Fe3+
②Fe3+、Cr3+完全沉淀(c≤1.0×
10-5mol·
L-1)时pH分别为3.6和5。
(1)“微热”的作用:
①;
②。
(2)根据溶解度(S)~温度(T)曲线,操作B的最佳方法为(填字母)
a.蒸发浓缩,趁热过滤
b.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为;
酸C为,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=。
(4)已知Cr(OH)3在溶液中存在平衡H++CrO2-(亮绿色)+H2O⇌Cr(OH)3(s)⇌Cr3+(紫色)+3OH-,加入NaOH溶液时要控制pH为5,pH不能过高的理由是。
(5)根据2CrO42-+2H+Cr2O72-+H2O设计上图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中左侧电极连接电源的极,电解制备过程的总反应方程式为。
测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为d,则此时Na2CrO4的转化率为。
若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为。
36.【化学—选修2:
化学与技术】(15分)
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。
工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·
2H2O),再高温煅烧草酸镍制取三氧化二镍。
已知草酸的钙、镁、镍盐均难溶于水。
工艺流程图如下所示。
(1)操作Ⅰ为。
(2)①加入H2O2发生的主要反应的离子方程式为;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为;
(3)草酸镍(NiC2O4·
2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。
NiC2O4受热分解的化学方程式为。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。
电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。
ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为。
amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是。
37.【化学―选修3物质结构与性质】
(15分)
氮族元素(Nitrogengroup)是元素周期表VA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种。
(1)氮族元素的外围电子排布式的通式为;
基态磷原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为。
(2)PH3分子的VSEPR模型为______________,键角NH3H2O(填“>
”、“<
”或“=”)。
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:
已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为。
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是。
NH3易与Cu2+反应,而NF3却不能,其原因是。
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的
晶胞结构与金刚石类似,磷原子作面心立方
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高考 化学 模拟 适应性 考试 化学试题 答案
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《巴黎圣母院》3000字读书心得范文.docx
《巴黎圣母院》3000字读书心得范文.docx
