 高中化学专题2从海水中获得的化学物质第二单元钠镁及其化合物第1课时金属钠的性质与应用学案苏教版必修1Word文件下载.docx
高中化学专题2从海水中获得的化学物质第二单元钠镁及其化合物第1课时金属钠的性质与应用学案苏教版必修1Word文件下载.docx
- 文档编号:14987232
- 上传时间:2022-10-26
- 格式:DOCX
- 页数:15
- 大小:78.60KB
高中化学专题2从海水中获得的化学物质第二单元钠镁及其化合物第1课时金属钠的性质与应用学案苏教版必修1Word文件下载.docx
《高中化学专题2从海水中获得的化学物质第二单元钠镁及其化合物第1课时金属钠的性质与应用学案苏教版必修1Word文件下载.docx》由会员分享,可在线阅读,更多相关《高中化学专题2从海水中获得的化学物质第二单元钠镁及其化合物第1课时金属钠的性质与应用学案苏教版必修1Word文件下载.docx(15页珍藏版)》请在冰豆网上搜索。
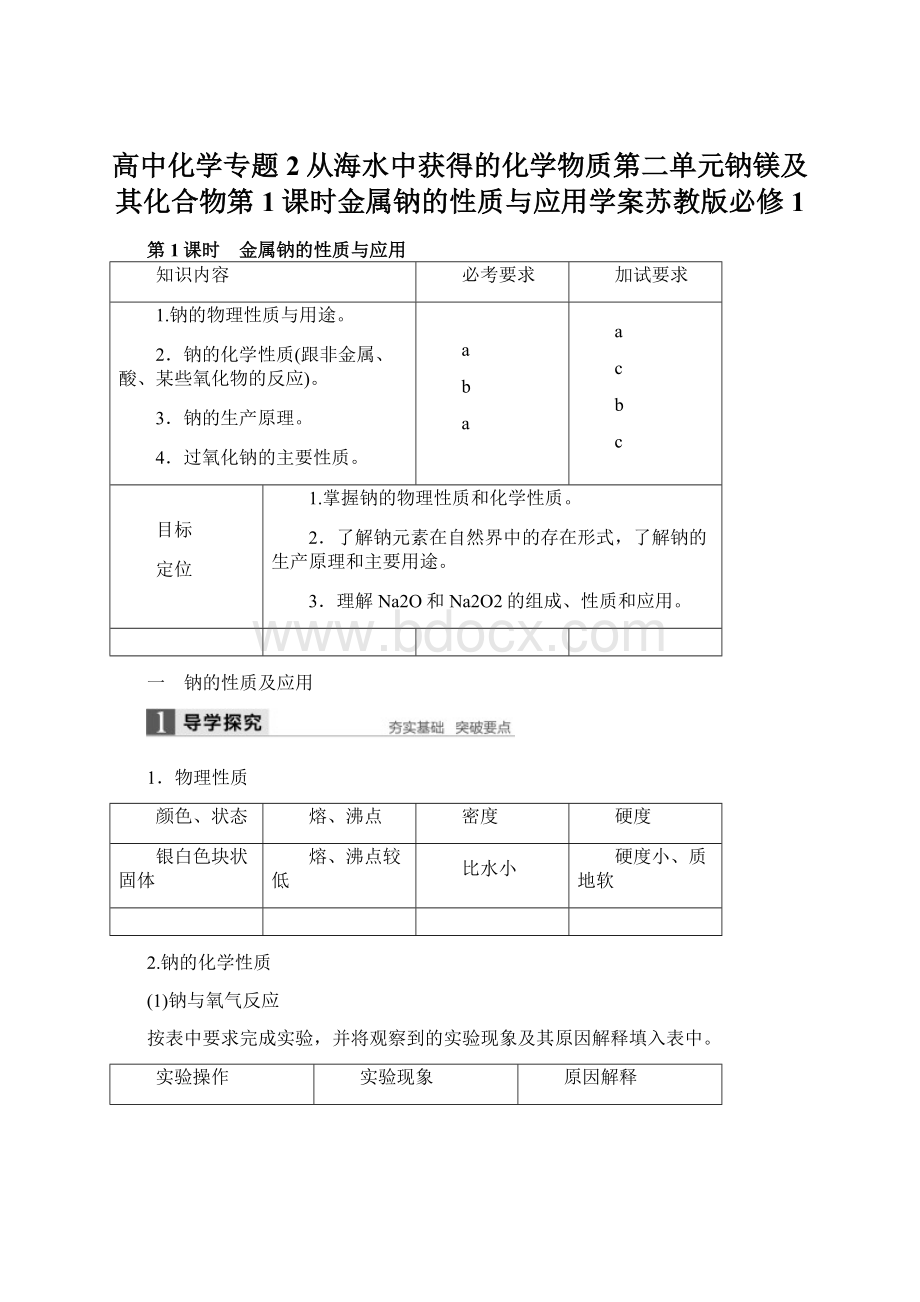
熔、沸点
密度
硬度
银白色块状固体
熔、沸点较低
比水小
硬度小、质地软
2.钠的化学性质
(1)钠与氧气反应
按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
实验操作
实验现象
原因解释
钠的新切面呈银白色,具有金属光泽,在空气中很快变暗
钠是活泼金属,在空气中极易被氧化,生成Na2O
把一小块金属钠放在坩埚中,加热
钠先熔化为银白色小球;
然后燃烧,火焰呈黄色;
最后生成淡黄色固体
金属钠熔点低,加热时与O2反应生成Na2O2
①钠在常温下与氧气反应的化学方程式是4Na+O2===2Na2O,在加热点燃时反应的化学方程式是2Na+O2Na2O2。
由此你能得出的结论是反应条件不同,其产物不同。
②通过以上实验过程,可以说明钠具有的性质有哪些?
并分析说明在实验室中应怎样保存金属钠?
答案 钠的硬度小,熔点低,是一种银白色的金属,具有金属光泽。
常温下极易被氧化,加热时可燃烧生成Na2O2。
因为钠在空气中极易被氧化,实验室保存钠时应与空气隔绝,通常保存在煤油中。
(2)钠与水反应
在小烧杯中加入约的水,滴入1~2滴酚酞溶液,将切好的钠投入到水中,盖上表面皿,观察实验现象。
填写下表:
原因分析
钠浮在水面上
钠的密度比水小
钠熔成光亮小球
反应放热且钠熔点低
四处游动
生成气体
发出“嘶嘶”响声,且很快消失
反应剧烈
溶液变红色
反应生成物显碱性
钠与水反应的化学方程式是2Na+2H2O===2NaOH+H2↑,氧化剂是H2O,还原剂是Na。
3.钠的制备和用途
(1)制备
工业上电解熔融NaCl可以得到金属钠:
2NaCl2Na+Cl2↑(填电解方程式)。
(2)用途
①钠和钾的合金常温下呈液态,可用于快中子反应堆作热交换剂。
②高压钠灯发出的黄光射程远,透雾能力强,常用作路灯。
③金属钠还可以用于钛、锆、铌、钽等金属的冶炼。
如Na与TiCl4反应:
TiCl4+4NaTi+4NaCl。
归纳总结
有关钠的反应
(1)钠在常温下与O2反应生成Na2O,加热条件下生成Na2O2,钠与O2的反应产物是由温度决定的,而不是由O2的量决定的。
(2)钠与水(滴有酚酞)反应的实验现象可概括为5个字——“浮”“熔”“游”“响”“红”。
(3)钠与酸反应是先酸后水;
钠与盐溶液反应是先水后盐,并不能置换出不活泼金属。
(4)钠与熔融的盐反应时可以置换出比其不活泼的金属。
1.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量大
D.两块钠的反应产物质量一样大
答案 B
解析 根据关系式:
2Na~Na2O2~2e-、2Na~Na2O~2e-,可知等质量的两块钠反应生成的氧化物的物质的量、转移电子的物质的量都相等,因为Na2O2的摩尔质量比Na2O的大,所以生成的Na2O2的质量比Na2O的大。
2.将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A.HClB.NaOH
C.K2SO4D.CuSO4
答案 D
解析 钠与4种溶液中的水反应均有H2放出。
A、B、C三项只有H2放出,逸出H2的质量小于加入的Na的质量,溶液质量增加;
D项,氢气与氢氧化铜沉淀的质量大于所加入的钠的质量,故溶液质量减轻。
二 氧化钠和过氧化钠(过氧化钠为加试要求)
1.氧化钠是一种碱性氧化物,能与水、酸、酸性氧化物等发生反应。
请写出下列反应的化学方程式:
(1)氧化钠与水反应:
Na2O+H2O===2NaOH;
(2)氧化钠溶于盐酸:
Na2O+2HCl===2NaCl+H2O;
(3)氧化钠与CO2反应:
Na2O+CO2===Na2CO3。
2.实验探究(加试要求)
(1)把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,现象为______________________;
用手轻摸试管外壁,感觉________________________________,
说明反应__________;
向试管溶液中滴入酚酞溶液,现象为_________________________。
实验结论:
______________________________________________________________。
(2)写出过氧化钠与水反应的化学方程式:
________________________;
氧化剂是________,还原剂是________;
被氧化的元素是________,被还原的元素是________。
答案
(1)试管中有大量气泡产生,带火星的木条复燃 试管壁温度升高 放热 溶液先变红,后褪色 过氧化钠与水反应产生O2和碱性物质,同时放热,过氧化钠有漂白性
(2)2Na2O2+2H2O===4NaOH+O2↑ Na2O2 Na2O2 Na2O2中的氧元素 Na2O2中的氧元素
3.(加试要求)氧化钠、过氧化钠都能与水反应生成氢氧化钠,其不同点是Na2O2与水反应有O2生成,Na2O与水反应无O2生成。
二者与二氧化碳反应具有类似的规律,试写出过氧化钠与二氧化碳反应的化学方程式:
2Na2O2+2CO2===2Na2CO3+O2。
4.(加试要求)Na2O2具有强氧化性,与H2O、CO2反应生成O2,Na2O2可作漂白剂和呼吸面具中的供氧剂。
氧化钠与过氧化钠的比较(加试要求)
名称
氧化钠
过氧化钠
化学式
Na2O
Na2O2
氧元素的
化合价
-2价
-1价
颜色状态
白色固体
淡黄色固体
氧化物类别
碱性氧化物
过氧化物
化学性质
相同点
都能与H2O反应生成NaOH,都能与CO2反应生成Na2CO3
不同点
Na2O2与H2O、CO2反应有O2产生,具有强氧化性,而Na2O不具有此强氧化性
[提醒]
(1)Na2O2不属于碱性氧化物。
(2)Na2O固体中的阳离子和阴离子分别为Na+、O2-,其数目比为2∶1,Na2O2固体中的阳离子和阴离子分别为Na+、O,其数目比为2∶1。
(3)Na2O2与CO2或H2O反应均为自身氧化还原反应,Na2O2既是氧化剂又是还原剂,H2O和CO2既不是氧化剂也不是还原剂。
1molNa2O2参与反应转移1mol电子。
3.(加试要求)下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O、Na2O2都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2与水反应时,1molNa2O2转移2mol电子
答案 C
解析 Na2O2与水反应时除了生成碱外,还生成了O2,故Na2O2不属于碱性氧化物,故A项错;
Na2O2是淡黄色固体,故B项错;
Na2O2与CO2和H2O反应时,是Na2O2中的氧元素发生了氧化还原反应,CO2、H2O既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原剂,1molNa2O2反应转移1mole-,故C项正确,故D项错误。
4.(加试要求)下列判断正确的是( )
A.可用水来确定某Na2O粉末中是否含有Na2O2
B.可用CO2来确定某Na2O粉末中是否含有Na2O2
C.可利用在空气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
答案 A
解析 CO2、H2O与Na2O2、Na2O均能反应,但与Na2O2反应时能产生气体,不过因氧气是无色无味的气体且CO2也是气体,故CO2与Na2O2的反应无明显的现象产生,水与Na2O2反应则会产生气泡而有明显的现象,故A项正确,B项错误;
在空气中加热Na2O2与Na2O的混合物,后者会转化为前者,故C项错误;
D项中两种氧化物加到酚酞溶液中后,均先与溶液中的水反应生成碱而使溶液变为红色,但因Na2O2具有漂白性,最后又会将变成红色的溶液漂白,D项错误。
1.下列关于钠的说法中不正确的是( )
A.实验后剩余的钠粒需放回原试剂瓶中
B.自然界中钠只能以化合物的形式存在
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.当钠与硫酸铜溶液反应时,有大量红色固体铜析出
解析 实验剩余的金属单质和非金属单质应放回原试剂瓶,即剩余的钠应放回原试剂瓶,A正确;
钠是非常活泼的金属,极易和氧气、水等反应,故在自然界中无钠单质,只能以化合态存在,B正确;
钠的密度比煤油的大,且和煤油不反应,故保存在煤油中可以隔绝空气和水,C正确;
钠和盐溶液反应时,先和水反应,生成的氢氧化钠再和盐反应,不能置换出金属铜,D错误。
2.取一小块金属钠放在燃烧匙里加热,观察到下列实验现象:
①金属先熔化;
②在空气中燃烧,放出黄色火花;
③燃烧后得白色固体;
④燃烧时火焰为黄色;
⑤燃烧后生成淡黄色固体物质。
描述正确的是( )
A.①②B.①②③
C.①④D.①④⑤
解析 钠的熔点只有97.8℃,受热时立即熔化。
钠是一种很活泼的金属,受热时与氧气化合生成过氧化钠,呈淡黄色。
钠在空气中燃烧的火焰为黄色。
3.将2.3g金属钠放入1000g水中,完全反应后溶液的质量分数为( )
A.×
100%
B.×
C.×
D.×
解析 依据Na与H2O的反应2Na+2H2O===2NaOH+H2↑可知,2.3g钠与1000g水完全反应后生成4gNaOH,同时放出0.1gH2,故反应后溶液的质量分数为w(NaOH)=×
100%。
4.将一小块钠投入到盛有MgCl2溶液的试管中,不可能观察到的现象是( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有白色物质生成
D.溶液变浑浊
解析 钠投入MgCl2溶液中,钠先与水反应产生氢氧化钠,然后氢氧化钠与氯化镁发生复分解反应生成难溶物氢氧化镁,使溶液变浑浊。
5.(加试要求)下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠中钠元素的化合价相同,氧元素化合价不同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
解析 Na2O和Na2O2中钠元素化合价都为+1价,氧元素化合价不同,前者中为-2价,后者中为-1价,A选项正确;
因2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2,故C项正确,B项错误。
6.(加试要求)下图中,A是固体金属单质,燃烧时火焰呈黄色。
(1)判断A、B、C、D是什么物质,写出其化学式:
A________,B________,C________,D_____
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 专题 海水 获得 化学物质 第二 单元 及其 化合物 课时 金属钠 性质 应用 学案苏教版 必修
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
链接地址:https://www.bdocx.com/doc/14987232.html


 12处方点评管理规范实施细则_精品文档.doc
12处方点评管理规范实施细则_精品文档.doc
 17种抗癌药纳入国家基本医疗保险工伤保险和生育保险药品目录_精品文档.xls
17种抗癌药纳入国家基本医疗保险工伤保险和生育保险药品目录_精品文档.xls
