 结果化学课后习题考试重点raWord文档格式.docx
结果化学课后习题考试重点raWord文档格式.docx
- 文档编号:14985057
- 上传时间:2022-10-26
- 格式:DOCX
- 页数:15
- 大小:359.64KB
结果化学课后习题考试重点raWord文档格式.docx
《结果化学课后习题考试重点raWord文档格式.docx》由会员分享,可在线阅读,更多相关《结果化学课后习题考试重点raWord文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
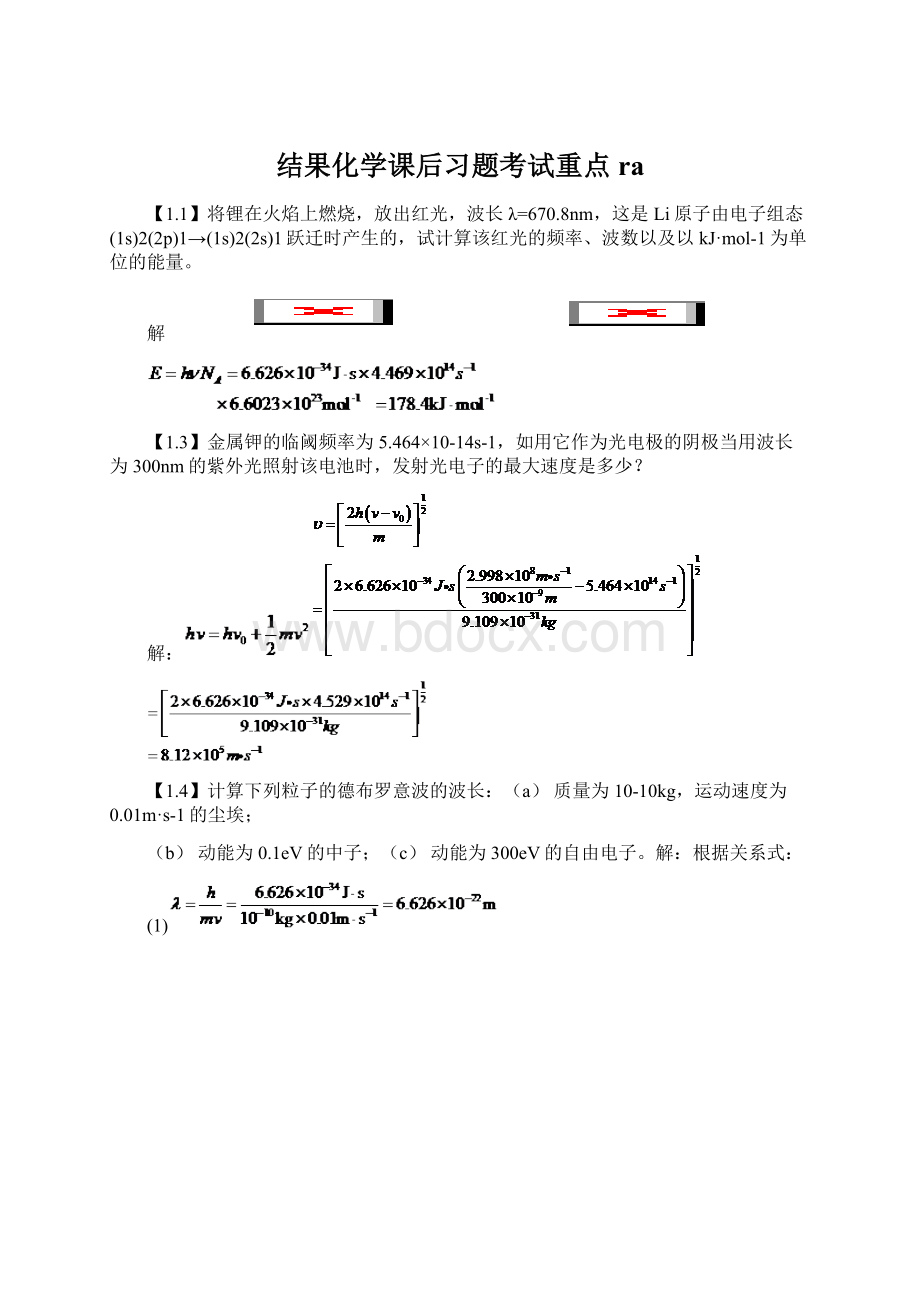
式中,u是微粒的传播速度,它不等于微粒的运动速度υ,但③中用了,显然是错的。
在④中,无疑是正确的,这里的E是微粒的总能量。
若计及E中的势能,则⑤也不正确。
【1.7】子弹(质量0.01kg,速度1000m·
s-1),尘埃(质量10-9kg,速度10m·
s-1)、作布郎运动的花粉(质量10-13kg,速度1m·
s-1)、原子中电子(速度1000m·
s-1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?
按测不准关系,诸粒子的坐标的不确定度分别为:
子弹:
尘埃:
花粉:
电子:
【1.11】是算符的本征函数,求其本征值。
应用量子力学基本假设Ⅱ(算符)和Ⅲ(本征函数,本征值和本征方程)得:
因此,本征值为。
【1.16】求一维势箱中粒子在和状态时,在箱中范围内出现的概率,并与图1.3.2(b)相比较,讨论所得结果是否合理。
(a)
由上述表达式计算和,并列表如下:
1/8
1/4
1/3
3/8
1/2
0.293
1.000
1.500
1.726
2.000
5/8
2/3
3/4
7/8
1
根据表中所列数据作图示于图1.16中。
图1.16
(b)粒子在状态时,出现在和间的概率为:
粒子在ψ2状态时,出现在0.49l和0.51l见的概率为:
(c)计算结果与图形符合。
【1.19】一个粒子处在的三维势箱中,试求能级最低的前5个能量值[以h2/(8ma2)为单位],计算每个能级的简并度。
质量为m的粒子在边长为a的立方箱中运动,其能级公式为:
E122=E212=E221=9
E113=E131=E311=11
E222=12
【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R及整数n1、n2的数值。
解:
将各波长换算成波数:
由于这些谱线相邻,可令,……。
列出下列4式:
(1)÷
(2)得:
用尝试法得m=2(任意两式计算,结果皆同)。
将m=2带入上列4式中任意一式,得:
因而,氢原子可见光谱(Balmer线系)各谱线的波数可归纳为下式:
式中,。
【2.4】请通过计算说明,用氢原子从第六激发态跃迁到基态所产生的光子照射长度为的线型分子,该分子能否产生吸收光谱。
若能,计算谱线的最大波长;
若不能,请提出将不能变为能的思路。
氢原子从第六激发态(n=7)跃迁到基态(n=1)所产生的光子的能量为:
而分子产生吸收光谱所需要的最低能量为:
显然,但此两种能量不相等,根据量子化规则,不能产生吸收光效应。
若使它产生吸收光谱,可改换光源,例如用连续光谱代替H原子光谱。
此时可满足量子化条件,该共轭分子可产生吸收光谱,其吸收波长为:
【2.5】计算氢原子在和处的比值。
氢原子基态波函数为:
该函数在r=a0和r=2a0处的比值为:
而在在r=a0和r=2a0处的比值为:
e2≈7.38906
【1.14】写出Li2+离子的Schrö
dinger方程,说明该方程中各符号及各项的意义,写出Li2+离子1s态的波函数并计算或回答:
(a)1s电子径向分布最大值离核的距离;
(b)1s电子离核的平均距离;
(c)1s电子几率密度最大处离核的距离;
(d)比较Li2+离子的2s和2p态能量的高低;
(e)Li原子的第一电高能(按Slater屏蔽常数算有效核电荷)。
Li2+离子的Schrö
dinger方程为:
方程中,μ和r分别代表Li2+的约化质量和电子到核的距离;
▽2,ψ和E分别是Laplace算符、状态函数及该状态的能量,h和ε0分别是Planck常数和真空电容率。
方括号内为总能量算符,其中第一项为动能算符。
第二项为势能算符(即势能函数)。
Li2+子1s态的波函数为:
(a)
又
1s电子径向分布最大值在距核处。
(b)(c)
因为随着r的增大而单调下降,所以不能用令一阶导数为0的方法求其最大值离核的距离。
分析的表达式可见,r=0时最大,因而也最大。
但实际上r不能为0(电子不可能落到原于核上),因此更确切的说法是r趋近于0时1s电子的几率密度最大。
(d)Li2+为单电子“原子”,组态的能量只与主量子数有关,所以2s和2p态简并,即E2s=E2p。
(e)Li原子的基组态为(1s)2(2s)1。
对2s电子来说,1s电子为其相邻内一组电子,σ=0.85。
因而:
根据Koopmann定理,Li原子的第一电离能:
I1=-E2s=5.75eV
【2.16】已知He原子的第一电离能I1=24.59eV,试计算:
(a)第二电离能;
(b)基态能量;
(c)在1s轨道中两个电子的互斥能;
(d)屏蔽常数;
(e)根据(d)所得结果求H-的基态能量.
(a)He原子的第二电离能是下一电离过程所需要的最低能量,即:
He+(g)He2+(g)+c
He+是单电子“原子”,可按单电子原子能级公式计算,因而:
(b)从原子的电离能的定义出发,按下述步骤推求He原子基态的能量:
He(g)He+(g)+e
(1)
He+(g)He2+(g)+e
(2)
由
(1)式得:
将
(2)式代入,得:
推而广之,含有n个电子的多电子原子A,其基态能量等于各级电离能之和的负值,即
(c)用J(s,s)表示He原子中两个1s电子的互斥能,则:
也可直接由减求算J(s,s),两法本质相同。
(d)
(e)H-是核电荷为1的两电子“原子”,其基组态为(1s)2,因而基态能量为:
【2.19】写出下列原子能量最低的光谱支项的符号:
(a)Si;
(b)Mn;
(c)Br;
(d)Nb;
(e)Ni
写出各原子的基组态和最外层电子排布(对全充满的电子层,电子的自旋互相抵消,各电子的轨道角动量矢量也相互抵消,不必考虑),根据Hund规则推出原子最低能态的自旋量子数S,角量子数L和总量子数J,进而写出最稳定的光谱支项。
(a)Si:
(b)Mn:
(c)Br:
(d)Nb:
(e)Ni:
【3.2】写出,,的键级,键长长短次序和磁性。
分子(或离子)
键级
2.5
2
1.5
键长次序
磁性
顺磁
抗磁
【3.3】分子基态的电子组态为,其激发态有,,
试比较,,三者能级的高低次序,说明理由,能量最低的激发态是顺磁性还是反磁性?
。
因为(c)中两个电子都在反键轨道上,与H原子的基态能量相比,约高出。
而(a)和(b)中的2个电子分别处在成键轨道和反键轨道上,和都与H原子的基态能量相近,但(a)中2个电子的自旋相反,(b)中的2个电子的自旋相同,因而稍高于。
能级最低的激发态(b)是顺磁性的。
【3.5】基态为反磁性分子,试写出其电子组态;
实验测定分子键长为,比原子共价双键半径和短,试说明其原因。
分子的基组态为:
由于s-p混杂,为弱反键,分子的键级在之间,从而使实测键长比按共价双键半径计算得到的值短。
【3.6】据分子轨道理论,指出的键比的键是强还是弱,为什么?
的键比的键弱。
原因是:
的基态价电子组态为,键级为1。
比少1个反键电子,键级为1.5。
【3.8】画出的分子轨道示意图,计算键级及自旋磁矩,试比较和何者的键更强?
哪一个键长长一些?
NO的价层分子轨道能级示意图如图3.8所示。
键级
图3.8NO价层分子轨道能级图
不成对电子数为1,自旋磁矩。
由于NO+失去了1个反键的2π电子,因而键级为3,所以它的化学键比NO化学键强。
相应地,其键长比NO的键长短。
【3.13】写出,的价电子组态和基态光谱项。
:
,基态光谱项:
CN:
,基态光谱项:
【5.1】利用价电子互斥理论,说明等分子的形状。
分子
m+n(不计电子)
6
4
5
价电子空间分布
八面体
四面体
三角双锥
孤对电子对数
3
配位原子数(电子对)
几何构型
正方形
三角锥
直线形
四方锥
【5.4】写出下列分子或离子中,中心原子所采用的杂化轨道:
,,,,,,,,,,,,。
分子或离子
中心原子的杂化轨道
CS2
三角形
准四面体
【5.6】臭氧的键角是。
若用杂化轨道描述中心氧原子的成键轨道,试按键角与轨道成分的关系式计算:
(a)成键杂化轨道中系数和值;
(b)成键杂化轨道的每个原子轨道贡献的百分数。
(a)根据杂化轨道的正交、归一性可得下立方程[在本方程中
(2)作为已知条件给出]:
解之,得
所以,O3原子的O原子的成键杂化轨道为:
ψ成
而被孤对电子占据的杂化轨道为:
孤
可见,孤中的s成分比成中的s成分多。
(b)按态叠加原理,杂化轨道中某一原子轨道所占的成分(即该原子轨道对杂化轨道的贡献)等于该原子轨道组合系数的平方。
因此,和对成的贡献分别为和,即分别约为0.3108和0.6892。
【5.15】已知三次甲基甲烷为平面形分子,形成键。
试用HMO法处理,证明中心碳原子和周围3个碳原子间的键键级和为。
提示:
列出久期行列式,解得,0,0,,然后再求。
画出分子骨架并给各C原子编号,如图5.15(a)。
根据Huckel近似,写出相应于此骨架的久期方程如下:
利用分子的对称性将久期方程化简,求出,代回久期方程,结合归一化条件求出组合系数,进而写出分子轨道。
将,可求出与分子轨道相应的能级。
考虑对镜面Ⅰ和Ⅱ都对称,则有,于是久期方程可化简为:
令其系数行列式
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 结果 化学 课后 习题 考试 重点 ra
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 12处方点评管理规范实施细则_精品文档.doc
12处方点评管理规范实施细则_精品文档.doc
 17种抗癌药纳入国家基本医疗保险工伤保险和生育保险药品目录_精品文档.xls
17种抗癌药纳入国家基本医疗保险工伤保险和生育保险药品目录_精品文档.xls
