 39高考化学二轮复习主观题综合训练二工艺流程卷139Word下载.docx
39高考化学二轮复习主观题综合训练二工艺流程卷139Word下载.docx
- 文档编号:14901154
- 上传时间:2022-10-25
- 格式:DOCX
- 页数:9
- 大小:221.89KB
39高考化学二轮复习主观题综合训练二工艺流程卷139Word下载.docx
《39高考化学二轮复习主观题综合训练二工艺流程卷139Word下载.docx》由会员分享,可在线阅读,更多相关《39高考化学二轮复习主观题综合训练二工艺流程卷139Word下载.docx(9页珍藏版)》请在冰豆网上搜索。
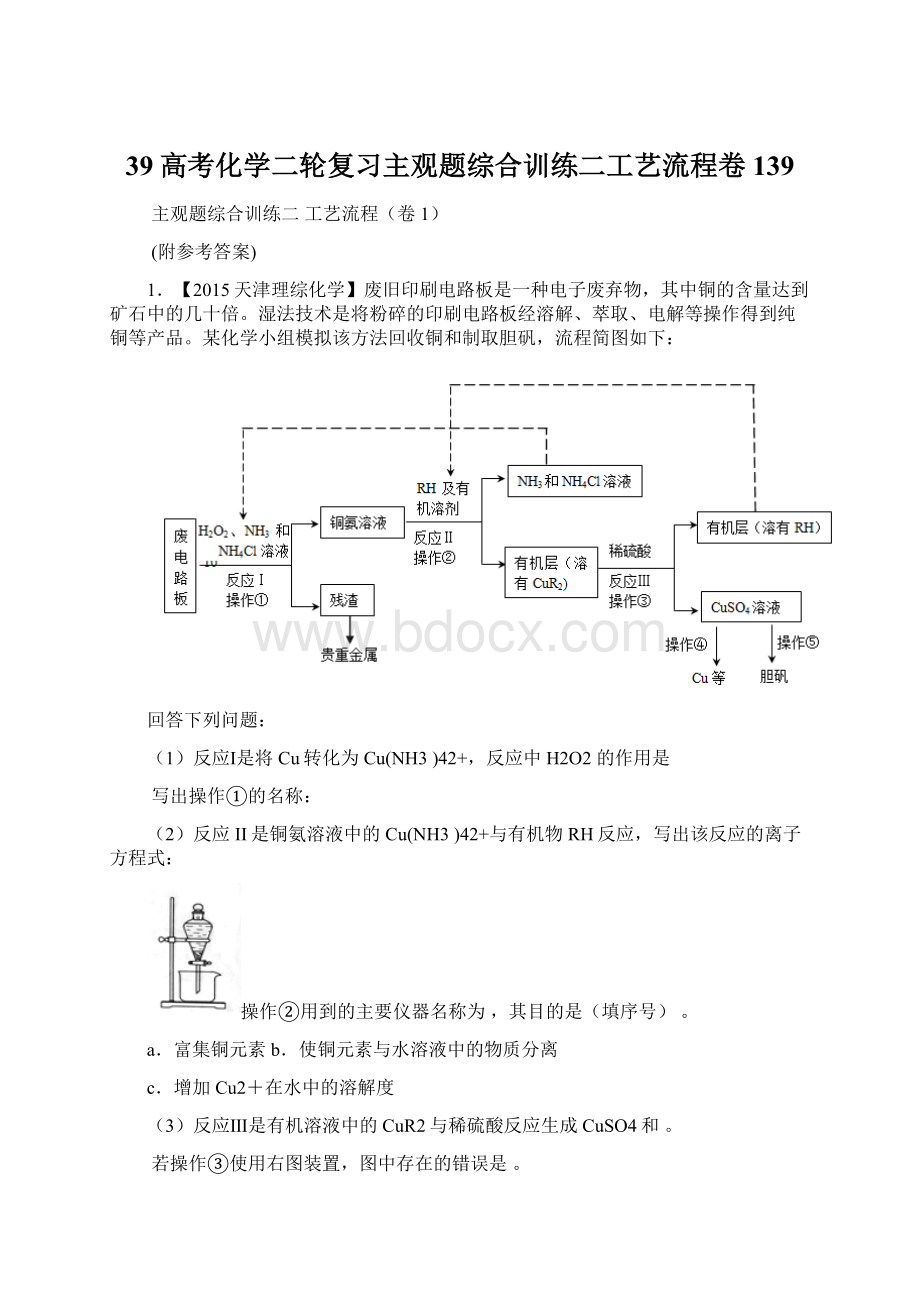
(4)操作④以石墨作电极电解CuSO4溶液。
阴极析出铜,阳极产物是。
操作⑤由硫酸铜溶液制胆矾的主要步骤是。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是。
循环使用的NH4Cl在反应Ⅰ中的主要作用是。
2.【2015四川理综化学】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:
FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。
请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择(填字母编号)。
A.KMnO4溶液B.K3[Fe(CN)6]溶液C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。
通入空气引起溶液pH降低的原因是。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s)=-1648kJ/mol
C(s)+O2(g)=CO2(g)=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。
该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。
将akg质量分数为b%的硫酸加入到ckg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。
按上述流程,第Ⅲ步应加入FeCO3kg。
3.【2015福建理综化学】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质
SiCl4
AlCl3
FeCl3
FeCl2
沸点/℃
57.6
180(升华)
300(升华)
1023
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是
(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)ΔH1=+1344.1kJ·
mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是。
4.【2015广东理综化学】七铝十二钙(12CaO·
7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(1)煅粉主要含MgO和,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液I中c(Mg2+)小于5×
10-6mol·
L-1,
则溶液pH大于(Mg(OH)2的Ksp=5×
10-12);
该工艺中不能用(NH4)2SO4代替NH4NO3,原因是。
(2)滤液I中的阴离子有(忽略杂质成分的影响);
若滤液I中仅通入CO2,会生成,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为。
(5)一种可超快充电的新型铝电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为。
5.【2015江苏化学】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。
清液pH>
11时CaSO4转化的离子方程式_________________________;
能提高其转化速率的措施有__________(填序号)
A.搅拌浆料B.加热浆料至100℃
C.增大氨水浓度D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。
滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);
检验洗涤是否完全的方法是______________________________________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因_____________________________。
6.(2015全国新课标I)硼及其化合物在工业上有许多用途。
以铁硼矿(主要成分为Mg2B2O5·
H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程
如图所示:
(1)写出Mg2B2O5·
H2O与硫酸反应的化学方程式_______________________
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施
有______________________________________________________(写出两条)。
(2)利用_____________的磁性,可将其从“浸渣”中分离。
“浸渣”中还剩余的物质是____________(化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_________________________。
然后在调节溶液的pH约为5,目的是___________________________。
(4)“粗硼酸”中的主要杂质是__________________________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,
其电子式为___________________。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。
以硼酸和金属镁为原料可制备
单质硼,用化学方程式表示制备过程___________________________________。
主观题综合训练二工艺流程(卷1)答案
1.【答案】
(1)作氧化剂过滤
(2)Cu(NH3)42++2RH=2NH4++2NH3+CuR2分液漏斗ab
(3)RH分液漏斗尖端未紧靠烧杯内壁液体过多
(4)O2H2SO4加热浓缩冷却结晶过滤
(5)H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
【解析】
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,Cu被氧化,则反应中H2O2的作用是作氧化剂;
操作①是把滤渣和液体分离,所以该操作为过滤;
(2)根据流程图可知,Cu(NH3)42+与有机物RH反应生成CuR2和氨气、氯化铵,所以该反应的离子方程式是Cu(NH3)42++2RH=2NH4++2NH3+CuR2;
操作②是把水层与有机层分离,所以为分液操作,需要的主要仪器为分液漏斗;
Cu元素富集在有机层,所以该操作的目的是富集Cu元素,使铜元素与水溶液中的物质分离,答案选ab;
(3)CuR2中R元素为-1价,所以反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和RH;
操作③使用的过滤操作中分液漏斗尖端未紧靠烧杯内壁,且分液漏斗内的液体太多;
(4)以石墨作电极电解CuSO4溶液。
阴极析出铜,则阳极为阴离子氢氧根放电,生成氧气,导致氢离子浓度增大,所以阳极的产物有O2、H2SO4;
由溶液得到晶体的操作步骤一般为加热浓缩冷却结晶过滤;
(5)操作④中得到的硫酸可用在反应III中,所以第三种循环的试剂为H2SO4;
氯化铵溶液为酸性,可降低溶液中氢氧根离子的浓度,防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。
2.【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)=-260kJ/mol。
(5)FeS2+4e-=Fe+2S2-
(6)-kg。
(2)若Fe3+没有完全还原,则可以用KSCN检验。
(3)部分Fe2+被氧化为Fe3+。
(4)根据盖斯定律可得:
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)=-260kJ/mol。
(5)正极得电子,化合价降低,可得正极方程式:
FeS2+4e-=Fe+2S2-
(6)由于最终得到FeSO4,根据元素守恒,n(Fe)=n(S),Fe来自于Fe2O3、FeS2、FeCO3;
S来自于FeS2、H2SO4则有:
(×
2+×
2×
)×
96%+=+×
×
2×
96%
则得答案:
-kg。
3.【答案】
(15分)
(1)Al3++3H2OAl(OH)3+3H+
(2)①防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率。
②Fe或铁;
③Al2O3(s)+3C(s)+2Cl2(g)=2AlCl3(g)+3CO(g)ΔH=+174.9kJ/mol;
④NaCl、NaClO、NaClO3;
⑤除去FeCl3,提高AlCl3纯度。
(1)氯化铝是强酸弱碱盐,在溶液中Al3+发生水解反应产生氢氧化铝胶体,其反应的离子方程式为Al3++3H2OAl(OH)3+3H+;
(2)①步骤Ⅰ中焙烧使固体中的水分挥发,导致气孔数目增多,其作用是可以防止后续步骤生成的AlCl3水解。
同时由于增大反应物的接触面积,使反应速率加快。
②根据物质中含有的元素组成可知:
若在步骤Ⅱ中不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是铁。
③第一个式子减去第二个式子,整理可得:
Al2O3(s)+3C(s)+2Cl2(g)=2AlCl3(g)+3CO(g)ΔH=+174.9kJ/mol;
④步骤Ⅲ
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 39 高考 化学 二轮 复习 主观题 综合 训练 工艺流程 139
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《巴黎圣母院》3000字读书心得范文.docx
《巴黎圣母院》3000字读书心得范文.docx
