 最新新课标全国卷2解析理科综合化学Word文件下载.docx
最新新课标全国卷2解析理科综合化学Word文件下载.docx
- 文档编号:14848614
- 上传时间:2022-10-25
- 格式:DOCX
- 页数:25
- 大小:290.47KB
最新新课标全国卷2解析理科综合化学Word文件下载.docx
《最新新课标全国卷2解析理科综合化学Word文件下载.docx》由会员分享,可在线阅读,更多相关《最新新课标全国卷2解析理科综合化学Word文件下载.docx(25页珍藏版)》请在冰豆网上搜索。
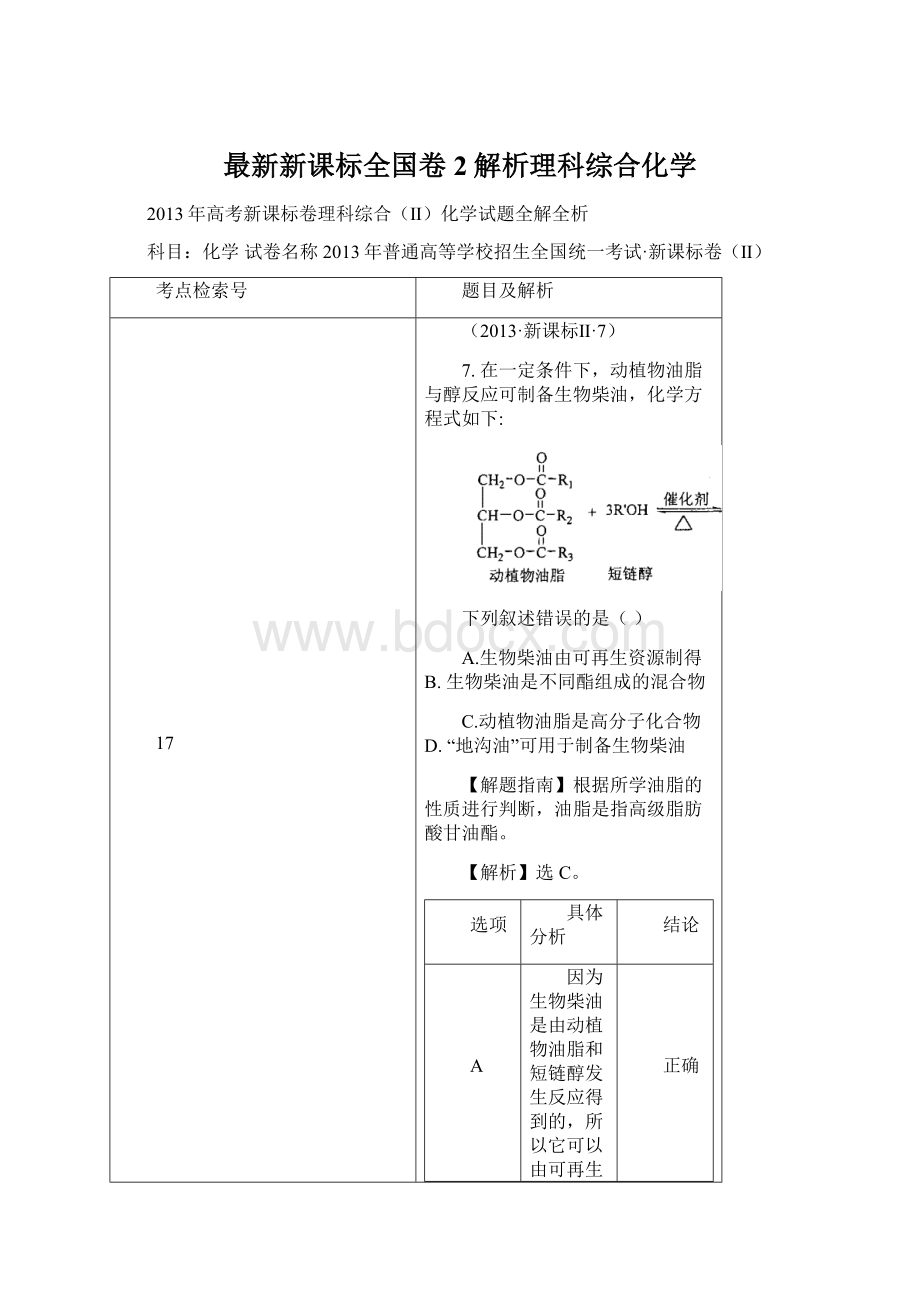
因为生物柴油是由动植物油脂和短链醇发生反应得到的,所以它可以由可再生资源制得。
正确
B
因为生物柴油中的R1、R2、R3既可以表示相同的烃基,也可以表示不同的烃基,因此生物柴油是混合物不是纯净物。
C
高分子化合物是指相对分子质量较大,从几万到几十万。
而动植物油脂相对分子质量一般不超过一千,故不是高分子化合物。
错误
D
“地沟油”中也有部分油脂存在,故也可以用来制备生物柴油。
8)
8.下列叙述中,错误的是()
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
【解题指南】本题应用苯的硝化反应,苯乙烯的加成反应,乙烯的加成反应和甲苯的取代反应来解答。
【解析】选D。
苯可以与浓硝酸、浓硫酸共热并保持55---60℃水浴加热发生取代反应生成硝基苯,其中浓硫酸起催化剂和吸水剂的作用,A项正确;
苯乙烯中的碳碳双键和苯环都可以和氢气发生加成反应,故在合适条件下催化加氢可生成乙基环己烷,B项正确;
乙烯可以与溴的四氯化碳溶液发生加成反应,碳碳双键断开分别加溴原子,生成1,2—二溴乙烷,C项正确;
甲苯与氯气在光照下反应应该在甲基上发生取代反应,不是2,4-二氯甲苯,D项错误。
1、8
9)
9.N0为阿伏伽德罗常数的值,下列叙述正确的是()
A.1.0L1.0mo1·
L-1的NaAlO2水溶液中含有的氧原子数为2N0
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5N0
C.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0
D.1mol的羟基与1mol的氢氧根离子所含电子数均为9N0
【解题指南】阿伏伽德罗常数的相关计算牵扯到以下知识点:
原子守恒,石墨的结构,溶液pH计算,原子团和离子的电子计算。
【解析】选B。
偏铝酸钠溶液中有水,水分子中也有氧原子存在,故氧原子数大于2N0
石墨层内是正六边形结构,每个六元环有6个碳原子,而每个碳原子同时为三个六元环所共有,故每个六元环平均只占有2个碳原子。
12g石墨烯含碳原子为1mol,故其中含六元环的个数应为0.5N0
该选项因为溶液的体积未知,故只能求出OH—的浓度,无法求出其数目
1个羟基中含9个电子,1个氢氧根离子中含10个电子,故此选项错误
3、8、12
10)
10.能正确表示下列反应的离子方程式是()
A.浓盐酸与铁屑反应:
2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:
2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:
CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:
3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
【解题指南】运用离子方程式的书写知识解答本题,知道哪些物质能拆写成离子形式,哪些不能拆;
其次还要了解常见的金属钠和铁的性质。
金属铁和盐酸反应时,因为H+的氧化性比较弱,只能把铁氧化为正二价,故不能生成三价铁离子,A项错误;
金属钠是一种非常活泼的金属,所以当它遇到CuSO4水溶液时,优先与水发生反应,故不能置换出金属铜,B项错误;
碳酸氢钠在水溶液中电离出的是钠离子和碳酸氢根离子而不是碳酸根离子,故反应时应为碳酸氢根离子与氢离子发生反应,C项错误;
氢氧化镁和氢氧化铁均为不溶于水的碱,故在书写离子方程式时应写成化学式;
且氢氧化铁比氢氧化镁更难溶于水,故可以用氢氧化镁制取氢氧化铁,D项正确。
9
11)
11.“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是()
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:
NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
【解题指南】解答本题时应了解原电池的工作原理,会判断正负极材料和电极反应式。
在该原电池中金属钠做负极材料,氯化镍做正极材料,NaAlCl4做电解质溶液,钠离子导体可以传导钠离子。
金属钠失电子变为钠离子,故有氯化钠生成,A项正确;
电池的总反应应该是金属钠还原Ni2+,B项错误;
正极反应为Ni2+得电子生成金属镍,C项正确;
钠离子导体可以传导钠离子,故钠离子可以在两极间移动,D项正确。
6、15
12)
12.在1200℃时,天然气脱硫工艺中会发生下列反应
则△H4的正确表达式为()
【解题指南】应用盖斯定律解答本题。
【解析】选A。
只需要把(+)×
2/3-×
2即可得到要求的反应热,故选项A正确。
8
13)
13.室温时,M(OH)2(S)M2+(aq)+2OH-(aq)Ksp=a,c(M2+)=bmol·
L-1时,溶液的pH等于()
A.B.C.D.
【解题指南】解答本题时应掌握溶度积常数的表示方法,会用水的离子积常数求溶液的pH。
由题知该反应的溶度积常数Ksp=c(M2+)·
c2(OH-)=a,由此得出c(OH-)=(a/b)1/2,则c(H+)=10-14÷
c(OH-),pH=—lgc(H+),经过计算即可得到正确答案为C。
17、19
26)
26.(15分)正丁醛是一种化工原料。
某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OHCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃
密度/(g·
cm-3)
水中溶解性
正丁醇
117.2
0.8109
微溶
正丁醛
75.7
0.8017
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。
在A中加入4.0g正丁醇和几粒沸石,加热。
当有蒸汽出现时,开始滴加B中溶液。
滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)加入沸石的作用是。
若加热后发现未加沸石,应采取的正确方法是。
(3)上述装置图中,B仪器的名称是,D仪器的名称是。
(4)分液漏斗使用前必须进行的操作是(填正确答案标号)。
a.润湿b.干燥c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)
(6)反应温度应保持在90—95。
C,其原因是。
(7)本实验中,正丁醛的产率为%。
【解题指南】解答本题需要根据题目中的相关信息进行分析解答,同时需要了解一些常见的实验操作,如蒸馏,会计算产物的产率。
【解析】
(1)将重铬酸钾溶液和浓硫酸混合时,相当于对浓硫酸进行稀释。
若将重铬酸钾溶液加到浓硫酸中,水的密度比浓硫酸小,会引起液滴飞溅,造成危险。
(2)实验装置中沸石的作用是防止溶液暴沸。
若加热后发现未加沸石,应该停止加热,等溶液冷却后再加入沸石。
(3)装置中B仪器叫滴液漏斗,D仪器叫直形冷凝器。
(4)分液漏斗使用前必须进行的操作是检查是否漏液。
(5)由题意知正丁醛微溶于水,密度比水小,所以分液时水在下层,正丁醛在上层。
(6)反应时温度保持在90—95℃,既可以保证正丁醛变成蒸汽及时分离出去,同时还可以避免正丁醛被继续氧化。
(7)若4.0g的正丁醇完全反应产生的正丁醛应为4÷
74×
72=3.89g,则正丁醛的产率应为2÷
3.89×
100%=51%。
【答案】
(1)不能,易迸溅;
(2)防止爆沸;
冷却后补加;
(3)滴液漏斗;
直形冷凝管;
(4)c;
(5)下;
(6)即可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)51。
1、3、
8、19
27)
27.(14分)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程如下:
提示:
在本实验条件下,Ni(Ⅱ)不能被氧化;
高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是,发生反应的离子方程式为;
在加高锰酸钾溶液前,若pH较低,对除杂的影响是。
(2)反应③的反应类型为,过滤得到的滤渣中,除了过量的锌外还有。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是。
(4)反应④中产物的成分可能是ZnCO3·
xZn(OH)2,取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于。
【解题指南】解答本题需要明确除杂的原则是在除去杂质的同时不能引入新的杂质,为了除去杂质,每一步加入的除杂试剂要适当过量,并尽可能生成更多的目标物质。
工业氧化锌中含有铁锰镍等杂质,第一步加入稀硫酸可以溶解氧化锌,同时让铁锰镍转化为金属阳离子;
第二步在浸出液中加入酸性高锰酸钾溶液,可以除去Fe2+和Mn2+,将它们转化为沉淀除去,此时滤液中剩余Zn2+和Ni2+;
第三步加入锌粉,可以置换出金属镍除去;
第四步向滤液中加入碳酸钠溶液可以将Zn2+转化为碳酸锌沉淀;
第五步将碳酸锌沉淀煅烧即可得到纯净的氧化锌固体。
(1)反应出去的杂质离子是Fe2+和Mn2+,发生反应的离子方程式为:
MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+,2MnO4-+3Mn2++2H2O=5MnO2↓+4H+
在加高锰酸钾之前,若溶液的pH较低,则铁离子和锰离子不能生成沉淀而除去。
(2)反应的反应类型是置换反应,过滤所得的滤渣中除了过量的锌外还有置换出来的金属镍。
(3)反应过滤出的沉淀在用蒸馏水洗涤后,若已经洗涤干净则滤液中不含碳酸根离子,因此只需要加入硝酸酸化的硝酸钡溶液即可检验沉淀是否洗涤干净。
(4)第五步煅烧发生反应的方程式为:
ZnCO3·
xZn(OH)2===(x+1)ZnO+CO2↑+xH2O
125+99x81(x+1)
11.2g8.1g
列比例式(125+99x)÷
[81(x+1)]=11.2÷
8.1,并解得x=1。
(1)Fe2+和Mn2+;
MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+;
2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)置换反应;
镍;
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 最新 新课 全国卷 解析 理科 综合 化学
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《巴黎圣母院》3000字读书心得范文.docx
《巴黎圣母院》3000字读书心得范文.docx
