 酸碱盐的溶解性表Word格式文档下载.docx
酸碱盐的溶解性表Word格式文档下载.docx
- 文档编号:14748377
- 上传时间:2022-10-24
- 格式:DOCX
- 页数:7
- 大小:18.04KB
酸碱盐的溶解性表Word格式文档下载.docx
《酸碱盐的溶解性表Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《酸碱盐的溶解性表Word格式文档下载.docx(7页珍藏版)》请在冰豆网上搜索。
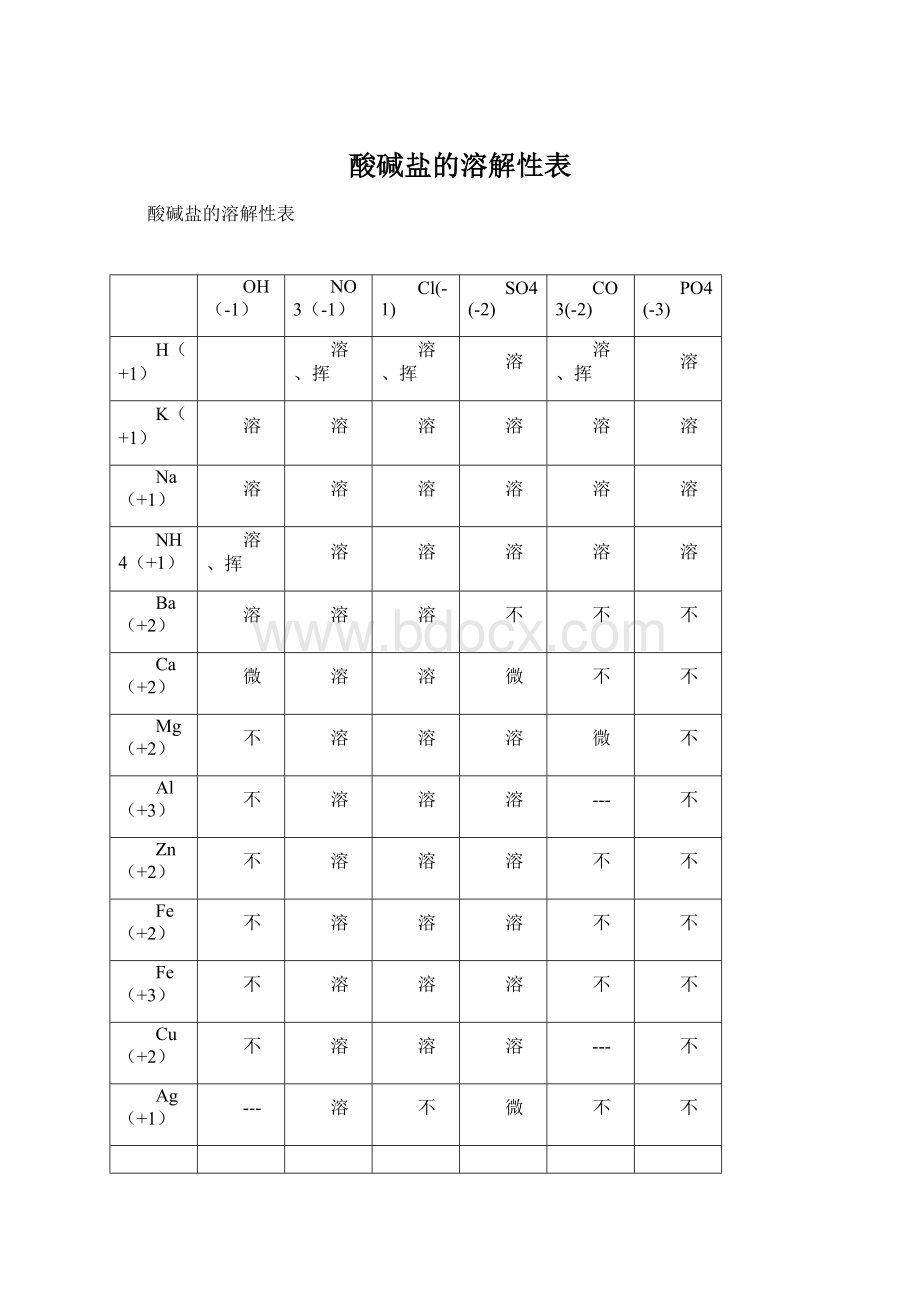
Fe(+3)
Cu(+2)
Ag(+1)
说明:
此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了
背诵口诀
1.钾钠铵盐都可溶,氯化物不溶氯化银
硫酸盐钙银微溶钡不溶
硝酸盐遇水影无踪
碳酸盐除钾钠铵都不溶
钾钠钡钙碱可溶
红褐铁,蓝絮铜
其它沉淀白色呈
注:
1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)
说明【】内为前一物质的特点
2.钾钠铵盐全都溶
碳酸除镁是微溶
其他全都不能溶
AgCl、BaSO4酸也不溶
磷酸盐,更不溶
一、氧气的性质:
(1)单质与氧气的反应:
(化合反应)
1.镁在空气中燃烧:
2Mg+O2点燃2MgO
2.铁在氧气中燃烧:
3Fe+2O2点燃Fe3O4
3.铜在空气中受热:
2Cu+O2加热2CuO
4.铝在空气中燃烧:
4Al+3O2点燃2Al2O3
5.氢气中空气中燃烧:
2H2+O2点燃2H2O
6.红磷在空气中燃烧(研究空气组成的实验):
4P+5O2点燃2P2O5
7.硫粉在空气中燃烧:
S+O2点燃SO2
8.碳在氧气中充分燃烧:
C+O2点燃CO2
9.碳在氧气中不充分燃烧:
2C+O2点燃2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:
2CO+O2点燃2CO2
11.甲烷在空气中燃烧:
CH4+2O2点燃CO2+2H2O
12.酒精在空气中燃烧:
C2H5OH+3O2点燃2CO2+3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验2HgO加热Hg+O2↑
14.加热高锰酸钾:
2KMnO4加热K2MnO4+MnO2+O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应:
H2O2MnO22H2O+O2↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):
2H2O通电2H2↑+O2↑
17.生石灰溶于水:
CaO+H2O==Ca(OH)2
18.二氧化碳可溶于水:
H2O+CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:
20.铁和硫酸铜溶液反应:
Fe+CuSO4===FeSO4+Cu
21.氢气还原氧化铜:
H2+CuO加热Cu+H2O
22.镁还原氧化铜:
Mg+CuO加热Cu+MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23.碳在氧气中充分燃烧:
24.木炭还原氧化铜:
C+2CuO高温2Cu+CO2↑
25.焦炭还原氧化铁:
3C+2Fe2O3高温4Fe+3CO2↑
(2)煤炉中发生的三个反应:
(几个化合反应)
26.煤炉的底层:
27.煤炉的中层:
CO2+C高温2CO
28.煤炉的上部蓝色火焰的产生:
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3+2HCl==CaCl2+H2O+CO2↑
30.碳酸不稳定而分解:
H2CO3==H2O+CO2↑
31.二氧化碳可溶于水:
H2O+CO2==H2CO3
32.高温煅烧石灰石(工业制二氧化碳):
CaCO3高温CaO+CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2+CO2===CaCO3↓+H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:
CO+CuO加热Cu+CO2
35.一氧化碳的可燃性:
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3+2HCl==2NaCl+H2O+CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:
38.酒精在空气中燃烧:
39.氢气中空气中燃烧:
六、金属
(1)金属与氧气反应:
40.镁在空气中燃烧:
41.铁在氧气中燃烧:
42.铜在空气中受热:
43.铝在空气中形成氧化膜:
4Al+3O2=2Al2O3
(2)金属单质+酸--------盐+氢气(置换反应)
44.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑
45.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑
46.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑
47.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑
48.锌和稀盐酸Zn+2HCl==ZnCl2+H2↑
49.铁和稀盐酸Fe+2HCl==FeCl2+H2↑
50.镁和稀盐酸Mg+2HCl==MgCl2+H2↑
51.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑
(3)金属单质+盐(溶液)-------新金属+新盐
52.铁和硫酸铜溶液反应:
Fe+CuSO4==FeSO4+Cu
53.锌和硫酸铜溶液反应:
Zn+CuSO4==ZnSO4+Cu
54.铜和硝酸汞溶液反应:
Cu+Hg(NO3)2==Cu(NO3)2+Hg
(3)金属铁的治炼原理:
55.3CO+2Fe2O3高温4Fe+3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸+金属--------盐+氢气(见上)
(2)酸+金属氧化物--------盐+水
56.氧化铁和稀盐酸反应:
Fe2O3+6HCl==2FeCl3+3H2O
57.氧化铁和稀硫酸反应:
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
58.氧化铜和稀盐酸反应:
CuO+2HCl==CuCl2+H2O
59.氧化铜和稀硫酸反应:
CuO+H2SO4==CuSO4+H2O
(3)酸+碱--------盐+水(中和反应)
60.盐酸和烧碱起反应:
HCl+NaOH==NaCl+H2O
61.盐酸和氢氧化钙反应:
2HCl+Ca(OH)2==CaCl2+2H2O
62.氢氧化铝药物治疗胃酸过多:
3HCl+Al(OH)3==AlCl3+3H2O
63.硫酸和烧碱反应:
H2SO4+2NaOH==Na2SO4+2H2O
(4)酸+盐--------另一种酸+另一种盐
64.大理石与稀盐酸反应:
65.碳酸钠与稀盐酸反应:
Na2CO3+2HCl==2NaCl+H2O+CO2↑
66.碳酸氢钠与稀盐酸反应:
NaHCO3+HCl==NaCl+H2O+CO2↑
67.硫酸和氯化钡溶液反应:
H2SO4+BaCl2==BaSO4↓+2HCl
2、碱的化学性质
(1)碱+非金属氧化物--------盐+水
68.苛性钠暴露在空气中变质:
2NaOH+CO2==Na2CO3+H2O
69.苛性钠吸收二氧化硫气体:
2NaOH+SO2==Na2SO3+H2O
70.苛性钠吸收三氧化硫气体:
2NaOH+SO3==Na2SO4+H2O
71.消石灰放在空气中变质:
Ca(OH)2+CO2==CaCO3↓+H2O
72.消石灰吸收二氧化硫:
Ca(OH)2+SO2==CaSO3↓+H2O
(2)碱+酸--------盐+水(中和反应,方程式见上)
(3)碱+盐--------另一种碱+另一种盐
73.氢氧化钙与碳酸钠:
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
3、盐的化学性质
(1)盐(溶液)+金属单质-------另一种金属+另一种盐
74.铁和硫酸铜溶液反应:
(2)盐+酸--------另一种酸+另一种盐
75.碳酸钠与稀盐酸反应:
碳酸氢钠与稀盐酸反应:
(3)盐+碱--------另一种碱+另一种盐
76.氢氧化钙与碳酸钠:
(4)盐+盐-----两种新盐
77.氯化钠溶液和硝酸银溶液:
NaCl+AgNO3==AgCl↓+NaNO3
78.硫酸钠和氯化钡:
Na2SO4+BaCl2==BaSO4↓+2NaCl
钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶BaSO4,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
●溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④
注:
①钾钠铵盐都溶于水;
②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;
③硝酸盐都溶于水;
④口诀中没有涉及的盐类都不溶于水;
溶解性口诀二钾、钠、铵盐、硝酸盐;
氯化物除银、亚汞;
硫酸盐除钡和铅;
碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶
溶解性口诀四钾、钠、硝酸溶,
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 酸碱 溶解性
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 (完整word版)信息论与编码期末考试题----学生复习用.doc
(完整word版)信息论与编码期末考试题----学生复习用.doc
 (完整版)固定资产盘点表.xls
(完整版)固定资产盘点表.xls
