 化学能与电能练习题Word文档下载推荐.doc
化学能与电能练习题Word文档下载推荐.doc
- 文档编号:14711406
- 上传时间:2022-10-24
- 格式:DOC
- 页数:4
- 大小:237.50KB
化学能与电能练习题Word文档下载推荐.doc
《化学能与电能练习题Word文档下载推荐.doc》由会员分享,可在线阅读,更多相关《化学能与电能练习题Word文档下载推荐.doc(4页珍藏版)》请在冰豆网上搜索。
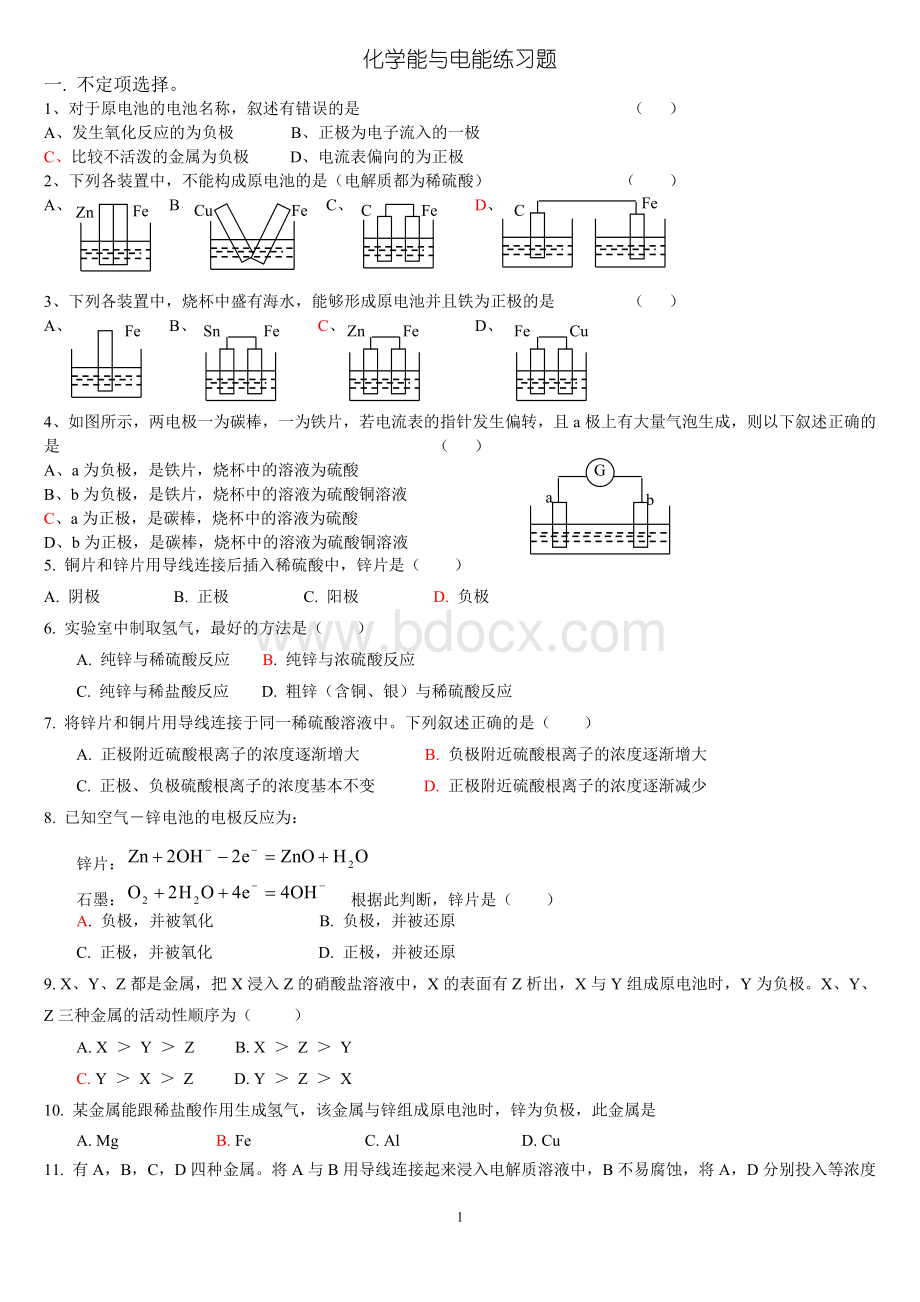
A、a为负极,是铁片,烧杯中的溶液为硫酸G
b
B、b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C、a为正极,是碳棒,烧杯中的溶液为硫酸
D、b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
5.铜片和锌片用导线连接后插入稀硫酸中,锌片是()
A.阴极 B.正极 C.阳极 D.负极
6.实验室中制取氢气,最好的方法是()
A.纯锌与稀硫酸反应B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应D.粗锌(含铜、银)与稀硫酸反应
7.将锌片和铜片用导线连接于同一稀硫酸溶液中。
下列叙述正确的是()
A.正极附近硫酸根离子的浓度逐渐增大B.负极附近硫酸根离子的浓度逐渐增大
C.正极、负极硫酸根离子的浓度基本不变D.正极附近硫酸根离子的浓度逐渐减少
8.已知空气-锌电池的电极反应为:
锌片:
石墨:
根据此判断,锌片是()
A.负极,并被氧化B.负极,并被还原
C.正极,并被氧化D.正极,并被还原
9.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。
X、Y、Z三种金属的活动性顺序为()
A.X>Y>ZB.X>Z>Y
C.Y>X>ZD.Y>Z>X
10.某金属能跟稀盐酸作用生成氢气,该金属与锌组成原电池时,锌为负极,此金属是
A.MgB.FeC.AlD.Cu
11.有A,B,C,D四种金属。
将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A,D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显变化,若将铜浸入C的盐溶液中,有金属C析出。
据此判断这四种金属的活动性由强到弱的顺序是()
A.D>
C>
A>
BB.D>
B>
CC.D>
CD.B>
D>
12.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是
A
B
D
正极
Ag
负极
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
13.如下图所示,电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。
则A、B、C分别为()
A.A是Zn,B是Cu,C是稀硫酸 B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液D.A是Ag,B是Fe,C是稀AgNO3溶液
14.对于锌—铜—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是()
①锌片溶解了32.5g ②锌片增重32.5g
③铜片上析出lgH2 ④铜片上析出1molH2
A.①和③B.①和④C.②和③D.②和④
15、关于如图所示装置的叙述,正确的是()
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原(05上海高考题)
16.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢(06上海高考题)
17.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中
的氧气与铝反应产生电流。
电池总反应为:
4A1+3O2+6H2O==4A1(OH)3,
下列说法不正确的是(06年江苏高考题)
A.正极反应式为:
O2+2H2O+4e==40H-B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积D.该电池通常只需更换铝板就可继续使用
18.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li+MnO2=LiMnO2,下列说法正确的是
A.Li是正极,电极反应为Li-e-=Li+B.Li是负极,电极反应为Li-e-=Li+
C.Li是负极,电极反应为MnO2+e-=MnO2D.Li是负极,电极反应为Li-2e-=Li2+
19.(06年广东高考题)某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。
放电时的电池反应为:
Li++LiMn2O4=Li2Mn2O4。
下列说法正确的是
A.放电时,LiMn2O4发生氧化反应B、放电时,正极的反应式为:
Li+LiMn2O4+e-=Li2Mn2O4
B.充电时,LiMn2O4发生氧化反应D、充电时,阳极的反应为:
Li+e-=Li
20.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH-D.Fe3++e-=Fe2+
21.某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是
A.
B.
C.
D.
正极
负极
ZnCl2
22.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化为电能的装置。
电解质溶液是强碱溶液。
下列关于甲烷的燃料电池说法中正确的为
A.负极反应:
O2+2H2O+4e-=4OH-B.随着放电进行,溶液的pH值增大
C.负极反应:
CH4+10OH--8e-=CO32-+7H2OD.放电时溶液中的阴离子向负极移动
23.下列说法正确的是
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀。
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀。
C.钢铁电化腐蚀的两种类型主要区别在于水膜的pH不同,引起正极反应不同。
D.无论哪种类型的腐蚀,其实质都是金属被氧化。
24、等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是()
t
V
A、B、C、D、
25、下列化学电池不易造成环境污染的是()
A、锂电池B、锌锰电池C、镍镉电池D、氢氧燃料电池
26、用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是()
A、加热B、不用稀硫酸,改用98%浓硫酸
C、滴加少量CuSO4溶液D、不用铁片,改用铁粉
二.填空题。
1、在铜锌硫酸原电池中,锌为极,电子,电极发生的是反应(填氧化或还原),电极反应式为;
铜为极,电子,电极发生的是反应,电极反应式为,铜片上观察到的现象为。
2、利用Fe+CuSO4=Cu+FeSO4设计一个原电池。
画出实验装置图。
并指出:
正极为,电极反应:
;
负极为,电极反应:
。
3.我国首创以铝─空气─海水电池为能源的新型海水标志灯。
该灯以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。
只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20─50倍,请回答:
该电源负极材料是____________,正极材料可以用_________;
正极反应:
_______________________,负极反应:
_________________________。
4.市场上出售的“热敷袋”其主要成分是铁屑、炭粉、木屑和少量氯化钠、水等。
“热敷袋”启用之前用塑料袋使其与空气隔绝;
启用时,打开塑料袋轻轻揉搓就会放出热量。
使用完后,会发现有大量铁锈存在。
请回答下列问题:
(1)“热敷袋”放出的热量是利用了铁放出的热量;
(2)炭粉的主要作用是;
(3)加入氯化钠的主要作用是;
(4)试写出有关的电极反应式和化学方程式
5.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。
氢氧燃料电池有酸式和碱式两种,它们放电时的电池反应总式都表示为:
2H2+O2=2H2O。
酸式氢氧燃料电池的电解质是酸,其负极反应可表示为:
2H2-4e=4H+,则其正极反应表示为;
碱式氢氧燃料电池的电解质是碱,其正极反应表示为
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 化学能 电能 练习题
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 保育笔记.doc
保育笔记.doc
 幼儿园日常安全检查记录表.xls
幼儿园日常安全检查记录表.xls
 企业管理创新【精选-PPT】.ppt
企业管理创新【精选-PPT】.ppt
