 化学反应速率知识点及练习Word文档格式.doc
化学反应速率知识点及练习Word文档格式.doc
- 文档编号:14709739
- 上传时间:2022-10-24
- 格式:DOC
- 页数:8
- 大小:130.50KB
化学反应速率知识点及练习Word文档格式.doc
《化学反应速率知识点及练习Word文档格式.doc》由会员分享,可在线阅读,更多相关《化学反应速率知识点及练习Word文档格式.doc(8页珍藏版)》请在冰豆网上搜索。
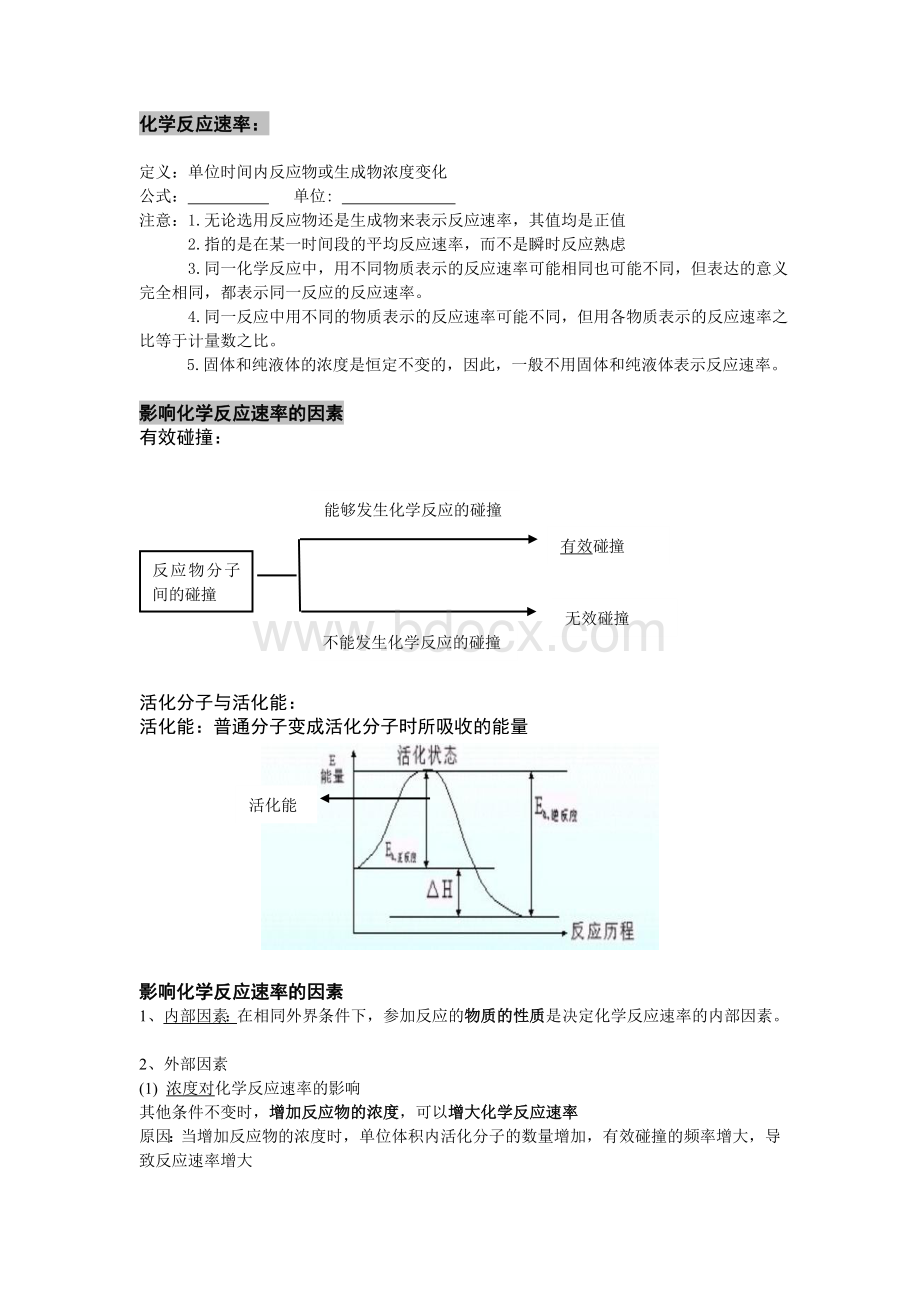
活化分子与活化能:
活化能:
普通分子变成活化分子时所吸收的能量
活化能
影响化学反应速率的因素
1、内部因素:
在相同外界条件下,参加反应的物质的性质是决定化学反应速率的内部因素。
2、外部因素
(1)浓度对化学反应速率的影响
其他条件不变时,增加反应物的浓度,可以增大化学反应速率
原因:
当增加反应物的浓度时,单位体积内活化分子的数量增加,有效碰撞的频率增大,导致反应速率增大
(2)固体反应物的表面积:
有固体参加的反应,固体的表面积越大,固体在同一时间内与其他反应物的接触越多,化学反应速率越快。
(3)反应物状态:
通常气相或液相反应比固相反应的反应速率大。
(4)压强对化学反应速率的影响
结论:
对于有气体参加的反应,当其他条件不变时,压强增大,看浓度是否增大,也就是压强对反应速率的影响是通过改变浓度而影响反应速率的
压强增加的两种方法:
,
A.减小体积。
这就是说,如果气体的压强增大到原来的2倍,气体的体积就缩小到原来的一半,单位体积内的分子数就增多到原来的2倍,即体系中各个物质的浓度都增加,所以化学反应速率增大。
相反,减小压强,气体的体积就扩大,浓度减小,因而反应速率减小。
B、充入惰性气体。
压强增大,但物质的浓度并没有变化所以对反应速率没影响。
如果参加反应的物质是固体、液体或溶液时,由于改变压强对它们的体积改变很小,因而它们的浓度改变也很小,可以认为压强与它们的反应速率无关。
(3)温度对化学反应速率的影响
在其他条件不变的条件下,温度越高化学反应速率越快
当反应物浓度一定时,分子总数一定,升高温度,反应物分子的能量增高,是活化分子的百分比增大,因而活化分子数量增多,有效碰撞频率增大,所以,反应速率加大。
(4)催化剂(catalyst)对化学反应速率的影响
在其他条件不变的条件下,催化剂能够改变化学反应速率。
催化剂改变化学反应速率的原因仅仅是改变始态到终态的途径,不改变反应的结果。
能加快化学反应速率的叫正催化剂;
能减慢化学反应速率的叫负催化剂。
练习
1.一般都能使反应速率加快的方法是()。
①升温;
②改变生成物浓度;
③增加反应物浓度;
④加压
(A)①②③(B)①③(C)②③(D)①②③④
2.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:
2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是()
(A)使用催化剂能加快反应速率
(B)改变压强对反应速率没有影响
(C)冬天气温低,反应速率降低,对人体危害更大
(D)无论外界条件怎样改变,均对此化学反应的速率无影响
3.设C+CO22CO-Q1,反应速率为υ1;
N2+3H22NH3+Q2,反应速率为υ2。
对于上述反应,当温度升高时,υ1和υ2的变化情况为()。
(A)同时增大(B)同时减小
(C)υ1增大,υ2减小(D)υ1减小,υ2 增大
5.煅烧硫铁矿产生二氧化硫,为了提高生成二氧化硫的速率,下列措施可行的是()。
(A)把块状矿石碾成粉末(B)向炉内喷吹氧气
(C)使用Fe2O3作催化剂(D)降低体系的温度
6.在密闭容器中发生2SO2+O22SO3反应,现控制下列三种不同的条件:
①在400℃时,10molSO2与5molO2反应;
②在400℃时,20molSO2与5molO2反应;
③在300℃时,10molSO2与5molO2反应;
问:
开始时,正反应速率最快的是____②_;
正反应速率最慢的是_③__。
专题
认识化学反应速率
例1下列有关化学反应速率的说法正确的是()
A对任何化学反应来说,反应速率越大,反应现象就越明显
B化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C化学反应速率为0.8mol/(L·
S)是指反应1s时某物质的浓度为0.8mol/L
D化学反应速率是用来衡量化学反应进行快慢的物理量
2.在一定温度和一定容积的容器中进行反应2HI
H2+I2,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需要的反应时间为( )
A.等于18sB.等于12sC.大于18sD.小于18s
3.反应2SO2+O2催化剂
△
2SO3,经一段时间后,SO3的浓度增加了0.4mol/L,在这段
时间内用O2表示的反应速率为0.04mol/(L·
s),则这段时间为( )
A.0.1sB.2.5sC.5sD.10s
4.温度不变恒容的容器中进行反应H22H,若反应物浓度由0.1mol·
L-1降到0.06mol·
L-1需20s,那么由0.06mol·
L-1降到0.036mol·
L-1所需反应时间应为()
A.等于10s B.等于12s C.大于12s D.小于12s
化学反应速率的计算
1直接利用公式v(A)==计算
2根据各物质的反应速率之比等于计量数之比计算
对于反应mA(g)+nB(g)pC(g)+qD(g)来说,则有
3三段式
例2、在N2+3H22NH3反应中,自开始至2秒,氨的浓度由0变为0.6mol/L,则以氨气表示的化学反应速率是多少?
例3、反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率()
A、ν(NH3)=0.0101mol.L-1.s-1B、ν(O2)=0.0010mol.L-1.s-1
C、ν(NO)=0.0010mol.L-1.s-1D、ν(H2O)=0.045mol.L-1.s-1
例4、合成NH3的反应为N2+3H22NH3。
现在某2L的容器中充入2mol的N2和5mol的H2。
反应5分钟后,容器中的N2的物质的量减少为1mol。
试求:
(1)5分钟后,容器中H2和NH3的物质的量。
(2)5分钟内三者的反应速率各是多少?
(3)三者速率是否相等
N2+3H22NH3
反应前2mol5mol0mol
变化1mol3mol2mol
反应后1mol2mol2mol
(2)v(N2)==0.1mol/L·
min
v(H2)==0.3mol/L·
v(NH3)==0.2mol/L·
v(N2):
v(H2):
v(NH3)==1:
3:
2
化学反应速率大小的比较
1、定性比较:
通过明显的实验现象如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需要的时间。
如钾与水反应比钠和水反应剧烈,即反应速率:
钾〉钠
2、定量比较
比较化学反应速率的大小,具体比较方法:
(1)化学反应速率的单位需统一
(2)转化成同一物质的反应速率
(3)数值越大表示反应速率越大
例5、在四个不同的容器中,在不同条件下进行反应:
N2+3H22NH3据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A、ν(H2)=0.1mol/(L.min)B、ν(N2)=0.1mol/(L.min)
C、ν(NH3)=0.3mol/(L.min)D、ν(H2)=0.01mol/(L.s)
外界条件对化学反应速率的影响:
例6、对于反应:
A+B=C
,下列条件的改变一定能使化学反应速率加快的是
A.增加A的物质的量 B.升高体系的温度
C.增加体系的压强 D.减少c的物质的量
图形分析
定性分析
随反应的进行,化学反应速率的变化曲线。
如图中是镁和盐酸的反应,AB段上升的原因是:
金属与酸的反应是放热反应,温度升高反应速率升高BC段下降得原因:
随着反应的进行酸的浓度降低,反应速率降低
定量分析
例7.在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示。
反应在t时刻达到平衡,据图回答下列问题:
(1)该反应的化学方程式是________________。
(2)反应起始至t,Y的平均反应速率是__________________。
(3)X的转化率是________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻,正反应速率等于逆反应速率
D.在t时刻,达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
一、专题过关
1.某温度下,反应堆2N2O5===4NO2+O2开始进行时,[N2O5]==0.0408mol/L,经6秒后测得[N2O5]==0.030mol/L,则该反应的速率为
A.v(N2O5)==1.08×
10-3mol/L·
s
B.v(O2)==2v(N2O5)
C.v(N2O5)==1.8×
s
D.v(NO2)==3.6×
s
2.反应3A(g)+B(g)==2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:
①vA==1mol/L·
min②vC==0.5mol/L·
min③vB==0.5mol/L·
min,三种情况下该反应速率大小的关系正确的是
A.③>①>② B.③>②>①
C.①>②>③ D. ②>①>③
3.在合成氨的反应中N2+3H2===2NH3
起始浓度(mol/L)130.1
已知,v(H2)==0.3mol/L·
min,求3分钟后氨气的浓度.
4.将3molA和2.5molB混合于容积为2L的密闭容器中,使其发生如下反应:
3A(g)+B(g)====xC(g)+2D(g
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 化学反应 速率 知识点 练习
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 保育笔记.doc
保育笔记.doc
 幼儿园日常安全检查记录表.xls
幼儿园日常安全检查记录表.xls
