 高考化学二轮专题复习第二编专题六金属及其化合物讲练新人教版Word文件下载.docx
高考化学二轮专题复习第二编专题六金属及其化合物讲练新人教版Word文件下载.docx
- 文档编号:14371662
- 上传时间:2022-10-22
- 格式:DOCX
- 页数:37
- 大小:328.60KB
高考化学二轮专题复习第二编专题六金属及其化合物讲练新人教版Word文件下载.docx
《高考化学二轮专题复习第二编专题六金属及其化合物讲练新人教版Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学二轮专题复习第二编专题六金属及其化合物讲练新人教版Word文件下载.docx(37页珍藏版)》请在冰豆网上搜索。
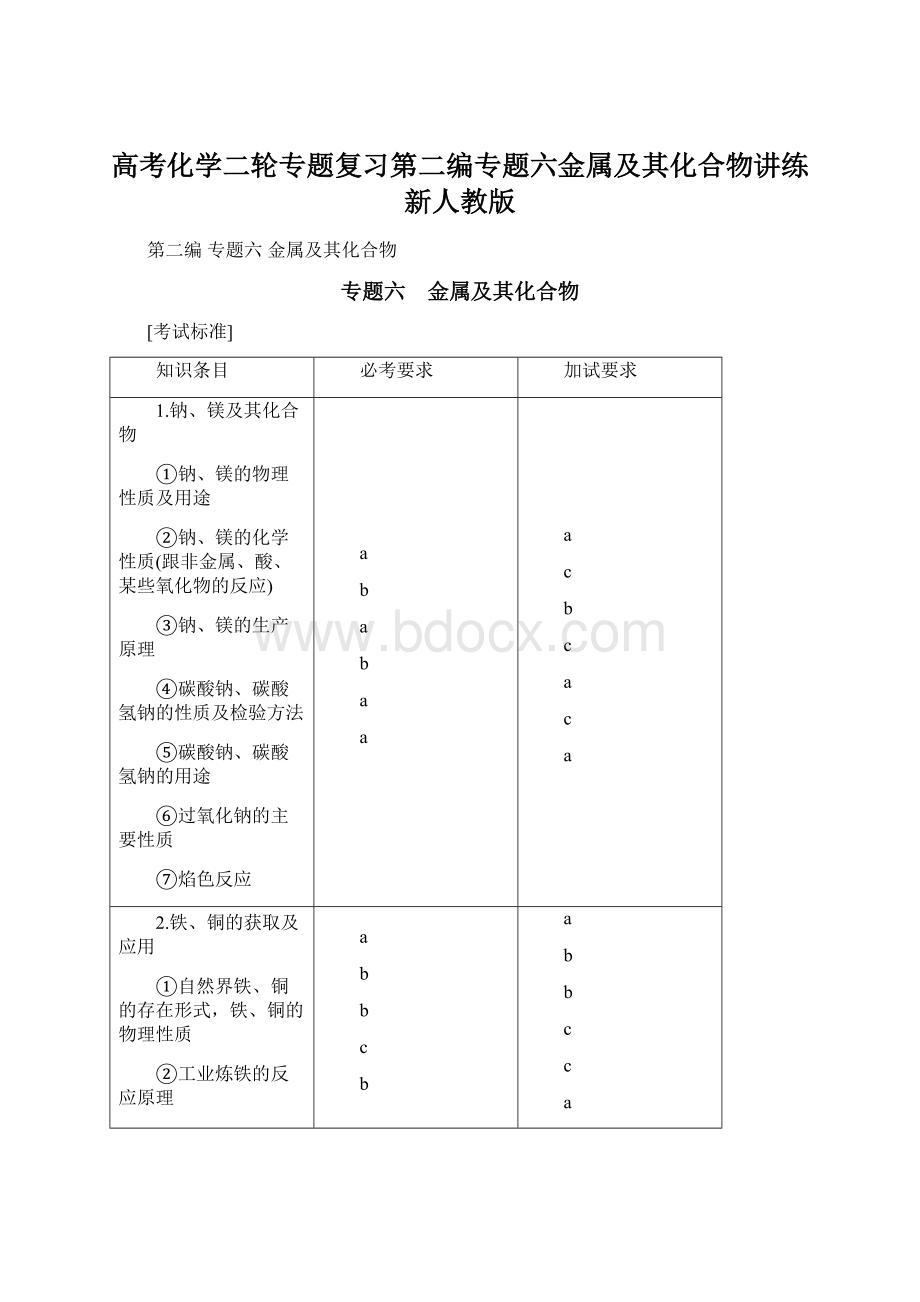
a
b
c
2.铁、铜的获取及应用
①自然界铁、铜的存在形式,铁、铜的物理性质
②工业炼铁的反应原理
③铁、铜的化学性质(跟某些非金属、酸、盐的反应)
④Fe2+、Fe3+的性质及转化
⑤检验Fe2+、Fe3+的常用方法
⑥不锈钢的主要组成元素及其用途
考点一 钠及其重要化合物
1.树立物质转化思想
(1)理清知识主线
Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3
(2)形成网络构建
2.扫除易忘知识盲点
(1)钠和盐溶液反应,不能置换出盐中的金属,与熔融的盐反应才能置换出盐中的金属。
(2)无论Na与O2反应生成Na2O还是Na2O2,只要参与反应的Na的质量相等,则转移电子的物质的量一定相等,但得到Na2O2的质量大于Na2O的。
(3)Na分别与H2O和乙醇发生的反应均属于置换反应,二者现象明显不同,前者剧烈,后者缓慢。
(4)1molNa2O2参与反应转移电子的物质的量不一定为1mol,如Na2O2与SO2的反应转移电子应为2mol。
(加试)
(5)不能用Ca(OH)2鉴别Na2CO3和NaHCO3溶液,应选用CaCl2或BaCl2溶液。
(6)除去CO2中的HCl气体,应选用饱和的NaHCO3溶液。
(7)向饱和的Na2CO3溶液中通入过量CO2,有晶体析出。
(8)焰色反应是元素的性质,无论游离态还是化合态,均具有相同的焰色反应,它不是化学变化,在观察钾元素的焰色反应时,应通过蓝色的钴玻璃片。
(9)Na-K合金常温下呈液态,是原子反应堆的导热剂。
(10)碱金属的密度呈现增大的趋势,但K反常。
(11)Li和O2反应只生成Li2O;
NaH是离子化合物,是一种强还原剂。
Na2O、Na2O2阴阳离子个数比均为1∶2。
3.规范书写重要反应
(1)实验室怎样处理钠屑?
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。
(2)写出Na与CuSO4溶液反应的离子方程式。
2Na+2H2O+Cu2+===Cu(OH)2↓+H2↑+2Na+。
(3)怎样将Na2CO3溶液转化为NaOH溶液(用化学方程式表示)。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
(4)向NaOH、Na2CO3、NaHCO3溶液中逐滴加入盐酸,写出发生反应的离子方程式。
OH-+H+===H2O;
CO+H+===HCO、HCO+H+===H2O+CO2↑;
HCO+H+===H2O+CO2↑。
(5)怎样除去CO2中的SO2气体(用离子方程式表示)。
SO2+2HCO===2CO2↑+SO+H2O。
(6)怎样除去Na2CO3溶液中的NaHCO3(用离子方程式表示)。
HCO+OH-===CO+H2O。
(7)怎样除去NaHCO3溶液中的Na2CO3(用离子方程式表示)。
CO+H2O+CO2===2HCO。
(8)用化学方程式表示呼吸面具中产生O2的原理。
2Na2O2+2H2O===4NaOH+O2↑;
2Na2O2+2CO2===2Na2CO3+O2。
题组一 考查金属钠的性质
1.下列有关钠的叙述正确的是( )
A.2.3g钠与97.7g水反应后溶液中溶质的质量分数等于4%
B.钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜
C.因为钠比铁活泼,故将钠放入FeCl3溶液中有红褐色沉淀生成
D.钠在空气中的缓慢氧化与其在空气中点燃的产物都一样
答案 C
解析 根据反应方程式,2.3g钠与97.7g水反应生成4.0gNaOH,放出0.1g氢气,溶液的质量为99.9g,所以NaOH的质量分数大于4%,A项错误;
Na与H2O反应生成NaOH,NaOH再与Cu2+反应生成Cu(OH)2,因Na与H2O发生的反应是放热反应,可导致生成的Cu(OH)2表面部分分解为CuO(黑色)而非Cu,B项错误;
钠与FeCl3溶液反应,反应的化学方程式为2Na+2H2O===2NaOH+H2↑,3NaOH+FeCl3===Fe(OH)3↓+3NaCl,C项正确;
Na在空气中缓慢氧化生成Na2O,钠在空气中点燃或加热时生成淡黄色固体Na2O2,D项错误。
2.有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质。
实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。
仔细观察,回答下列问题:
(1)有关钠反应的现象:
______________________________________________________
________________________________________________________________________。
(2)大试管的溶液中出现的现象:
______________________________________________
(3)装置中液面的变化:
大试管内________;
长颈漏斗内________。
(4)写出钠与硫酸亚铁溶液反应的化学方程式:
__________________________________
答案
(1)有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全消失
(2)下层溶液出现白色絮状沉淀 (3)下降 上升 (4)2Na+FeSO4+2H2O===Na2SO4+Fe(OH)2↓+H2↑
解析
(1)金属Na与FeSO4溶液反应实质是Na先与水反应,使Na粒熔化成闪亮的小球,由于钠的密度小于水大于煤油,钠随气泡的生成而在两种液体界面处上下跳动。
(2)反应生成的NaOH与FeSO4反应生成白色絮状沉淀,溶液的颜色逐渐变浅。
(3)产生的H2使装置内压强增大,大试管内液面下降,长颈漏斗内液面上升。
(4)反应的化学方程式为2Na+FeSO4+2H2O===Na2SO4+Fe(OH)2↓+H2↑。
在探究金属钠与可溶性盐溶液反应时,要考虑:
题组二 考查碳酸钠、碳酸氢钠的性质
(一)Na2CO3、NaHCO3的鉴别及实验探究
3.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了下列四种不同的方法,其中不可行的是( )
A.分别加入1mol·
L-1的盐酸,看气泡产生的快慢
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水中,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液、做焰色反应实验,观察火焰的颜色
解析 A项,因K2CO3与盐酸反应分步进行,先生成碳酸氢钾,盐酸过量时才生成气体,可行;
B项,K2CO3受热不分解,NaHCO3受热分解产生CO2,可行;
C项,二者与Ba(OH)2溶液反应都产生白色沉淀BaCO3,不可行;
D项,钾的焰色为紫色(透过蓝色钴玻璃观察),钠的焰色为黄色,可行。
4.小明通过学习知道:
Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
【产生疑问】NaHCO3溶液也能与石灰水反应吗?
如果能反应,生成物可能是什么?
【进行实验】小明将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。
此白色沉淀是________;
为了进一步了解生成的含钠化合物有什么,继续探究:
【作出猜想】①只有NaOH ②有Na2CO3和NaOH
③________________________________________________________________________
【实验设计】步骤1:
取少量上述实验后的上层清液于试管中,再滴加足量的CaCl2溶液(中性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有________________________________________________________________________;
步骤2:
将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为_______________________________________________,
整个实验过程中无气泡产生,由此可知猜想②成立。
【拓展提高】若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为________________________________________________________________________
答案 【进行实验】CaCO3
【作出猜想】只有Na2CO3
【实验设计】Na2CO3 溶液先由无色变红色,然后红色变为无色
【拓展提高】Ca(OH)2+NaHCO3===CaCO3↓+NaOH+H2O
解析 因为题给信息:
Ca(HCO3)2能溶于水,而HCO能与OH-反应生成CO,故将NaHCO3溶液与石灰水混合后,产物除CaCO3外溶液中还可能有:
①Ca(OH)2过量时:
发生反应NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O;
②恰好反应时:
2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O;
③NaHCO3过量时,产物有CaCO3、Na2CO3,剩余的NaHCO3。
依据以上分析可猜想:
生成的含钠化合物只能有三种情况:
①NaOH、②Na2CO3和NaOH、③Na2CO3。
判断类别,用准性质,突破Na2CO3、NaHCO3的鉴别
(1)利用热稳定性不同
(2)利用和酸反应生成气体的速率不同(相同条件下)
(3)利用阴离子不同
(4)利用溶液的酸碱性不同
(二)有关碳酸盐、碳酸氢盐参与反应的定量计算
5.(2017·
浙江省金华十校联考高一上期末)有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
A.2∶1B.1∶1
C.1∶2D.4∶2
答案 B
解析 两个过程最终都得到NaCl,由原子守恒可知两过程消耗HCl的质量相等,故选B。
6.(2017·
宁波市十校高三9月联考)将可能混有NaOH的16.80gNaHCO3固体,在200℃条件下充分加热,排出反应产生的气体,得到固体的质量为bg。
(1)b的最小值为________。
(2)当b=________时,产物中水的质量最多。
答案
(1)10.60
(2)14.416
解析 考
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高考 化学 二轮 专题 复习 第二 金属 及其 化合物 新人
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《雷雨》中的蘩漪人物形象分析 1.docx
《雷雨》中的蘩漪人物形象分析 1.docx
