 配位化学讲义 第五章 配合物的电子光谱文档格式.docx
配位化学讲义 第五章 配合物的电子光谱文档格式.docx
- 文档编号:13445342
- 上传时间:2022-10-10
- 格式:DOCX
- 页数:19
- 大小:230.85KB
配位化学讲义 第五章 配合物的电子光谱文档格式.docx
《配位化学讲义 第五章 配合物的电子光谱文档格式.docx》由会员分享,可在线阅读,更多相关《配位化学讲义 第五章 配合物的电子光谱文档格式.docx(19页珍藏版)》请在冰豆网上搜索。
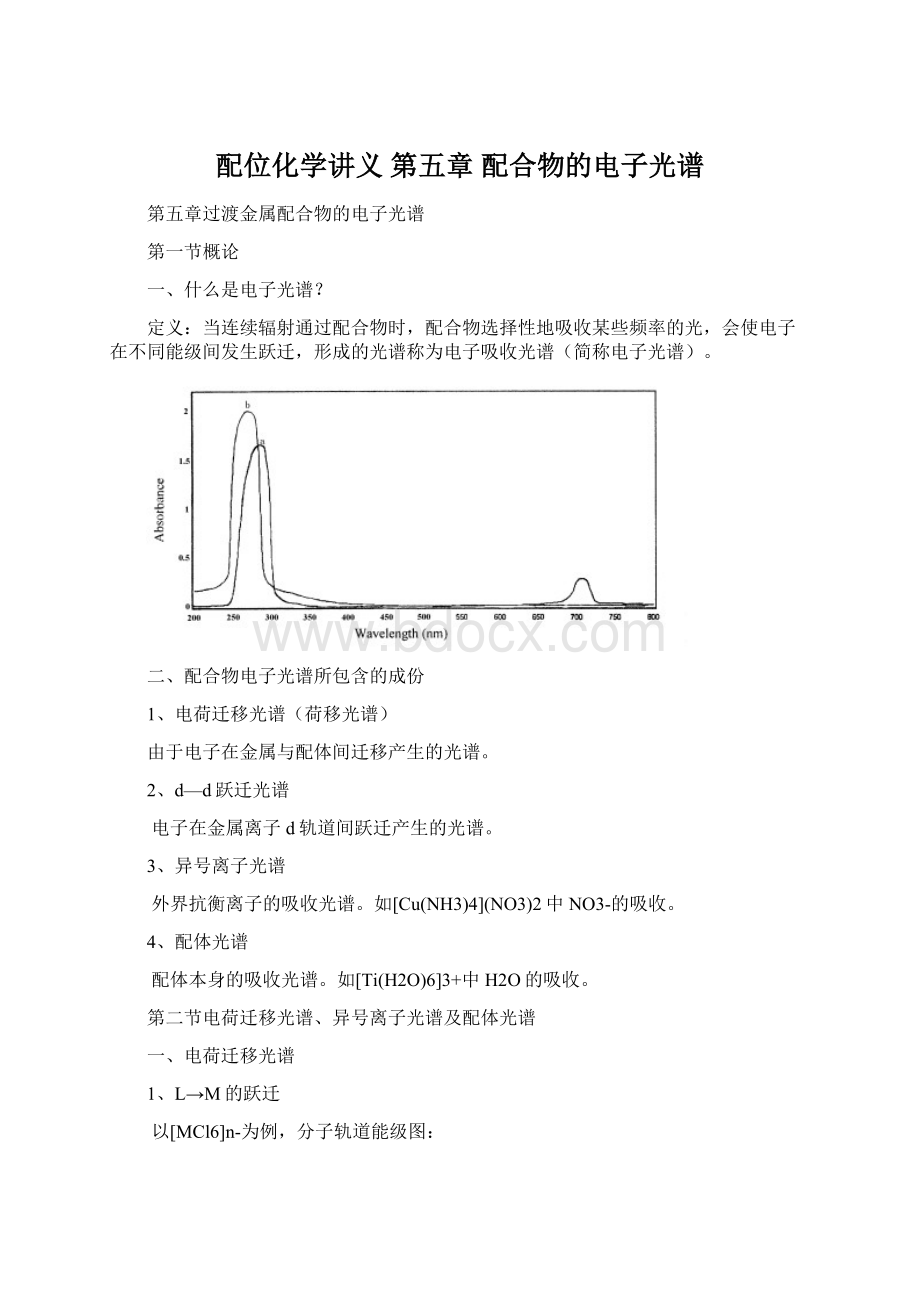
t2gt2gπ群轨道
eg
eg、t2g主要成份为配体轨道;
而t2g*、eg*主要成份为金属离子轨道。
四种跃迁:
ν1=t2gt2g*
ν2=t2geg*
ν3=egt2g*
ν4=egeg*
2、M→L的跃迁
t2g*
ν1
eg*eg*
Δoν2
t2g配体高能空轨道
t2g
t2g、eg*主要为金属离子轨道成份,而t2g*主要为配体轨道。
例:
[Co(CN)6]3-,M→L跃迁,ν1=49500cm-1
二、异号离子光谱
可分为三种情况:
1、在紫外区有吸收,如NO3—,NO2—;
2、在可见区有吸收,如CrO42—、MnO4—;
3、无吸收,如Cl—、SO42—、ClO4—。
由于ClO4—既无吸收,配位能力又差。
因此测定水合离子的光谱时,为防止水解现象,常加入HClO4。
如测定[Ti(H2O)6]3+的光谱时,若在HCl中进行,则吸收峰移向长波方向。
三、配体光谱
配体如水、有机分子通常在紫外区有吸收。
形成配合物后,这些谱带仍保留在配合物的光谱中,吸收峰位置有可能发生移动。
第三节d—d跃迁光谱
一、概论
不考虑d电子间相互作用时,d2组态的能态分析:
基态激发态1激发态2
二、d电子间相互作用(谱项与基谱项)
1、单电子运动的描述
运动:
自旋运动轨道运动
描述:
自旋角动量s轨道角动量l
│s│=[s(s+1)]1/2(h/2π)│l│=[l(l+1)]1/2(h/2π)
自旋角量子数s=1/2l—轨道角量子数
*矢量用黑体字母表示。
2、电子间相互作用
在多电子体系中,li与lj主要是通过电性相互作用;
而si与li或sj之间则主要通过磁性作用。
sisj
lilj
对轻元素(原子序数<
30),电子间偶合强于电子内偶合,即:
li——lj
si——sj的作用要大于si——li的作用。
此时电子间相互作用,可用L—S偶合方案处理:
ΣlL(总轨道角动量)
ΣsS(总自旋角动量)
即可用L、S描述多电子体系的状态。
│S│=[S(S+1)]1/2(h/2π)│L│=[L(L+1)]1/2(h/2π)
S——总自旋角量子数L——总轨道角量子数
如何求S、L见“物质结构”。
3、dn组态金属离子的谱项
多电子体系的能量状态可用谱项符号表示:
2S+1LL012345
符号SPDFGH
(2S+1)为谱项的自旋多重度。
如S=1/2,L=2时,为2D谱项。
组态谱项
d1d92D
d2d83F,3P,1G,1D,1S
d3d74F,4P,2H,2G,2F,2x2D,2P
d4d65D,3H,3G,2x3F,3D,2x3P,1I,2x1G,1F,2x1D,
2x1S
d56S,4G,4F,4D,4P,2I,2H,2x2G,2x2G,
2x2F,3x2D,2P,2S
*dn体系,不考虑电子间作用时,只有一种能量状态。
考虑电子间作用后,产生多个能量状态(谱项)。
d1体系除外,因其只含一个电子。
4、基态谱项
1)定义:
能量最低的谱项称为基态谱项(基谱项)。
1)如何确定基谱项?
A、同一电子组态的各谱项中,自旋多重度最大者能量最低。
B、在自旋多重度最大的各谱项中,轨道角量子数最大者能量最低。
例:
d2组态:
3F(基)、3P、1G、1D、1S
C、根据上述原则,可用下述方法求基谱项(对d轨道l=2):
轨道磁量子数(ml)LS基谱项
210-1-2(Σml)(Σms)2S+1L
d1↑21/22D
d2↑↑313F
d3↑↑↑33/24F
d4↑↑↑↑225D
d5↑↑↑↑↑05/26S
d6↑↓↑↑↑↑225D
d7↑↓↑↓↑↑↑33/24F
d8↑↓↑↓↑↓↑↑313F
d9↑↓↑↓↑↓↑↓↑21/22D
*ms=1/2(↑)、-1/2(↓)
5、光谱支项
三、自由离子谱项在配体场中的分裂
1、研究谱项分裂的两种方法
1)弱场方法
适用条件:
d电子间作用>
配体场与d电子的作用
方法:
先考虑电子间作用得到谱项;
再考虑配体场对电子的作用得到配体场谱项。
2)强场方法
d电子间作用<
先考虑配体场对电子的作用得到强场组态;
再考虑电子间作用得到配体场谱项。
2、弱场方法的处理
1)谱项分裂的两条规则
A、不论谱项由哪个dn组态产生,相同配体场,对给定L的谱项分裂后得到的配体场谱项的数目和类型是相同的。
B、如果忽略化学环境对电子自旋的影响,则一个谱项被配体场分裂后产生的配体场谱项与原谱项具有相同的自旋多重度。
2)用群论方法讨论谱项的分裂
由于单电子轨道波函数和谱项波函数在空间的分布状况分别依赖于量子数l和L,若L=l,则该谱项波函数在空间的分布状况类似于该单电子轨道波函数。
因此谱项波函数分裂的结果与单电子轨道波函数的分裂结果相同。
*下标g、u的用法:
A、单电子轨道波函数,如果配体场无对称中心,则不用这两个下标;
若有对称中心,则l为偶数的轨道(s、d、g)用下标g,l为奇数的轨道(p、f)用下标u。
B、对于谱项波函数,如果配体场无对称中心,则不用这两个下标;
若有对称中心,则用g或u,取决于产生这个谱项的电子组态中各个电子的单电子轨道波函数的本质。
我们感兴趣的来自dn组态的那些谱项,它们在中心对称场中全部是g特征状态。
单电子轨道波函数的分裂
轨道OhTdD4h
sa1ga1a1g
pt1ut1a2u+eu
deg+t2ge+t2a1g+b1g+b2g+eg
fa2u+t1u+t2ua2+t1+t2a2u+b1u+b2u+2eu
ga1g+eg+t1g+t2ga1+e+t1+t22a1g+a2g+b1g+b2g+2eg
heu+2t1u+t2ue+2t1+t2a1u+2a2u+b1u+b2u+3eu
ia1g+a2g+eg+t1g+2t2ga1+a2+e+t1+2t22a1g+a2g+2b1g+2b2g+3eg
d2组态谱项波函数分裂的结果
谱项OhTdD4h
1S1A1g1A11A1g
3P3T1g3T13A2g+3Eg
1D1Eg+1T2g1E+1T21A1g+1B1g+1B2g+1Eg
3F3A2g+3T1g+3T2g3A2+3T1+3T23A2g+3B1g+3B2g+23Eg
1G1A1g+1Eg+1T1g+1T2g1A1+1E+1T1+1T221A1g+1A2g+1B1g+1B2g+21Eg
3、d1-d9组态离子基谱项在八面体场中的分裂
由上述可见,dn与d10-n产生的谱项的密切对应关系,这种对应关系是电子与空穴互易的结果。
4、欧格尔(Orgel)图
1)定义:
确定配体场分裂的大小和各能级的顺序要做量子化学计算。
将计算出的结果以图表示,图的纵坐标为能量,横坐标为配体场强度,这种形式的图就是著名的Orgel图。
八面体场中d2金属离子的Orgel图如下:
在图的最左端Δo=0处,是自由离子的谱项。
这些谱项在配体场中,随配体场强度增大,分裂亦越来越大。
2)不相交规则
可以看出Orgel图中,有些线是直的,而有些是弯曲的。
其弯曲是由于相同标记的谱项相互排斥引起的。
不相交规则:
相同标记的谱项的能量变化曲线永不相交,而且相互排斥,即它们相互弯曲开来。
5、能量相关图
1)能量相关图
将配合物的弱场谱项与强场谱项间的关系用图表示,即得到能量相关图。
两条规则:
A、弱场谱项与强场谱项间存在一一对应关系。
这是因为在配体场强度变化的过程中,其对称性保持不变,因此每一种状态的数目必然是相同的;
B、配体场强度变化过程中,各配体场谱项的能量变化曲线遵守不相交规则。
以d2组态金属离子八面体配合物为例:
1S1A1g1A1g
1A1g1Egeg2
1G1Eg3A2g
1T2g1T2g
1T1g1T1g
3T2gt2g1eg1
3P3T1g3T1g
1Eg
1D1A1g
1T2g1Eg
t2g2
3A2g1T2g
3F3T2g3T1g
3T1g
谱项弱场谱项中等场强场谱项强场组态
2)强场谱项的推导
A、数目与类型
当d电子轨道分裂到最大限度时,有如下三种强场组态:
t2g2、t2g1eg1、eg2
当开始减小环境同离子间的作用,使电子感受到彼此之间相互作用时,它们开始偶合,产生了一组属于整个组态的状态,这些状态的对称性质决定于单电子表示的直积。
t2g2:
(t2g×
t2g)再约化为:
A1g+Eg+T1g+T2g
t2g1eg1:
(t2g×
eg)再约化为:
T1g+T2g
eg2:
(eg×
A1g+A2g+Eg
这些就是由电子间相互作用产生的轨道状态波函数的对称性。
B、自旋多重度
通过降低对称性将多维表示过渡到一维表示,先求出低对称性时状态的自旋多重度。
由于对称性降低后,自旋多重度保持不变,从而可由低对称性的自旋多重度推出高对称性时状态的自旋多重度。
Oh群的相关表
该表指出当对称性降低时,Oh群的表示如何改变或分解为它的子群表示。
OhTdD4hC4vD3C2h
A1gA1A1gA1A1Ag
A2gA2B1gB1A2Bg
EgEA1g+B1gA1+B1EAg+Bg
T1gT1A2g+EgA2+EA2+EAg+2Bg
T2gT2B2g+EgB2+EA1+E2Ag+Bg
A1uA2A1uA2A1Au
A2uA1B1uB2A2Bu
EuEA1u+B1uA2+B2EAu+Bu
T1uT2A2u+EuA1+EA2+EAu+2Bu
T2uT1B2u+EuB1+EA1+E2Au+Bu
将Oh对称性降低为D4h,表示均过渡到一维表示。
OhD4h
A1gA1g
A2gB1g
EgA1g+B1g
现在要求出D4h中各谱项的自旋多重度。
Oh中的eg二重简并轨道在D4h中解除简并:
OhD4h
a1g
eg
b1g
组态谱项(直积)可能的自旋多重度
a1g2A1g1A1g
a1g1b1g1B1g1B1g,,3B1g
b1g2A1g1A1g
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 配位化学讲义 第五章 配合物的电子光谱 化学 讲义 第五 配合 电子 光谱
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 转基因粮食的危害资料摘编Word下载.docx
转基因粮食的危害资料摘编Word下载.docx
