 A版版高考化学总复习专题四氧化还原反应学案文档格式.docx
A版版高考化学总复习专题四氧化还原反应学案文档格式.docx
- 文档编号:13362326
- 上传时间:2022-10-10
- 格式:DOCX
- 页数:30
- 大小:1.37MB
A版版高考化学总复习专题四氧化还原反应学案文档格式.docx
《A版版高考化学总复习专题四氧化还原反应学案文档格式.docx》由会员分享,可在线阅读,更多相关《A版版高考化学总复习专题四氧化还原反应学案文档格式.docx(30页珍藏版)》请在冰豆网上搜索。
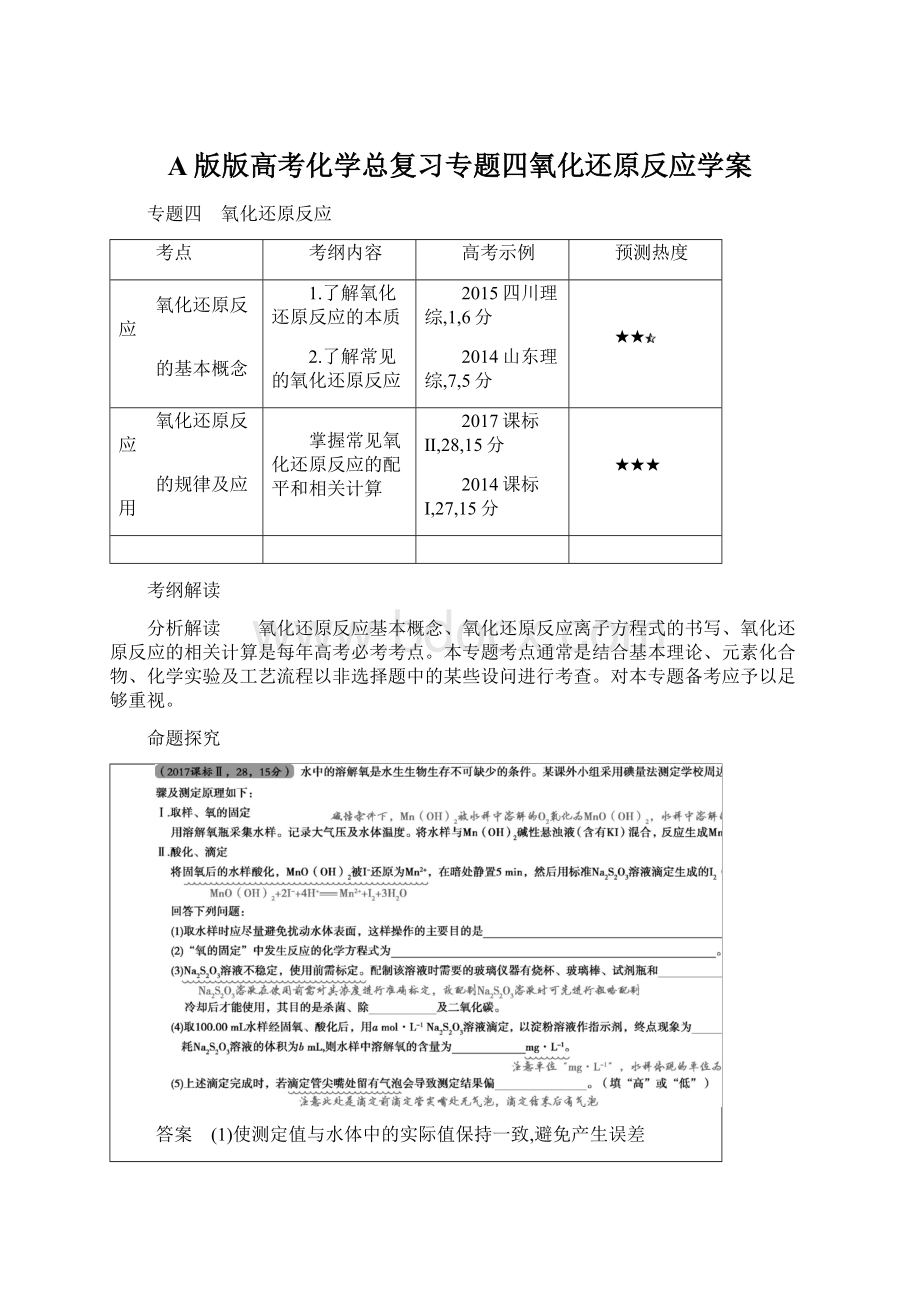
(2)O2+2Mn(OH)2
2MnO(OH)2
(3)量筒 氧气 (4)蓝色刚好褪去 80ab (5)低
核心考点
1.氧化还原反应方程式的书写 2.溶液的配制
3.氧化还原滴定实验的结果处理及误差分析
关联知识
1.
(OH)2
O(OH)2
2.气体溶解度随温度升高而降低
3.淀粉遇I2变蓝色
4.滴定实验终点判断
解题思路
(1)扰动水体表面会使水样中溶解氧逸出,使测定结果产生误差。
(2)反应中Mn(OH)2作还原剂,O2作氧化剂,依据得失电子守恒可知二者应按物质的量之比2∶1反应。
(3)配制Na2S2O3溶液时,若蒸馏水中含有溶解氧会导致后续滴定实验产生误差,故应除去蒸馏水中的溶解氧。
(4)由得失电子守恒可得关系式:
O2~2I2~4Na2S2O3,则100.00mL水样中含氧量为
mol,即8ab×
10-3g,1000mL(即1L)水样中含氧量为80abmg。
(5)滴定完成时,若滴定管尖嘴处留有气泡会导致代入计算式中Na2S2O3溶液的体积偏小,使测定结果偏低。
解题方法
发生多步反应时可根据得失电子守恒找总关系式:
O2~2Mn(OH)2~2I2~4Na2S2O3,从而可得关系式:
O2~4Na2S2O3,进行一步的计算。
知识储备
若某溶液使用前需对其浓度进行准确标定,则配制该溶液时可先称取所需量的溶质,用量筒量取一定体积的水,在烧杯中进行粗略配制,使用前再用对应的基准物质对其浓度进行准确标定。
设题技巧
本题以水中溶解氧的测定为背景,考查了化学实验基本操作、氧化还原反应方程式的书写、滴定终点的判断、实验结果的处理及误差分析等考点,紧密联系生活实际,试题难度中等。
命题特点
本专题命题方式通常是:
1.给出新情境,书写陌生的氧化还原反应方程式;
2.配平给定的氧化还原反应方程式;
3.根据已知条件计算反应转移的电子数或通过计算判断反应的氧化产物或还原产物;
4.结合生产、生活实际,对氧化还原反应基本概念进行考查。
本专题考点是高频考点之一。
五年高考
考点一 氧化还原反应的基本概念
1.(2017天津理综,3,6分)下列能量转化过程与氧化还原反应无关的是( )
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
答案 A
2.(2015四川理综,1,6分)下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂B.甘油作护肤保湿剂
C.漂粉精作消毒剂D.铁粉作食品袋内的脱氧剂
答案 D
3.(2014山东理综,7,5分)下表中对应关系正确的是( )
A
CH3CH3+Cl2
CH3CH2Cl+HCl
CH2
CH2+HCl
CH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br-
2Cl-+Br2
Zn+Cu2+
Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O
4NaOH+O2↑
Cl2+H2O
HCl+HClO
均为水作还原剂的氧化还原反应
答案 B
4.(2016天津理综,9,18分)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·
L-1。
我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg·
某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:
①2Mn2++O2+4OH-
2MnO(OH)2↓
酸性条件下,MnO(OH)2将I-氧化为I2:
②MnO(OH)2+I-+H+
Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2:
③2S2
+I2
S4
+2I-
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol·
L-1Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器是 。
①滴定管 ②注射器 ③量筒
(3)搅拌的作用是 。
(4)配平反应②的方程式,其化学计量数依次为 。
(5)步骤f为 。
(6)步骤e中达到滴定终点的标志为 。
若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO= mg·
L-1(保留一位小数)。
作为饮用水源,此次测得DO是否达标:
(填“是”或“否”)。
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差。
写出产生此误差的原因(用离子方程式表示,至少写出2个) 。
答案 (共18分)
(1)将溶剂水煮沸后冷却
(2)②
(3)使溶液混合均匀,快速完成反应
(4)1,2,4,1,1,3
(5)重复步骤e的操作2~3次
(6)溶液蓝色褪去(半分钟内不变色) 9.0 是
(7)2H++S2
S↓+SO2↑+H2O
SO2+I2+2H2O
4H++S
4H++4I-+O2
2I2+2H2O(任写其中2个)
5.(2014天津理综,9,18分)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·
5H2O
反应原理:
Na2SO3(aq)+S(s)
Na2S2O3(aq)
实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。
另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·
5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 。
检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:
。
Ⅱ.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·
L-1碘的标准溶液滴定。
反应原理为:
2S2
(5)滴定至终点时,溶液颜色的变化:
。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。
产品的纯度为(设Na2S2O3·
5H2O相对分子质量为M) 。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成S
常用作脱氯剂,该反应的离子方程式为 。
答案
(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)Na2SO4 取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)S2
+2H+
(5)由无色变蓝色
(6)18.10
×
100%
(7)S2
+4Cl2+5H2O
2S
+8Cl-+10H+
教师用书专用(6)
6.(2013天津理综,1,6分)运用有关概念判断下列叙述正确的是 ( )
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.
和
互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
考点二 氧化还原反应的规律及应用
1.(2014大纲全国,13,6分)已知:
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关。
当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后
=11,则溶液中
=
B.参加反应的氯气的物质的量等于
amol
C.改变温度,反应中转移电子的物质的量
的范围:
amol≤
≤
D.改变温度,产物中KClO3的最大理论产量为
2.(2015课标Ⅱ,28,15分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为
。
②溶液X中大量存在的阴离子有 。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用右图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000mol·
L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2
2I-+S4
),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。
在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为
。
②玻璃液封装置的作用是 。
③Ⅴ中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。
若要除去超标的亚氯酸盐,下列物质最适宜的是 (填标号)。
a.明矾 b.碘化钾
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高考 化学 复习 专题 氧化 还原 反应
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 国企会计岗位笔试试题及答案解析(分享).docx
国企会计岗位笔试试题及答案解析(分享).docx
 行政事业单位内部审计流程图(按照新内部审计准则).xls
行政事业单位内部审计流程图(按照新内部审计准则).xls
