 初中基本实验操作.docx
初中基本实验操作.docx
- 文档编号:10855441
- 上传时间:2023-02-23
- 格式:DOCX
- 页数:33
- 大小:282.74KB
初中基本实验操作.docx
《初中基本实验操作.docx》由会员分享,可在线阅读,更多相关《初中基本实验操作.docx(33页珍藏版)》请在冰豆网上搜索。
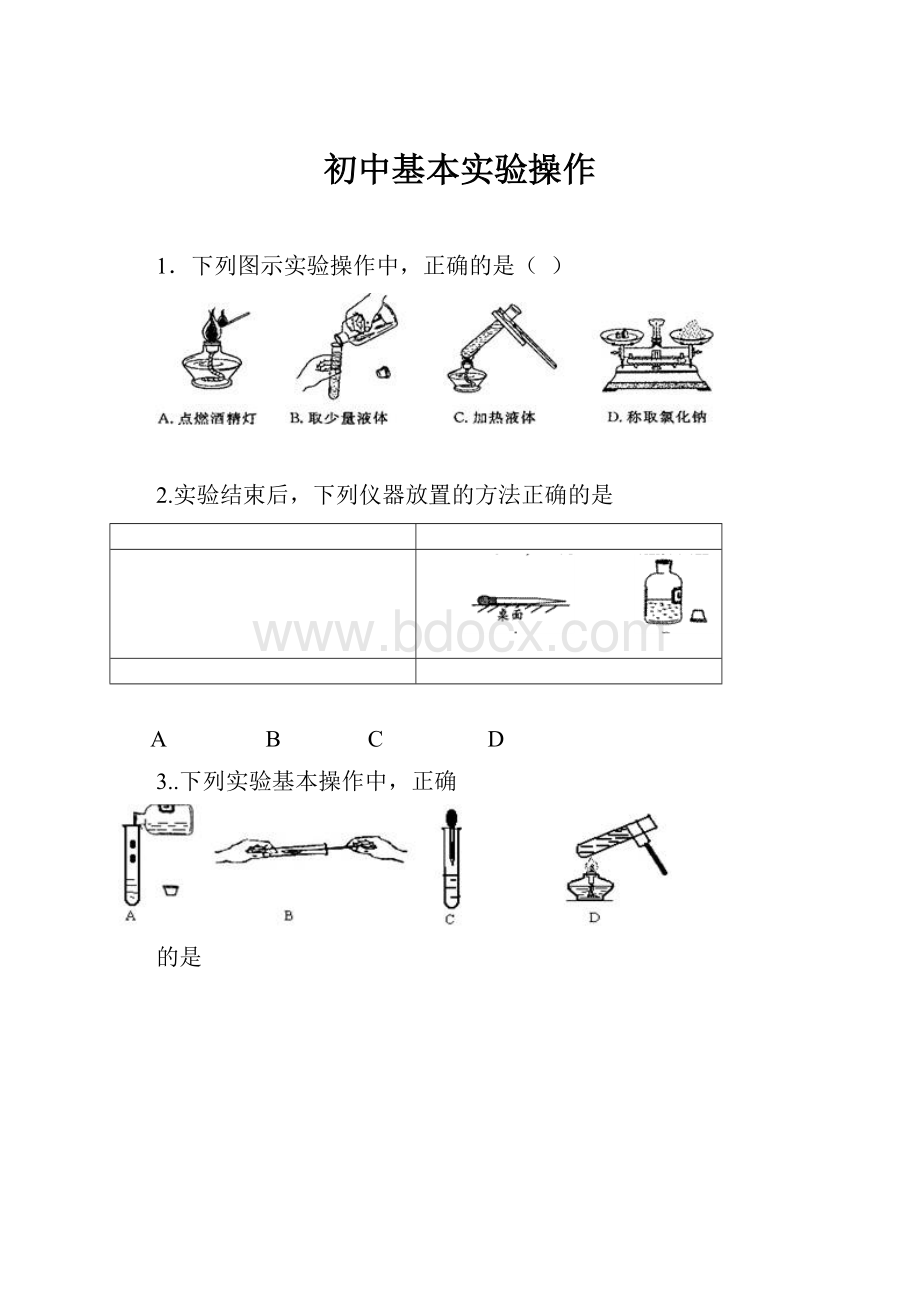
初中基本实验操作
1.下列图示实验操作中,正确的是( )
2.实验结束后,下列仪器放置的方法正确的是
A B C D
3..下列实验基本操作中,正确
的是
4·4下图所示实验操作正确的是( )
5.实验室中不能被加热的玻璃仪器是
A.试管 B.量筒 C.烧杯 D.锥形瓶
10.下列实验操作正确的是( )
11.实验操作不当的是 ( )
A.将烧碱放在已知质量的烧杯里用托盘天平称量
B.将试管夹从试管底部往上套,夹在试管的中上部
C.振荡试管时.用手紧握试管,拇指堵住试管口,上下晃动
D.滴加液体时,滴瓶滴管的尖端不能触及已加过其它试剂的试管内壁
“原子核外的电子排布教学设计方案
作者:
王雪(高中化学 甘平凉化学一班) 评论数/浏览数:
3/183 发表日期:
2012-07-1622:
02:
42
核外电子排布
一、学习目标
1.了解原子核外电子运动的特征。
2.初步掌握原子核外电子排布规律,会画1~18号元素原子结构示意图。
3.培养学生的观察能力、分析能力和抽象思维的能力。
二、教学重点及难点
重点:
知道原子核外电子是如何分层排布的。
难点:
原子核外电子排布规律间相互制约关系。
三、设计思路
教学中,首先引导学生观察1~18号元素的原子结构示意图,熟悉这些元素的原子核外电子排布情况,然后采用交流、讨论、归纳、总结的方法,探究原子核外电子的排布规律,得出以下规律:
1.电子总是尽量先排布在能量最低的电子层,然后排布在能量较高的电子层。
即电子总是尽量先排在内层。
2.随着核电荷数的增加,元素原子的最外层电子数逐步增加,每一电子层都容纳一定数目的电子。
3.再引导学生观察稀有气体的原子核外电子的排布情况,探究排布规律,通过分析讨论下列规律:
(1)各电子层最多容纳的电子数为2n2个(n为电子层序数)。
(2)各稀有气体元素的原子中最外层所容纳的电子数是8(氦除外)。
(3)各元素原子次外层所容纳的电子数最多是18。
四、教学内容
1.复习在初中阶段和必修一中学习过的知识,引入新课内容。
问题1:
世界是由什么构成的?
问题2:
物质是由什么构成的?
问题3:
原子是由什么构成的?
今天的这些简单问题却是困扰了人类几千年的深奥无比的问题,几千年的思考,几千年的知识积累,才给予我们今天如此的智慧!
——学会思考!
不断探索!
2.新知学习
经过几代科学家的不懈努力,现代量子力学原子结构模型(电子云模型)认为:
①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同③对于多电子的原子,电子在核外一定的空间近似于分层排布。
一、原子核外电子的分层排布
阅读课本图1-27几种原子的核外电子排布,初步理解多电子原子的核外电子排布。
(学生观察后小结)对于多电子原子,原子核外电子是分层排布的,原子的核外电子数越多,占据的电子层越多。
为了更形象简单地表示某种原子的核外电子排布,我们可以用“原子结构示意图”来表示原子的结构。
以Mg为例,结合板演分析讲解原子结构示意图的画法。
请同学们理解原子结构示意图的画法后结合图1-27画出氢、氦、氧、氩的原子结构示意图。
【交流与讨论】多电子原子核外电子的排布并不是杂乱无章的,而是有一定的规律,那么这个规律是什么呢?
我们一起来找找看。
观察分析稀有气体元素的原子核外电子排布,讨论核外电子排布的规律。
核电荷数
元素名称
元素符号
各电子层的电子数
K
L
M
N
O
P
最外层电子数
2
氦
He
2
2
10
氖
Ne
2
8
8
18
氩
Ar
2
8
8
8
36
氪
Kr
2
8
18
8
8
54
氙
Xe
2
8
18
18
8
8
86
氡
Rn
2
8
18
32
18
8
8
各层最多电子数
2
8
18
32
?
?
【结合学生回答板书】二、原子核外电子排布规律
1、能量最低原理:
电子总是尽先排布在能量最低的电子层里, 然后由往外,依次排在能量逐步升高的电子层里,即先排K层,排满K层后再排L层,排满L层后再排M层;
2、每个电子层最多只能容纳2n2个电子;
3、最外层最多只能容纳8个电子(K层为最外层时不能超过2个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
1~18号元素原子结构示意图,观察原子的最外层电子数与元素的性质有何联系?
【结合学生回答板书】三、原子结构与元素性质的关系(结构决定性质)
(1)稳定结构:
最外层电子数为8(注意:
He最外层为2),原子既不容易失去电子又不容易得到电子。
(2)不稳定结构:
最外层电子数不为8,因此可能失去电子或者得到电子转变为稳定结构——最外层为8(氢原子变为0或2)个电子
一般最外层电子数小于4个的多为金属,在化学反应中容易失电子;最外层电子数大于等于4个的多为非金属,在化学反应中容易得电子。
(在化学反应中发生电子得失时,原子核不发生变化)
以氧化镁的形成为例,介绍元素原子在化学反应中的得失电子情况。
【问题解决】理解元素化合价与其在反应中得失电子数目的关系,探究下列问题。
⑴金属钠、镁能分别与非金属单质氧气、氯气反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
Na2O、MgO、NaCl、MgCl2
⑵根据钠、镁、氧、氯原子在反应过程中失去或得到电子的数目及其最外层电子数目,推断其氧化物和氯化物中元素的化合价,完成表格1-6。
元素
化合价
原子最外层电子数目
失去(或得到)电子数目
Na
+1
1
失1e-
Mg
+2
2
失2e-
O
-2
6
得2e-
Cl
-1
7
得1e-
【板书】四、原子最外层电子数与元素化合价的关系
元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
原子 ①最外层电子数﹤4时,容易失去电子:
化合价=+失去的电子数目
②最外层电子数≥4时,容易得到电子:
化合价=最外层电子数-8
知识小结
初中化学:
核外电子排布规律
点击数:
3272次 录入时间:
2011/6/1114:
22:
00 编辑:
zhuofuyu
①每层最多排2n2个电子(n表示层数)
②最外层电子数不超过8个(最外层为第一层不超过2个)
③先排满内层再排外层
注:
元素的化学性质取决于最外层电子数
金属元素原子的最外层电子数<4,易失电子,化学性质活泼。
非金属元素原子的最外层电子数≥4,易得电子,化学性质活泼。
稀有气体元素原子的最外层有8个电子(He有2个),结构稳定,性质稳定。
嗨!
同学们,我是水分子,我的质量和体积都很小,一个水分子的质量约是3×10-26kg,在每一滴水中我们水分子大约有1.67×1021个水分子,我这么小,当然你们人类用肉眼是看不见我的。
如果用10亿人来数一滴水里的分子,每人每分钟数100个,日夜不停,需要数3万多年才能数完咧。
我想请你们猜一猜:
我们这么小,我们会运动吗?
当我们分子聚集在一起构成水时,彼此之间是否会存在空隙呢?
”二、深入剖析,明确概念
本单元涉及到分子、原子、离子、原子核、质子、中子、电子、元素、元素符号、元素周期表、相对原子质量、化合价、化学式、相对分子质量等多个概念,复习时要对每个概念进行深入剖析,逐个明确概念。
剖析概念中的每一个字词的含义及它们之间的关系,是明确概念的好办法。
例如,对于分子的概念,可作如下剖析:
⑴分子保持了物质所有的化学性质。
如氧分子保持了氧气所有的化学性质,氧分子和氧气的化学性质完全一样。
⑵分子不能保持物质的物理性质。
如水的密度是1克/毫升,但不能说水分子的密度也是1克/毫升。
⑶同种物质的分子性质相同。
如所有的二氧化碳分子的性质是完全一样的。
⑷不同种物质的分子性质各异。
如氮分子、一氧化碳分子、甲烷分子的性质各不相同。
⑸分子属于微观粒子,它可以再分,但分割以后的粒子不再保持原物质的化学性质。
如水分子在化学反应中可分割出氢、氧两种原子,但氢原子、氧原子不再保持水的化学性质。
⑹物质的化学性质由谁保持,要看构成这种物质的粒子是什么?
若构成这种物质的粒子是分子,则分子保持这种物质的化学性质。
如氢气是由氢分子构成的,氢分子保持了氢气的化学性质。
若构成这种物质的粒子是原子,则原子保持这种物质的化学性质。
如金属铁是由铁原子构成的,铁原子保持了金属铁的化学性质。
所以,分子是保持物质化学性质的一种粒子。
三、利用比较,辨明概念
本单元中的几组概念(“分子与原子”、“原子与离子”、“元素与原子”等)既微观又抽象,若将它们分别进行比较,就能达到辨清异同、防止混淆、加深理解的目的。
例如,原子与离子,可用列表法比较如下:
四、找出联系,理顺概念
本单元所学内容集中了九年级化学全部概念的三分之一,全部的元素符号和部分的化学式,以及原子的结构、化合价、根据化学式的计算等内容,涉及的知识多而杂。
因此,在复习时,应把学过的主要知识进行综合、归纳、分类和系统化,把学过的基础知识整理成“知识点”,把相互联系的概念连接成“知识线”,最后交织成“知识网”。
这样可避免知识零碎、不成系统,避免死记硬背。
连同前面内容和本单元内容,围绕“物质”形成了一系列概念,可总结出如下关
系图:
关系图一旦形成,你就应该读图,将关系图纳入自己的知识结构中,使概念真正系统化。
五、重视运用,巩固概念
掌握概念就是为了运用概念。
运用过的概念对你来说才更为亲切。
概念的每一次运用,都会使你对概念的理解和掌握更全面、更深刻。
例1 计算以下粒子中质子数和核外电子数。
具有相同质子数和相同核外电子数的两种粒子,它们不可能是( )
A.两种不同的离子 B.两种不同的分子
C.一种分子和一种离子 D.一种分子和一种原子
分析 H、N、O、F、Ne、Na原子的质子数(或电子数)分别是1、7、8、9、10、11。
H2O分子由2个H原子和1个O原子构成,则H2O分子的质子数(或电子数)为1×2+8=10;同理NH3分子的质子数(或电子数)为10;Na+离子的质子数为11,电子数为11-1=10;F-离子的质子数为9,电子数为9+1=10。
NH4+和Na+是质子数为11,电子数均为10的不同的离子(还有OH-和F-是质子数为9,电子数均为10的不同的离子),A错;CH4和H2O是质子数与电子数均为10的不同的分子,B错;CH4、H2O、NH3与Ne的质子数与电子数均相等,然而一个是分子另一个是原子,D错。
正确的选项是C。
答案 C
例2 已知铁有两种氧化物,其中铁的化合价分别是+2、+3。
写出这两种氧化物的化学式,并计算两种氧化物中铁元素的质量分数。
分析 已知铁为+2价,氧为-2价,由于化合物中正负化合价的代数和为零,所以这种铁的氧化物的化学式为FeO。
在FeO中,铁元素的质量分数=56/(56+16)×100%=77.8%。
已知铁为+3价,氧为-2价,则这种铁的氧化物的化学式为Fe2O3。
在Fe2O3中,铁元素的质量分数=56×2/(56×2+16×3)×100%=70%。
答案 FeO Fe2O3 77.8%(FeO) 70%(Fe2O3)
例3 碘元素具有预防和治疗甲状腺肿的作用,人体缺碘时易患粗脖子病。
为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐。
所谓碘盐就是在食盐中加入一定量的碘酸钾。
下表为湖北省盐业公司专营的“云鹤牌”精制碘盐包装袋上的部分文字说明:
配料表
食用盐、碘酸钾
含碘量
(20mg~40mg)/kg
保质期
18个月
食用方法
待食物烹调好后再放入碘盐,勿长时间炖炒
贮藏指南
避热、避光、密封、防潮
⑴已知碘酸钾的化学式为KIO3,
①碘酸钾中碘元素的化合价为 。
②碘酸钾的相对分子质量为 。
③一定量的碘酸钾中含有20g碘,则碘酸钾的质量为 g。
⑵由食用方法和贮藏方法,可推测碘酸钾的化学性质之一是 。
⑶若1000g碘盐中约含20mg碘,
①这里标明的碘的含量是指( )
A.碘单质 B.碘元素 C.碘原子 D.碘分子
②已知成人每天约需0.15mg碘,假设这些碘主要是从碘盐中摄取的,则成人每天需要食用碘盐 克?
分析 ⑴①在KIO3中,K为+1价、O为-2价,设I的化合价为x,则:
(+1)+x+(-2)×3=0,x=+5。
⑴②碘酸钾的相对分子质量=39+127+16×3=214。
⑴③设碘酸钾的质量为y,则:
y×127/214=20g,y=33.7g。
⑵由于碘盐食用时勿长时间炖炒,贮藏时应避热,由此推断碘酸钾受热易分解。
⑶①元素是宏观概念,这里标明的碘的含量指的是碘元素的含量。
⑶②每天需食用碘盐的质量=1000g×0.15mg/20mg=7.5g
答案 ⑴①+5 ②214 ③33.7g ⑵受热易分解 ⑶①B ②7.5g
练习题
1.冰岛火山灰曾严重影响欧洲飞机的正常飞行。
火山灰是细微的火山碎屑物,它质地坚硬、不溶于水,含有硫、钙、硅、氧及重金属等成分。
这里所说的成分是指( )
A.元素 B.原子 C.分子 D.单质
2.生活中的下列现象,用分子的相关知识解释,其中不正确的是( )
A.室内插花,满室飘香,说明分子不断地运动
B.热胀冷缩,说明分子大小随温度而改变
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子之间有间隔
D.湿衣服放在火炉旁,干得较快,说明分子运动速率随温度升高而增大
3.食醋是一种调味品,其中含有少量醋酸。
下列有关醋酸的说法不正确的是( )
A.醋酸分子是有碳、氢、氧三种原子构成的
B.醋酸中碳元素的质量分数为40%
C.醋酸是由碳、氢、氧三个元素组成的
D.每个醋酸分子中有8个原子核
4.下列关于耐高温新型陶瓷氮化硅(Si3N4)的叙述正确的是( )
A.氮化硅中硅、氮元素的质量比为3:
4 B.氮化硅中氮元素的质量分数为45%
C.140g氮化硅中含硅元素的质量为84g D.氮化硅的相对分子质量为140g
5.下面是某学生学完化学用语后的一次练习的部分内容,其中不正确的是( )
A.2MnO42-:
表示2个高锰酸根离子
B.维生素C(C6H8O6):
表示该物质由三种元素组成,该分子中含20个原子
C.Ar:
可表示1个氩分子由1个氩原子构成
D.2O:
表示2个氧原子
6.航天飞船常用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,高氯酸铵中氯元素的化合价为( )
A.+1 B.+3 C.+5 D.+7
7.下列化学式中,书写错误的是( )
A.氧化钙 OCa B.氧化镁MgO C.氯化铁FeCl3 D.三氧化硫SO3
8.如图,这四位同学描述的可能同是下面的哪一个化学符号( )
A.HClO B.O3 C.OH- D.CO2
9.如图是元素周期表的一角,据此你能获得哪些关于钠元素的信息。
⑴ ;
⑵ ;
⑶ 。
10.在元素周期表中,横行叫做“周期”,其周期数与该原子的电子层数相同;纵行叫做“族”,其数值与该原子的最外层电子数相同,且某元素的原子序数等于该元素的质子数。
请将第三周期,第二族的元素,其原子的各个内容填入下表:
原子序数
原子结构示意图
中子数
相对原子质量
离子符号
化合价的表示
其氧化物的化学式
12
11.有下列物质:
A.硫酸铜;B.氧化镁;C.碳酸钙;D.石灰水;E.加热高锰酸钾反应后的剩余物;F.水银;G.硫磺;H.红磷燃烧后的产物;I.氖气;J.山泉水。
其中属于混合物的有 ;属于纯净物的有 ;属于单质的有 ;属于金属的有 ;属于非金属的有 ;属于稀有气体的有 ;属于含氧化合物的有 ;
12.⑴向容积为250mL的细颈玻璃仪器A中加水至虚线处,再滴几滴红墨水,一段时间后,A中的现象是_____________,说明______________。
⑵继续向A中加酒精至凹液面最低处正好与刻度线相切。
塞紧玻璃塞,将A中液体倒转摇匀,重复2次。
静置一段时间后,A中的现象为______________,说明____________。
仪器A细颈部的作用是_________________。
13.锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。
已知葡萄糖酸锌的化学式为C12H22O14Zn。
请回答:
⑴葡萄糖酸锌是由___________种元素组成的。
⑵葡萄糖酸锌中所含锌元素的质量分数为__________(结果保留至0.1%)。
⑶现有一支20mL的葡萄糖酸锌口服液,其中含锌6.5mg,那么该口服液中葡萄糖酸锌的质量是_________mg。
答案
1.A 2.B 3.C 4.C 5.A 6.D 7.A 8.B
9.⑴钠的元素符号为Na ⑵钠的原子序数(或质子数)为11 ⑶钠元素的相对原子质量为22.99
11.DEJ ABCFGHI FGI F GI I ABCH
12.⑴整瓶水变红 分子在不断运动 ⑵液面低于刻线且距离较远 分子间存在间隙 便于观察液面变化 13.⑴4 ⑵14.3% ⑶45.5
化学式与化合价学习要点归纳
黑龙江省宁安市石岩学校 徐国成
要点一、化学式
1.化学式的概念:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2.化学式的意义
化学式的表示的意义
以CO2为例来说明
宏观
意义
①表示一种物质
①表示二氧化碳这种物质
②表示该物质是由哪些元素组成的
②表示二氧化碳是由碳元素和氧元素组成的
微观
意义
③由分子构成的物质的化学式可以表示该物质的一个分子
③表示一个二氧化碳分子
④表示该物质的一个分子是由哪些原子构成的
④表示一个二氧化碳分子是由二个氧原子和一个碳原子构成的
由于目前教材不要求学生区分哪些物质是由分子构成的哪些物质是由离子构成的,因此我们还可以把化学式的一般意义归纳成以下三条:
①表示一种物质。
②表这种物质是由哪些元素组成的。
③表示组成这种物质的各元素的原子个数之比。
例如高锰酸钾的化学式为KMnO4它所能表示的含义为:
①表示高锰酸钾这种物质。
②表示高锰酸钾是由钾元素、锰元素、氧元素组成的。
③表示高锰酸钾中钾元素、锰元素、氧元素的原子个数之比为1:
1:
4。
3.化学式的书写
(1)单质的化学式的书写
单质种类
化学式书写方法
书写示例
解释
稀有气体
用元素符号表示
氦气:
He
氖气:
Ne
稀有气体都是由原子直接构成的
金属
用元素符号表示
铁:
Fe,铜:
Cu等
金属也都是由原子直接构成的
常温下为固态的大多数非金属
用元素符号表示
硫:
S,碳:
C等
固态非金属的结构比较复杂,因此规定直接用元素符号表示它们的化学式
由双原子或多原子分子构成的非金属
先写出组成该非金属的元素符号,再在元素符号右下角标出原子个数来表示它们的化学式
氧气:
O2
氢气:
H2
臭氧:
O3等
这样不但能表示该非金属是由什么元素的组成的,还能表示它的分子构成
(2)化合物的化学式的书写
由于化合物是由不同种元素组成的纯净物,因此在书写某化合物的化学式时不但要知道这种化合物是由哪几种元素组成的,还要知道组成这种化合物的各元素的原子个数之比。
知道了这些信息后,就可以先把组成这种物质的各元素的符号按一定顺序写在一起,然后再在元素符号右下角写上小数字来表示该物质的一个分子里所含该元素的原子个数。
把组成化合物的各元素的符号写在一起时的顺序是:
①氧化物的化学式,一般把氧的元素符号写在右边,另一种元素的符号写在左边。
②由金属元素与非金属元素组成的化合物,一般把金属的元素符号写在左边,非金属元素的符号写在右边。
③学习了化合价以后,一般把显正价的元素符号写在左边,把显负价的元素符号写在右边。
标化学式里各元素的原子个数时,当原子个数是1时,1可以省略不写。
要点二、化合价
1.化合价的概念:
一种元素一定数目的原子跟其他元素一定数目的原子相互化合的性质叫做化合价。
2.化合价的主要作用:
利用化合价可以推求实际存在的化合物的化学式。
3.化合价的一般规律:
(1)化合价有正价和负价。
①氧元素通常显-2价,氢元素通常显+1价。
②金属元素跟非金属元素化合时,金属显正价,非金属显负价。
(2)一些元素在不同的物质中可显不同的化合价。
例如,FeO中铁显+2价,Fe2O3中铁显+3价。
(3)在化合物里正负化合价的代数和为0。
(4)在单质里元素的化合价为0。
(因为元素的化合价是元素的原子在形成化合物时表现出来的一种性质,所以在单质里元素的化合价为0)
4.化合价的应用
(1)根据化合价推求实际存在的物质的化学式
例题1、写出氧化铝的化学式
解:
①写出组成氧化铝的两种元素的符号,显正价的写在左边,显负价的写在右边:
AlO
②求两种元素的化合价的绝对值的最小公倍数,因为铝显+3价氧显-2价:
3×2=6
③求化学式里个元素的原子个数:
最小公倍数÷元素的化合价
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 初中 基本 实验 操作
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《Java程序设计》考试大纲及样题试行.docx
《Java程序设计》考试大纲及样题试行.docx
